ОРВИ: не «короной» единой
Человечество уже больше двух лет находится в состоянии перманентной войны с коронавирусом SARS-CoV-2: на начало 2022 г. от COVID-19, по официальным оценкам, погибли около 5,5 млн человек, или 0,07 % населения планеты. Неудивительно, что на фоне этой борьбы на второй план отошли другие опасные инфекционные агенты, вирусные и бактериальные, которые также вызывают острые респираторные заболевания у человека и животных. А между тем об их существовании не стоит забывать, ведь до появления SARS-CoV-2 именно эти инфекции были одной из главных причин смертности в мире
По данным Всемирной организации здравоохранения, респираторные инфекции занимают первое место в рейтинге болезней, измеряемом потерянными годами жизни в результате смерти или инвалидности. В свою очередь, инфекции нижних дыхательных путей являются третьей по значимости причиной смертности даже в развитых странах, а в развивающихся занимают лидирующую позицию.
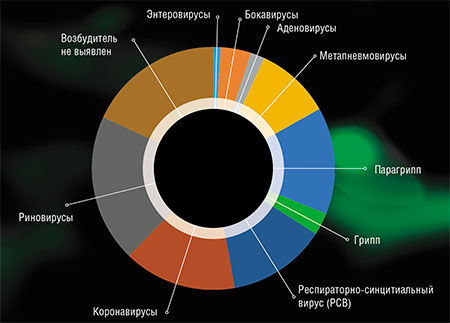
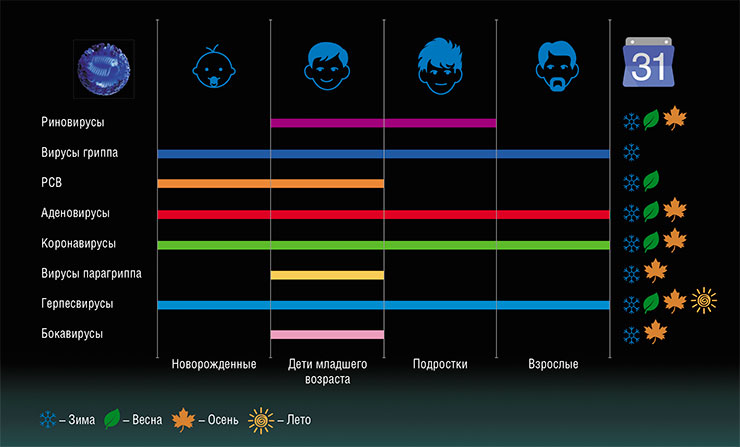
У детей вирусы ответственны более чем за 90 % всех случаев поражений верхних дыхательных путей и примерно за половину – нижних. Для взрослых характерно аналогичное распределение, однако нижние дыхательные пути у них чаще инфицируются патогенными бактериями.
Клинические проявления всех респираторных заболеваний варьируют от бессимптомных случаев до смертельных. Многие вирусы «нацелены» лишь на определенный участок дыхательной системы, в то время как другие менее избирательны. Вирусы гриппа, парагриппа, метапневмовирусы и некоторые аденовирусы в основном поражают нижние дыхательные пути, а риновирусы и коронавирусы – верхние.
Источником вирусной инфекции в большинстве случаев является другой человек, однако некоторые вирусы могут передаваться человеку от животных, как домашних, так и диких. К примеру, появляются новые штаммы вируса гриппа, которые ведут свое происхождение от вирусов гриппа птиц или свиней. А еще недавно малоизвестные коронавирусы, вызывающие сезонные ОРВИ, могли произойти от вирусов летучих мышей и грызунов.
Из патогена – в вакцинный вектор
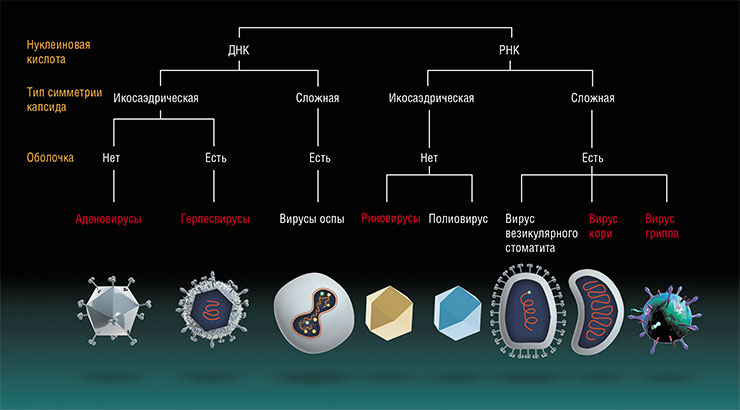
Наш список «простудных» вирусов возглавляют аденовирусы (Adenoviridae), и не только потому, что идут первыми по алфавиту. Во-первых, эти вирусы являются одной из главных причин заболеваний как верхних, так и нижних дыхательных путей человека, в первую очередь у детей. К примеру, есть мнение, что в возрасте до 4 лет аденовирусы вызывают около 15 % всех ОРЗ.
 Вспышки этой инфекции наиболее часты в начале учебного года и во время призывов в армию. Аденовирусы очень устойчивы и могут сохранять свою вирулентность (способность заражать организм), даже находясь в воде и на поверхности предметов домашнего обихода в течение нескольких недель.
Вспышки этой инфекции наиболее часты в начале учебного года и во время призывов в армию. Аденовирусы очень устойчивы и могут сохранять свою вирулентность (способность заражать организм), даже находясь в воде и на поверхности предметов домашнего обихода в течение нескольких недель.
Семейство аденовирусов делят на 7 групп (A–G), которые генетически значительно различаются. Каждая группа дополнительно делится на серотипы/генотипы. Для верхних дыхательных путей человека опасны некоторые представители групп В, C и E, причем наиболее тяжелые случаи связаны с заражением аденовирусами группы B. Так, считается, что более одной пятой всех случаев заражения аденовирусами были вызваны аденовирусом 7‑го серотипа из группы B.
Но аденовирусы представляют интерес для человека не только из-за своей патогенности. Именно эти распространенные и очень хорошо изученные инфекционные агенты часто используются в качестве носителей-векторов для создания средств генной терапии и вакцин. Сегодня благодаря успехам генной инженерии можно так изменить геном вируса, что он либо вообще не сможет сам размножаться, либо будет размножаться только в «нужном месте» – это делает его управляемым и предсказуемым.
Важным свойством аденовирусов является их высокая иммуногенность, т. е. способность вызывать сильный иммунный ответ – как к своим собственным белкам, так и к чужеродным, которые кодируются «чужими» генами, добавленными в их геном. Аденовирусы выбирают в качестве носителей еще и потому, что они могут эффективно заражать определенные типы клеток, устойчивы к изменениям температуры и их легко выращивать.
Среди известных 57 серотипов аденовирусов в качестве векторов для вакцин чаще всего используется 5‑й серотип (HAdV‑5), обладающий выдающейся иммуногенностью, а также 26‑й серотип. Однако сейчас на эту роль претендуют и другие аденовирусы, в том числе вирусы животных, что связано с клинически доказанным снижением эффективности вакцин на основе HAdV‑5. Причина в том, что этот аденовирус распространен повсеместно, поэтому многие люди уже имеют против него антитела (Afkhami, Yao, Xing, 2016).

Именно на основе аденовирусов разработаны и многие вакцины против COVID‑19, включая российские. «Спутник V» – двухкомпонентный: в состав первого компонента входит аденовирусный вектор на основе 26‑го серотипа, в который встроен ген поверхностного S-белка SARS-CoV‑2, второго – вектор на основе 5‑го серотипа.
Аденовирус 5‑го серотипа стал основой и вакцины китайской компании CanSino Biologics, которую Министерство обороны Китая официально разрешило использовать для вакцинации врачей некоторых армейских подразделений еще 25 июня 2020 г. – за полтора месяца до регистрации «Спутника V». Стоит упомянуть и вакцину AZD1222 производства компании AstraZeneca, созданную на основе аденовируса шимпанзе.
Коронавирусы: дамоклов меч
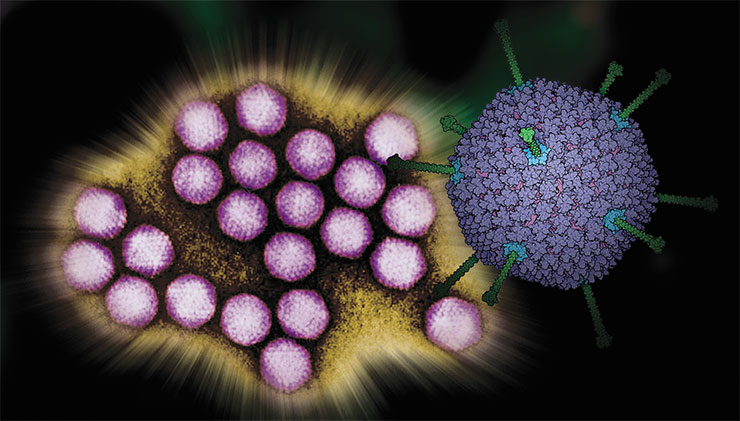
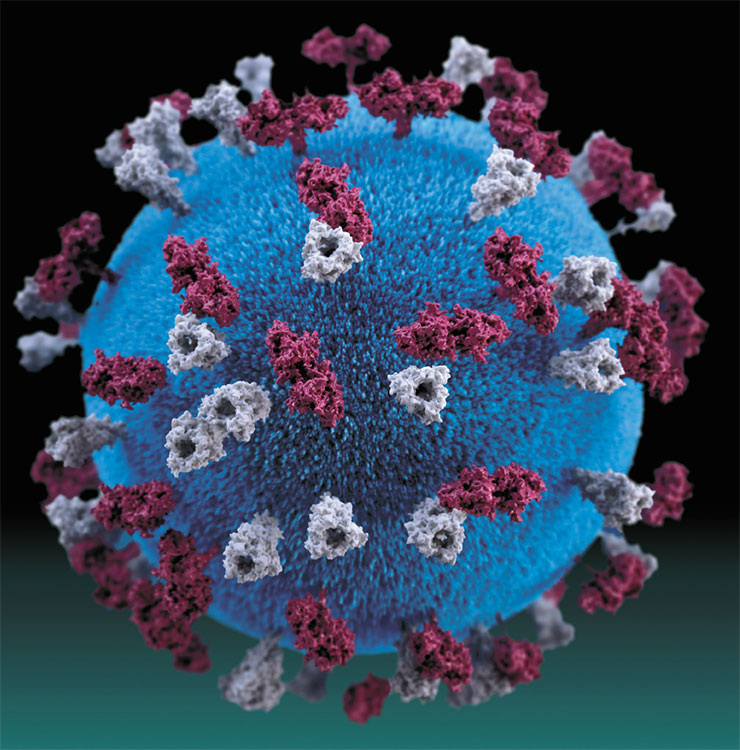
Коронавирусы (Coronaviridae) названы так благодаря характерным шипам на поверхности вирусных частиц – белкам S-гликопротеинам, которые на изображениях, полученных с помощью электронной микроскопии, образуют вокруг вирусных частиц нечто вроде солнечной короны.
КОРОНАВИРУС КОРОНАВИРУСУ РОЗНЬ. ИЛИ НЕТ? Так называемые сезонные коронавирусы (HCoV‑229E, -OC43, HCoV-NL63, -HKU1) постоянно циркулируют среди населения, являясь причиной до 30 % всех инфекций дыхательных путей. А поскольку генетически они родственны SARS-CoV‑2, возбудителю COVID‑19, то уже с начала пандемии активно обсуждается вопрос о возможности кросс-реактивности и кросс-нейтрализации антител против разных видов коронавирусов. Другими словами, об их способности связываться с антигенами близкородственных видов коронавирусов либо препятствовать заражению ими.Специалисты лаборатории фармакогеномики ИХБФМ СО РАН (Новосибирск) с помощью технологии секвенирования нового поколения идентифицировали возбудителя у трех пациентов с признаками ОРВИ – им оказался сезонный коронавирус HCoV-OC43. Все эти люди были вакцинированы «Спутником V» и демонстрировали после вакцинации высокий уровень антител к поверхностному S-белку SARS-CoV‑2, с помощью которого вирус прикрепляется к клетке. Это означает, что, несмотря на сходство таких белков у разных коронавирусов, антитела против них не проявляют кросс-нейтрализующую активность. В этом смысле люди, переболевшие сезонными коронавирусами, по-видимому, также не имеют эффективной защиты от «нападения» SARS-CoV‑2 (Корюков, Кечин, Шамовская и др., 2022).
Подчеркнем, что в этом случае речь идет об антителах именно к поверхностному белку-шипу, который значительно варьирует даже у самого SARS-CoV‑2. Однако недавно британские исследователи обнаружили перекрестно-реактивный иммунный ответ на SARS-CoV‑2, который обеспечивается так называемым Т-клеточным иммунитетом.
Именно специфические Т-лимфоциты, способные распознавать и уничтожать зараженные клетки, обеспечивают долгосрочную защиту от патогена. И результаты обследования семей, в которых имелись больные COVID‑19, показали, что Т-лимфоциты переболевших сезонными коронавирусными инфекциями хорошо узнают внутренние белки вируса SARS-CoV‑2. При этом количество этих иммунных клеток коррелировало с эффективностью защиты от заболевания. А поскольку внутренние белки коронавирусов гораздо менее изменчивы, чем поверхностные, это может способствовать защите и от новых штаммов SARS-CoV‑2 (Kundu, Narean, Wang et al., 2020)
Первые коронавирусы, идентифицированные в 1960‑х гг., не представляли особого интереса для исследователей, поскольку было установлено, что они вызывают лишь типичные симптомы простуды. Репутация этих патогенов кардинально изменилась с появлением в начале 2000‑х гг. SARS-CoV‑1 – возбудителя тяжелого острого респираторного синдрома, известного как атипичная пневмония. Во время вспышки в 2003 г. летальность составила 11 % (Consensus document on the epidemiology of severe acute respiratory syndrome (SARS)…, 2003). После этого отношение исследователей к этой группе вирусов заметно изменилось, и с тех пор было идентифицировано огромное число различных коронавирусов человека и животных. Помимо респираторных были описаны вирусы, вызывающие гастроэнтерит, гепатит и энцефалит у мышей и перитонит у кошек.
В связи с постоянным открытием новых коронавирусов их систематика часто меняется. На сегодня подсемейство Orthocoronaviridae делится на 4 рода (α, β, γ, δ). Среди них для человека опасны представители α- и β-коронавирусов. К последним относится не только всем известный SARS-CoV‑2, но и MERS-CoV, возбудитель ближневосточного респираторного синдрома. Этот патоген с осени 2012 г. до начала 2020 г. инфицировал более 2,5 тыс. человек, из которых около трети умерли.
Основным природным резервуаром коронавирусов признаны летучие мыши. Эпидемия COVID‑19, начавшаяся в 2019 г. в Китае и переросшая в пандемию, стала драматическим напоминанием, что коронавирусы животных представляют серьезную угрозу для человечества, поскольку в результате мутаций может появиться крайне опасный для нас вирус. Насколько велико разнообразие этих коронавирусов и их хозяев, до сих пор неизвестно. К примеру, в случае с MERS-CoV его промежуточным хозяином стал одногорбый верблюд. Поэтому невозможно предсказать, где и когда следует ждать вспышки новой коронавирусной инфекции.
Пикорнавирусы: клин клином вышибать
Представителей семейства пикорнавирусов (Picornaviridae) можно отнести к самым распространенным патогенам респираторной системы человека: к примеру, в 2014 г. они стали причиной более чем 35 % случаев ОРВИ в РФ. В мировом масштабе эта цифра варьирует в пределах 20–30 %, что делает эти вирусы одними из главных возбудителей ОРВИ.
Это большое семейство включает более 30 родов и 75 видов, большинство из которых заражает млекопитающих и птиц. Многие пикорнавирусы человека могут вызывать заболевания не только верхних дыхательных путей, но и центральной нервной системы, печени и желудочно-кишечного тракта.
ВИРУСЫ ПРОТИВ ОПУХОЛЕЙ Среди огромного множества самых разных вирусов есть немало опасных, а нередко и смертельных для человека. Однако благодаря одному свойству вирусов – способности размножаться только в живой клетке – они могут использоваться в качестве терапевтических средств при лечении онкологических заболеваний (Нетесов, Чумаков, 2013; Нетесов и др., 2017).Все дело в том, что клетки опухоли являются для вирусов идеальной мишенью: они физически более доступны для заражения и активно делятся, что «на руку» этим внутриклеточным паразитам, целью которых является захват синтетического аппарата клетки, который они используют для размножения. При этом развитие генной инженерии позволяет создавать вирусы, обладающие способностью распознавать, поражать и уничтожать только раковые клетки, не затрагивая здоровые.
Сейчас в роли онколитических вирусов очень активно исследуются уже хорошо изученные энтеровирусы, аденовирусы и др. И это понятно, поскольку многие из них либо практически не патогенны для человека, либо вызывают очень легкое заболевание. Главное достоинство такого лечения – минимум побочных эффектов по сравнению с широко применяющейся химио- и радиотерапией. Но, несмотря на это, к такому методу терапии рака до сих относятся скептически, опасаясь проявления патогенных свойств самого «лекарства»
Клинически значимым является род энтеровирусов (Enterovirus). Большая их часть является патогенами желудочно-кишечного тракта, однако ряд из них (некоторые штаммы вирусов Коксаки, эховирусов и др.) является возбудителями респираторных заболеваний. К этому роду относятся и риновирусы – основная причина ОРВИ в мире. К счастью, в большинстве случаев эти заболевания протекают в легкой форме.
Как правило, лекарственной терапии при риновирусной инфекции не требуется. Известно, что большая часть штаммов лучше размножается в носовой полости, где температура ниже, чем в легких: 33–35 и 37 °C соответственно. Размножение риновирусов приводит к устойчивой секреции интерферонов – белков с противовирусными свойствами, что в конечном итоге приводит к повышению температуры тела, ограничивающему распространение вируса. Поэтому снижение субфебрильной температуры с помощью жаропонижающих может усугубить болезнь.
Разработка как специализированных лекарств, так и вакцин против риновирусов представляется практически невозможной, поскольку они подразделяются более чем на 99 различных серотипов.
С другой стороны, есть мнение, что переболеть «легкой простудой» иногда даже полезно. К примеру, риновирусная инфекция может защитить от намного более опасного заражения коронавирусом SARS-CoV‑2. Предполагается, что она способствует снижению пиковой вирусной нагрузки при COVID‑19 благодаря активации синтеза интерферонов как важнейшего компонента врожденного неспецифического иммунитета. С другой стороны, риновирусная инфекция стимулирует производство рецепторов ACE2, которые SARS-CoV‑2 использует для проникновения в клетку. Так что о роли этой и других вирусных инфекций в защите от COVID‑19 пока трудно судить.
Зато известно, что периодические лихорадки, вызванные инфекционными заболеваниями, могут снижать риск развития онкологических болезней (Kleef, Jonas, Knogle et al., 2001; Repasky, Evans, Dewhirst, 2013; Kozak, Jedrzejewski, Pawlikowska et al., 2018). Конечно, это не означает, что нам нужно специально заражаться риновирусами или другими «простудными» патогенами, – они и сами нас найдут.
Парамиксовирусы: от «свинки» до парагриппа
Представители очень разнородного семейства парамиксовирусов (Paramyxoviridae) чаще всего вызывают у человека респираторные заболевания с легким течением, однако в некоторых случаях могут наблюдаться тяжелые обострения.
К особо опасным относятся вирусы кори, парагриппа, паротита («свинки»), а также вирус Нипах, который может вызывать энцефалит. Последний вирус по своему эпидемическому поведению похож на SARS-CoV‑2: распространяясь в основном среди представителей рукокрылых, он периодически вызывает эпидемические вспышки в Южной Азии, создавая угрозу новой пандемии.
Наиболее распространены вирусы парагриппа, среди которых выделяют 4 основных типа, вызывающие заболевания разной тяжести. Именно этот вирус чаще всего служит причиной крупа – затруднения дыхания вследствие сужения просвета гортани.
Остальные известные на сегодня парамиксовирусы пока не заражают человека, однако вызывают серьезные заболевания у птиц, летучих мышей, собак и других животных, представляя потенциальную угрозу для людей. Что касается вирусов кори и паротита, которые не имеют других природных «резервуаров» помимо человека, то их в принципе можно искоренить с помощью вакцинации, учитывая наличие действенных вакцин.
Однако в последнее время в ряде стран наблюдается оживление антивакцинаторского движения, в том числе против трехкомпонентной вакцины, направленной одновременно против кори, паротита и краснухи. Одной из побудительных причин стала работа врача Э. Уэйкфилда (1998), где он утверждал о наличии связи между этой вакциной и аутизмом. Его статья, впоследствии отозванная из-за фальсификации данных, получила широкую известность не только среди ученых, поскольку выжимки из нее были опубликованы во многих газетах.
В результате до сих пор случаются вспышки этих заболеваний, примером чего могут служить массовые заболевания корью в 2019 г. в США и других странах. По данным ВОЗ, в тот год только в Конго было выявлено свыше 310 тыс. случаев этой болезни, причем более 6 тыс. – со смертельным исходом.
Пневмовирусы – провокаторы астмы
Группа пневмовирусов (Pneumoviridae) была лишь недавно выделена в отдельное семейство из парамиксовирусов. Как видно из названия, эти вирусы поражают дыхательную систему.
На сегодня семейство включает два рода и пять видов. Наиболее известен респираторно-синцитиальный вирус (РСВ), который хотя бы раз обнаруживается почти у всех детей в возрасте до 2 лет, при этом пневмония развивается лишь в 0,1–0,8 % случаев. Однако, если инфицирование этим вирусом в первые годы жизни протекает с осложнениями (например, с развитием бронхиолита), оно служит фактором риском развития астмы. Поэтому желательно иметь возможность профилактики этой инфекции, но на сегодня разработаны лишь кандидатные вакцины.
Отдельный род составляют метапневмовирус птиц (AMVP) и метапневмовирус человека (HMPV), впервые обнаруженный в 2001 г. Геномы этих двух вирусов очень схожи, однако человеческий оказался неспособным размножаться в птицах (Williams, Shafagati, 2019). Так что, если метапневмовирус человека и возник изначально как зоонозная инфекция, сейчас он адаптирован исключительно к человеческому организму.
Подобно многим другим респираторным патогенам, HMPV вызывает тяжелые заболевания преимущественно у младенцев, пожилых и людей с хроническими заболеваниями, такими как астма и эмфизема. У детей пик заболеваемости приходится на второе полугодие первого года жизни. Эта инфекция так же, как РСВ, служит фактором риска развития астмы. Подавляющее большинство людей в первые пять лет жизни хотя бы раз сталкиваются с HMPV, однако возможно и повторное инфицирование на протяжении всей жизни.
Бессимптомное течение этой болезни наблюдается крайне редко. Усугубить течение болезни могут сопутствующие вирусные или бактериальные инфекции. По некоторым данным, частота сочетанной инфекции для этой группы вирусов колеблется от 6 до 23 %.
Грипп: от «испанки» до «птичьего»
Самой тяжелой среди сезонных респираторных инфекций, пожалуй, является грипп, вызываемый вирусами из семейства ортомиксовирусов (Orthomyxoviridae). Эта инфекция традиционно представляет серьезную проблему для здравоохранения, недаром смертность от COVID‑19 сравнивают со смертностью именно от этой ОРВИ.
 Но грипп гриппу рознь. Как известно, эти вирусы поражают не только человека. Так, из 4 типов вирусов гриппа (A–D) лишь вирусы группы B встречаются исключительно среди людей. Вирусы гриппа D поражают крупный рогатый скот и не опасны для человека, тогда как вирусы группы A могут передаваться человеку от свиней и птиц.
Но грипп гриппу рознь. Как известно, эти вирусы поражают не только человека. Так, из 4 типов вирусов гриппа (A–D) лишь вирусы группы B встречаются исключительно среди людей. Вирусы гриппа D поражают крупный рогатый скот и не опасны для человека, тогда как вирусы группы A могут передаваться человеку от свиней и птиц.
Вирусы группы A делят на подтипы на основе двух поверхностных белков: гемагглютинина (H) и нейраминидазы (N). Существует 18 подтипов гемагглютинина и 11 подтипов нейраминидазы, которые потенциально могут составлять 198 различных комбинаций, из них 131 обнаружена в природе.
Некоторые из вирусов этой группы уже вызывали смертоносные вспышки заболеваемости во всем мире. Самый серьезный случай – это пандемия знаменитой «испанки», вспыхнувшая в 1918 г., вызванная вирусом гриппа типа A, подтипа H1N1. Этот вирус образовался путем так называемого антигенного сдвига – процесса, в ходе которого сегменты генома вирусов гриппа свиней, людей и уток перемешались с образованием нового подтипа. По некоторым оценкам, эта инфекция поразила треть населения всего мира, или около полумиллиарда человек, из которых не менее 50 млн погибли (для сравнения: за два года нынешней пандемии от COVID‑19 погибли в десять раз меньше).
Последующие эпидемии гриппа были менее смертоносными: в 1957 г. число жертв «азиатского гриппа» (H2N2) составило более 2 млн человек, а в 1968 г. «гонконгский грипп» (H3N2) унес жизни около 1 млн.
Что касается гриппа B, то из-за меньшего разнообразия гемагглютинина и нейраминидазы его делят только на две линии: B/Yamagata и B/Victoria. И мутируют эти вирусы медленнее, чем гриппа A.
Благодаря антигенному дрейфу – случайным изменениям в генах, меняющим поверхностные белки-антигены, которые распознаются антителами хозяина, – вирусы гриппа успешно ускользают от иммунной системы человека. А из-за высокой антигенной изменчивости периодически появляются абсолютно новые штаммы с новыми свойствами. Поэтому даже вирусы «птичьего» гриппа H5N1, практически не передающиеся от человека к человеку, могут измениться настолько, что станут для нас крайне опасными.
Наиболее эффективным способом борьбы с гриппом считается вакцинация. Сегодня имеется большое разнообразие вакцин, как живых, так и инактивированных, включая субъединичные, состоящие лишь из двух вирусных белков: гемагглютинина и нейраминидазы. Обычно вакцины направлены против двух вирусов гриппа A (H1N1 и H3N2) и одного-двух вирусов гриппа B.
Состав вакцины ежегодно пересматривается за полгода до предстоящего сезона гриппа, поскольку вирусы постоянно эволюционируют. Глобальный мониторинг циркулирующих штаммов гриппа ведется ежегодно, однако дать точные предсказания очень сложно, поскольку процесс антигенного дрейфа случаен.
Существует несколько методов прогнозирования очередного этапа эволюции гриппа. Один из популярных – анализ «родословных» деревьев, с помощью которого можно установить связи между объектами на основе сходств или различий их генома.
К сожалению, механизмы этого феномена, открытого еще в середине прошлого века, до сих пор плохо изучены. Это явление, существование которого было подтверждено в многочисленных исследованиях, еще раз напоминает нам, как сложен иммунный ответ на различные инфекции. А в случае с гриппом наводит на мысль о целесообразности ежегодной вакцинации, эффект от которой может сильно варьировать.
Такой антигенный импринтинг, с одной стороны, может быть полезен для активизации иммунитета против консервативных эпитопов – структур на поверхности вирусных антигенов, распознаваемых антителами или иммунными B-клетками организма. С другой стороны, он может отрицательно повлиять на формирование иммунитета к значительно различающимся, хотя и близкородственным вирусам. В том числе поэтому так важно тщательно подходить к подбору состава вакцин
Современные биоинформационные технологии позволяют прогнозировать будущие вспышки заболеваемости гриппом на основе статистических данных по распространению разных штаммов вируса. Но, используя различные математические подходы при анализе, можно получить и разные результаты. С 2013 г. Центры по контролю и профилактике заболеваний США даже организуют соревнования, в которых исследовательские коллективы со всего мира представляют свои прогностические модели.
При антигенном несоответствии между штаммами вакцины и циркулирующими штаммами гриппа эффективность вакцинации может быть невысока. Другая проблема – существование природного резервуара вирусов гриппа в виде диких водоплавающих птиц. Так что искоренить эту инфекцию практически невозможно. Однако новые инновационные подходы для определения «кандидатов» для вакцин могут повысить эффективность профилактики гриппа.
Бокавирусы: заражаются все
Бокавирус, который относится к семейству парвовирусов (Parvoviridae), был открыт относительно недавно. Впервые его идентифицировали в 2005 г. в мазках из носоглотки детей с респираторными заболеваниями. Как показывают серологические исследования, около 76 % детей и 96 % взрослых имеют антитела к этим вирусам, т. е. за свою жизнь каждый из нас хотя бы один раз был инфицирован.
На сегодня известно уже 4 генотипических варианта бокавируса, которые в основном поражают детей, при этом лишь один (HBoV‑1) вызывает заболевания верхних и нижних отделов дыхательных путей, а остальные – заболевания желудочно-кишечного тракта. При этом считается, что чаще всего люди сталкиваются именно с HBoV‑1.
Роль бокавируса в развитии респираторных заболеваний долгое время не удавалось установить, поскольку в более чем 70 % случаев его обнаруживали вместе с другими вирусами (аденовирусы, риновирусы и др.). Определение истинной роли бокавирусов в развитии этих болезней существенно затрудняет и тот факт, что их до сих пор не удается выращивать в лабораторных условиях.
Респираторная бокавирусная инфекция обычно протекает в легкой форме, часто бессимптомно, однако в некоторых случаях требуется госпитализация.
Герпес – не только на губах
Герпесвирусы (Herpesviridae) – одна из самых распространенных групп вирусов: они способны поражать не только млекопитающих, но и птиц, рептилий, амфибий и рыб.
Человека инфицируют представители нескольких подсемейств и 8 типов этого большого вирусного семейства. Они вызывают целый спектр самых разнообразных заболеваний: от орального и генитального герпеса и ветряной оспы до опоясывающего лишая, синдрома хронической усталости и саркомы Капоши. Первичное инфицирование герпесвирусами происходит, как правило, в детстве, при этом заболевание возникает далеко не у всех – вирус может находиться в скрытом (латентном) состоянии на протяжении всей жизни.
В некоторых случаях заражение этими вирусами приводит к появлению кашля с выделением мокроты, болей в грудной клетке, одышки и даже пневмонии. В первую очередь это относится к герпесвирусам человека 6‑го типа (HHV‑6A и HHV‑6B).
Эти вирусы отличаются способностью встраиваться в геном: около 1 % всего населения мира несут в своей ДНК их гены (Pellett, Ablashi, Ambros et al., 2014). Считается, что интеграция происходит в областях теломер – концевых участков хромосом, причем этот процесс может идти в самых разных клетках организма, что способствует горизонтальной (внутри популяции) и вертикальной (через половые клетки) передаче вируса. В результате распространенность HHV‑6B среди взрослого населения превышает 90 %.
Наличие генетически «встроенного» вируса приводит к тому, что в тканях и жидкостях человека с помощью лабораторных методов может быть ошибочно диагностирована активная инфекция. Важно, что при воздействии некоторых средств противовирусной терапии вирус HHV‑6 может и на самом деле активизироваться.
То же самое может произойти в ситуации подавления иммунной системы человека, в том числе при иммуносупрессивной терапии, назначаемой, к примеру, при трансплантации. Так, вирус HHV‑6B был обнаружен в 165 из 685 образцов пациентов с трансплантированными кроветворными стволовыми клетками (Reid, Lynch, Weigt et al., 2016). В подобных случаях герпесвирусы способны вызывать крайне тяжелые заболевания респираторной системы, такие как острая интерстициальная пневмония, которые нередко заканчиваются смертью. Иммуносупрессивное состояние характерно и для пациентов, находящихся на искусственной вентиляции легких, в том числе при COVID‑10. В этом случае могут обостряться не только герпесвирусные, но и другие инфекции дыхательных путей.
Респираторные заболевания у людей могут вызывать и другие герпесвирусы: цитомегаловирус, вирус Эпштейна – Барра и вирус ветряной оспы (Reid, Lynch, Weigt et al., 2016). Однако такие случаи встречаются крайне редко.
Против герпесвирусов 1–5‑х типов уже существуют эффективные препараты, в первую очередь ацикловир. По своей структуре это органическое соединение очень похоже на азотистое основание гуанин, входящий в состав нуклеиновых кислот. Во время репликации ДНК в зараженной клетке производные ацикловира конкурируют с «нормальным» предшественником нуклеотида, который должен встраиваться в цепь при копировании ДНК. При встраивании в цепь они действуют как терминатор, блокируя работу фермента ДНК-полимеразы и таким образом останавливая синтез вирусной ДНК.
При этом ингибирование репликации будет происходить лишь в клетках, зараженных герпесвирусом. Дело в том, что превращать ацикловир в аналог нуклеотида может лишь вирусный фермент тимидинкиназа, а вот клеточная тимидинкиназа такой способностью не обладает. Этот пример наглядно показывает, как довольно простой (с точки зрения химического дизайна) препарат может избирательно влиять на вирусные ферменты.
Подводя итог, нужно отметить, что клиническая картина заболевания для всех респираторных вирусов очень похожа, так как во всех случаях входными воротами инфекции служат клетки мерцательного эпителия верхних дыхательных путей человека. В свою очередь, «склонность» вирусов к конкретным органам-мишеням определяет ее специфику.
Избежать встречи с респираторными вирусами практически невозможно. И хотя каждый день мы сталкиваемся с огромным числом патогенов, благодаря работе нашей иммунной системы большая часть из них не вызывает серьезных заболеваний. При этом реакция людей на инфицирование очень индивидуальна, и в некоторых случаях могут возникнуть серьезные осложнения. В группу повышенного риска, как правило, входят дети, иммунитет которых только начинает формироваться, а также пожилые люди, поскольку способность их иммунной системы бороться с новыми инфекциями снижается.
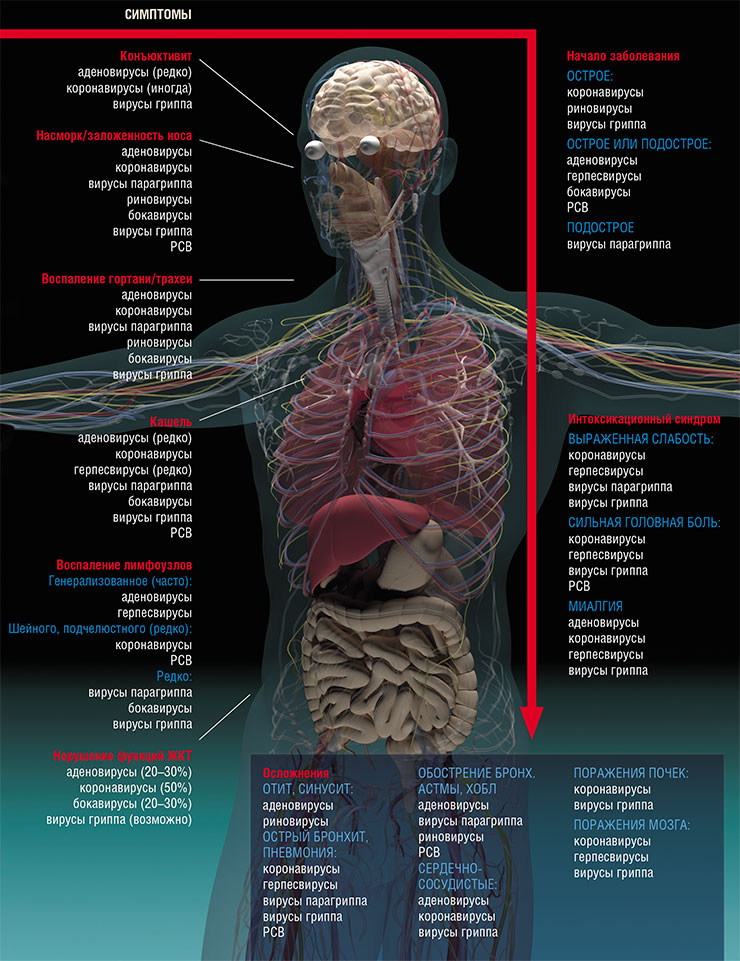
Симптомы многих ОРВИ схожи, поэтому их не всегда удается точно диагностировать. Чаще всего при диагностике опираются на общую симптоматику, визуальный осмотр горла и носа, прослушивание легких. Дополнительно назначается общий анализ крови и мочи, в некоторых случаях – лабораторная диагностика
Большинство заболеваний дыхательных путей не имеют какого-либо специфического лечения. Самым действенным способом борьбы с ними является профилактика, в первую очередь вакцинация – если имеются соответствующие вакцины. Благодаря вспышке COVID‑19 люди начали активно использовать респираторы и дезинфектанты, которые действенны не только против SARS-CoV‑2, но и против других, не менее серьезных вирусных и бактериальных патогенов.
Острые респираторные заболевания до сих пор недооцениваются, поскольку в большинстве случаев протекают в легкой форме и не приводят к потере трудоспособности. Однако не стоит забывать, что иногда они могут повлечь крайне серьезные последствия, причем эта причинно-следственная связь часто может быть неочевидна. Поэтому к профилактике и контролю за распространением этих патогенов нужно подходить более ответственно, чем это было принято до сегодняшнего дня.
Литература
Afkhami S., Yao Y., Xing Z. Methods and clinical development of adenovirus-vectored vaccines against mucosal pathogens // Mol. Ther. Methods Clin. Dev. 2016. V. 3. P. 16030.
Kleef R., Jonas W. B., Knogler W., Stenzinger W. Fever, cancer incidence and spontaneous remissions // Neuroimmunomodulation. 2001. V. 9. N. 2. P. 55–64.
Kupchenko A. N., Ponezheva Z. B. Actual Methods’ of Diagnosis and Treatment Arvi // Arch. Intern. Med. 2016. V. 6. N. 1. P. 6–12.
Pellett P. E., Ablashi D. V., Ambros P. F. et al. Chromosomally integrated human herpesvirus 6: questions and answers // Rev. Med. Virol. 2012. V. 22. N. 3. P. 144–155.
Repasky E. A., Evans S. S., Dewhirst M. W. Temperature matters! And why it should matter to tumor immunologists // Cancer Immunol. Res. 2013. V. 1. N. 4. P. 210–216.