«Слепки» жизни. Полимеры с молекулярной памятью
Специфически связываться с молекулами способны молекулярно импринтированные полимеры (МИПы) - синтетические вещества с «молекулярной памятью». Для этого нужные молекулы добавляются до начала полимеризации, в результате чего в твердом полимерном каркасе остаются «слепки», соответствующие по форме молекулярному «шаблону».
В новосибирском Институте химической биологии и фундаментальной медицины СО РАН предложен новый подход к получению «памятливых» полимеров на основе капрона. Более мягкие условия формирования позволяют сохранить всю внешнюю целостность сложноорганизованного шаблона, в качестве которого могут выступать такие крупные молекулы, как белки или даже биологические объекты (отдельные клетки, вирусы и бактерии).
Читайте другие публикации Д. В. Пышного в журнале «НАУКА из первых рук»! Читайте публикации других сотрудников Института химической биологии и фундаментальной медицины СО РАН (Новосибирск) в журнале «НАУКА из первых рук»!
Мысль о создании веществ, способных заменить природные, а еще лучше – превзойти их, издавна волнует ученых. Но возможно ли создать, например, искусcтвенные антитела, способные распознавать и захватывать чужеродные объекты? Большой шаг в этом направлении уже сделан. Современные технологии получения «слепков» молекул на синтетических полимерах позволяют имитировать процессы природного молекулярного распознавания, причем спектр применения таких памятливых пластиков может быть необычайно широк.
Каждый момент в нашем организме протекает множество саморегулируемых биохимических процессов, о которых мы не задумываемся. Работа ферментативных систем, направленный транспорт молекул, иммунные реакции – вот лишь малый перечень подобных межмолекулярных взаимодействий. Согласованность разнообразных биохимических процессов служит основой «взаимопонимания» между отдельными клетками, которое превращает их скопление в гибкую систему – живой организм, способный к самоконтролю, защите и воспроизведению.
В роли сенсорных элементов, регулирующих большинство внутриклеточных процессов, выступают большие молекулярные конструкции (например, белки-рецепторы), которые способны связываться с биологически активными веществами (лигандами). Таким образом, в основе саморегуляторных механизмов лежит свойственная биополимерам способность распознавать и связывать определенные молекулы с образованием межмолекулярных комплексов.
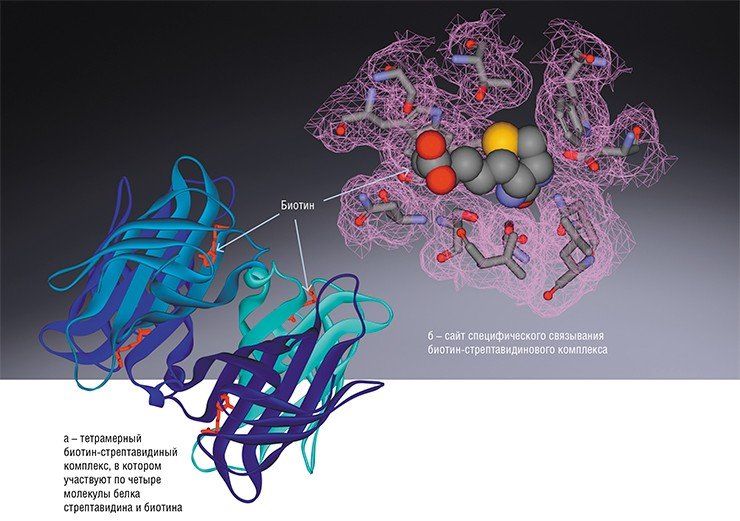
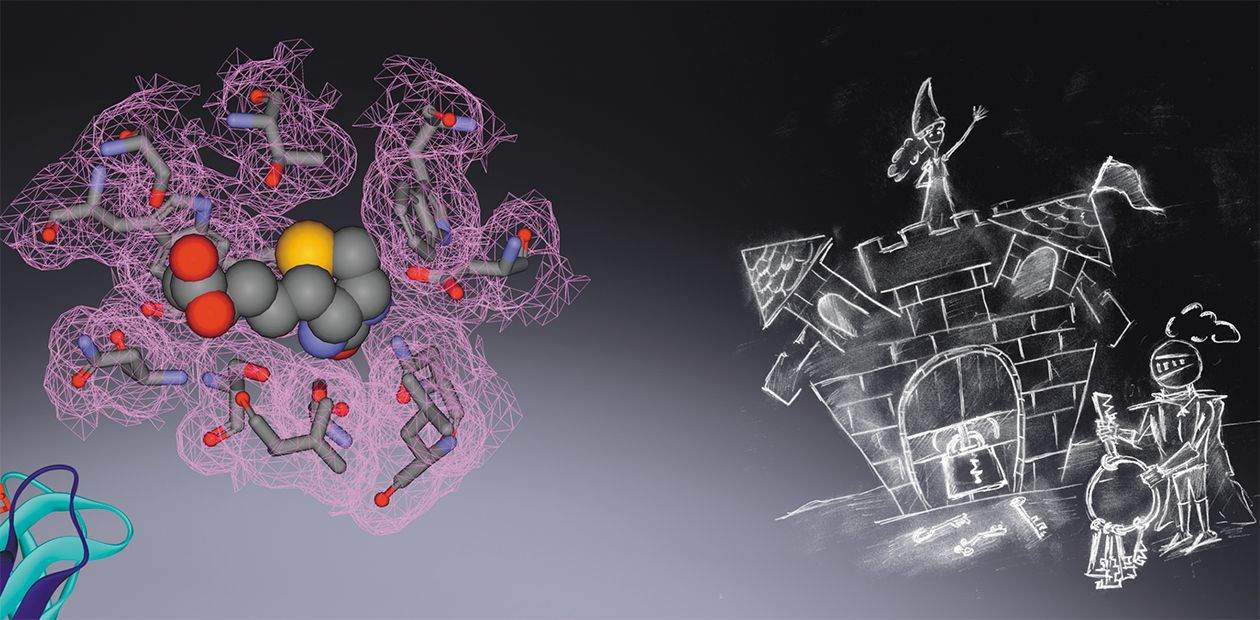
Но чтобы молекулы могли специфически взаимодействовать между собой, они должны подходить друг к другу как ключ к замку, то есть быть взаимно комплементарными. Это означает, что на участке (сайте) молекулы-рецептора, где происходит связывание, должен располагаться набор химических групп, обеспечивающий в том числе и достаточно тесный контакт со всей молекулой лиганда или с ее наиболее важными фрагментами. Другими словами, стенки полости такого сайта должны плотно облегать распознаваемую молекулу.
Наглядной демонстрацией важности специфического распознавания по принципу «ключ–замок» служит взаимодействие антитело–антиген. Как известно, при попадании в организм высших животных и человека чужеродного агента (белка, вируса, бактерии или отдельного белка) специальные иммунные клетки-лимфоциты начинают вырабатывать огромное количество белков-антител. Цель антител – нейтрализовать непрошенного «гостя», для чего в их структуре имеются специальные участки, ответственные за специфичное распознавание и связывание чужака-антигена (к примеру, поверхностного белка вируса гриппа). Поскольку у разных антител эти участки могут значительно различаться, эффективно будут работать лишь некоторые из антител – те, что наиболее «комплементарны» антигену. Популяция клеток, производящих антитела-«победители», будет сохраняться в организме, защищая его от возможной инфекционной интервенции в будущем.
Сегодня высокоэффективные специфичные антитела на различные молекулярные маркеры можно получить с помощью биотехнологических методов. Разработка технологии производства так называемых моноклональных антител (т. е. вырабатываемых одним клоном иммунных клеток) была в 1984 г. удостоена Нобелевской премии по физиологии и медицине. В наши дни моноклональные антитела широко используются в молекулярной диагностике и терапии различных патологий, в том числе некоторых типов онкологических и аутоиммунных заболеваний.
Однако получение таких антител – процесс продолжительный и дорогостоящий, а сами они вне организма недостаточно стабильны. К тому же у метода есть свои ограничения: моноклональные антитела можно получить далеко не на все нужные объекты. Неудивительно, что исследователи стали проявлять большой интерес к синтетическим материалам, способным, как и природные биополимеры, распознавать и прочно связывать разнообразные молекулярные мишени, а также нано- и микроразмерные биологические объекты. Иными словами, речь идет о синтетических аналогах природных антител.
Антитела из пластика
Идея создания искусственных антител была впервые высказана в 1940 г. знаменитым химиком и дважды нобелевским лауреатом Л. Полингом (Pauling, 1940). Через девять лет его ученик Ф. Дики предпринял удачную попытку синтезировать на основе силикатов полимерные матриксы, связывающие краситель метиловый оранжевый (Dickey, 1949). Справедливости ради надо отметить, что двумя десятилетиями ранее русский химик М. В. Поляков (1931) на основе силикагеля создал первые материалы, обладающие повышенной специфичностью к молекуле определенного углеводорода. Чтобы добиться такого эффекта, углеводороды добавлялись в то время, когда твердотельный силикатный каркас еще не был сформирован.
В 1960-е гг. начали появляться публикации, посвященные неорганическим полимерам с повышенным сродством к определенному типу молекул. Однако реальный интерес к новому направлению возник лишь в 1972 г., когда группа профессора Г. Вульфа (Дюссельдорф, Германия) сообщила об успешном синтезе органических полимеров, содержащих «отпечатки» молекул-шаблонов. При их создании шаблоны закреплялись ковалентными связями в исходном материале перед началом его полимеризации (Wulff, 1972). Такие вещества стали называть молекулярно импринтированные полимеры (МИПы), а процесс их получения, соответственно, молекулярным импринтингом.
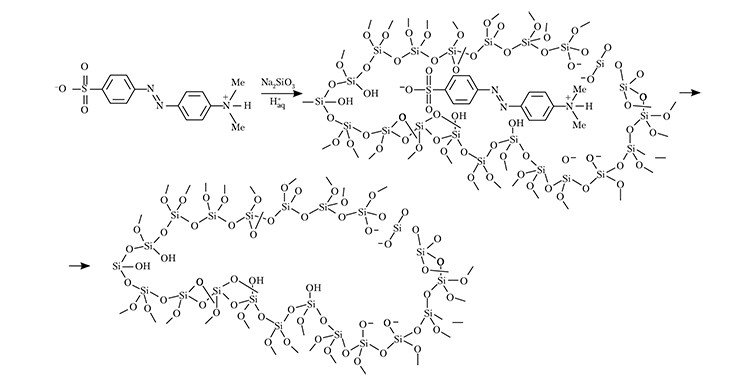
Очередной технологический прорыв в получении МИПов произошел спустя десятилетие, когда импринтированные полимеры удалось получить в присутствии свободных молекул-шаблонов, которые соединялись с исходным материалом будущего твердотельного каркаса за счет уже нековалентных связей (Arshady and Mosbach, 1981). Это открытие вызвало настоящий взрыв интереса к молекулярному импринтингу. С использованием «нековалентной» технологии удалось получить полимеры с отпечатками сложных органических молекул: в конце 1980-х – начале 1990-х гг. были обнародованы первые результаты о создании МИПов, способных к специфическому связыванию молекул белков (Kempe and Mosbach, 1995).
Мечта о создании искусственных «пластиковых» антител начала осуществляться. Однако синтез полимеров, содержащих отпечатки крупных биомолекул и биологических объектов, таких как пептиды, белки или даже целые клетки, до сих пор остается нетривиальной задачей.
Очередной бум в области молекулярного импринтинга произошел летом 2010 г. Причиной послужили работы профессора К. Ши (Калифорнийский университет) и его коллег из Японии, где МИПы выступили в роли «пластиковых» антител в системах in vivo, т. е. непосредственно в живом организме (Hoshino et al., 2010). В качестве подопытных «кроликов» были использованы лабораторные мыши, в качестве чужеродного антигена – пептид мелитин, входящий в состав пчелиного яда и смертельно опасный в больших концентрациях.
Исследователи подобрали композицию на основе замещенных акрилатов, которая при полимеризации в присутствии мелитина давала твердотельный полимерный каркас, который в обычных лабораторных условиях эффективно связывал молекулы токсина. Для введения в кровяное русло использовали наноразмерные частицы полимера.
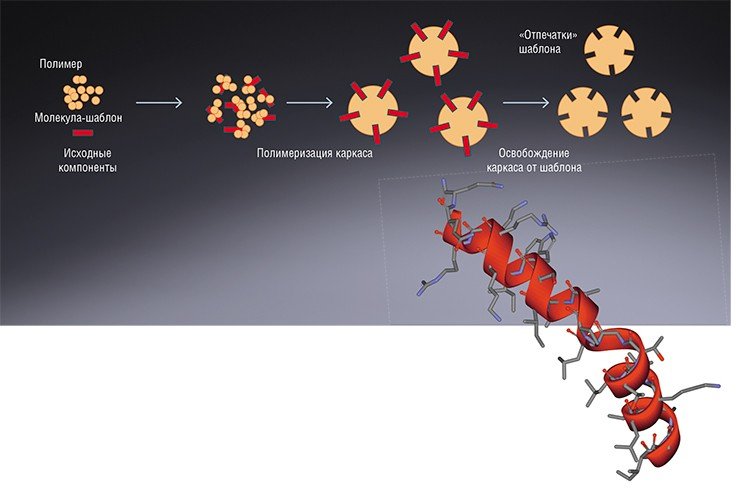
Молекулярная мишень может удерживаться в исходном матриксе, во-первых, за счет тесных «телесных» контактов (типа замок–ключ). Во-вторых, за счет специфичных взаимодействий между функциональными химическими группами шаблона и полимера, таких как водородные связи, электростатические и гидрофобные контакты, координационные взаимодействия и т. д. Таким способом можно синтезировать органические и неорганические полимерные материалы, обладающие своеобразной «молекулярной памятью». В качестве молекулярного шаблона могут быть использованы как относительно простые соединения, например, кофеин, так и высокомолекулярные (белки, вирусы и даже целые клетки)
Всем подопытным мышам вводили смертельную дозу мелитина – животные из контрольной группы действительно погибли через 2 часа. Экспериментальной группе мышей сразу после инъекции токсина вводили «пластиковые антитела» – импринтированные полимерные наночастицы, связывающие мелитин. Еще одной группе мышей делали инъекции наночастицами неимпринтированного полимера, синтез которого осуществлялся в отсутствие шаблона – молекулы мелитина.
Оказалось, что введение «пластиковых антител» имело выраженное дезактивирующее действие: более половины отравленных животных выжили. Кстати сказать, выживаемость повысилась и в контрольной группе, получавшей неимпринтированные наночастицы, хотя и не так значительно, как в экспериментальной.
Очень разборчивые
Хотя работа доктора Ши и его коллег на настоящий момент является единственной, где описывается действие МИПов непосредственно на животных, она убедительно демонстрирует их перспективность для использования в терапевтических целях. Действительно, искусственные «пластиковые» антитела действуют подобно природным, а их накопление и разрушение вместе с захваченным антигеном происходит в печени. И если вспомнить, какое огромное молекулярное разнообразие присутствует в живом организме, то специфичность связывания полимера при таком обилии «конкурентов» поражает.
Однако есть и ряд спорных моментов. Например, исследователи не касались вопроса возможной токсичности «пластиковых» антител; неясной осталась и причина повышения выживаемости животных при введении неимпринтированных полимерных частиц. Кроме того, мелитин все же является относительно простой и небольшой молекулой, поэтому остается открытым вопрос: насколько данная технология будет действенна в отношении более сложных антигенов?
Нужно сказать, что в настоящее время уже интенсивно разрабатываются технологии синтеза полимеров, способных к специфичному распознаванию и связыванию не только белковых шаблонов, но и достаточно больших биологических объектов.
Уже есть примеры успешного импринтинга вирионов (вирусных частиц). Специфичность связывания вирусов на поверхности таких МИПов в большинстве случаев определяется особенностями формы вирусной оболочки. Так, вирус табачной мозаики – широко известный патогенный вирус растений – имеет характерную палочкообразную форму, почему является очень удобным объектом для молекулярного импринтинга. Полученные МИПы оказались способны захватывать вирус не только из растворов, но даже из смеси с вирусом некроза табака, имеющего другую (сферическую) форму (Hayden, 2006). Имеются доказательства, что с помощью МИПов можно также разделять штаммы, вирусные частицы которых схожи по форме, но различаются по структуре белковых фрагментов на внешней стенке оболочки.
Уже разрабатываются подходы и к получению пластиковых антител против патогенных бактерий, хотя пока эти исследования находятся на начальном этапе. То же самое можно сказать и про импринтинг клеток млекопитающих: пока с использованием в качестве модельных объектов эритроцитов была показана лишь принципиальная возможность такого подхода.
Сделаны из капрона
В России работы по созданию молекулярно импринтированных полимеров ведутся лишь в нескольких научных центрах (в Москве, Санкт-Петербурге, Воронеже, Новосибирске).
Российские ученые, так же как и их зарубежные коллеги, в основном занимаются разработкой МИПов на низкомолекулярные шаблоны, которые можно использовать как сорбенты или сенсорные элементы в аналитических устройствах.
Созданием МИПов на сложные биологические объекты занимаются в новосибирском Институте химической биологии и фундаментальной медицины СО РАН. Здесь в лаборатории бионанотехнологии предложен новый подход к получению МИПов на основе капрона (Дмитриенко и др., 2010). Отличительная особенность метода – отсутствие этапа полимеризации при переходе в твердое состояние: формирование капронового каркаса идет из уже готовых полимерных цепей, находящихся в растворе.

Было показано, что микроструктура полученного таким способом капрона определяется композицией исходного раствора полимера. Так, из раствора чистого капрона на плоской поверхности образуется полимерная мембрана с равномерной и гладкой структурой. А добавление в раствор протяженных сложных молекул (например, поливинилпирролидона), будет существенно менять «рельеф» полимера – в нем появятся крупные углубления (полости).

Соответственно, если в исходный раствор капрона добавлять молекулы различных белков, то в результате получаются полимеры, так же различающиеся по своей структуре: полости в них будут соответствовать очертаниям молекулярных шаблонов, присутствовавших при «застывании» полимерного каркаса. Мягкие условия формирования специфически структурированного полимера – отсутствие самой химической реакции полимеризации, сшивающих агентов и молекул-инициаторов – позволяют сохранить всю внешнюю целостность сложноорганизованного биологического шаблона. В результате «слепки» и соответственно сами МИПы получаются более высокого качества.
Исследования доказали, что молекулярно импринтированные полимеры на основе капрона обладают повышенным сродством к молекулярным шаблонам, присутствовавшим при их синтезе. При этом капроновые МИПы можно получать разных форматов. Так, при формировании полимера на поверхности плоской подложки получается пленка с «отпечатками». Можно получать полимер и в виде объемных структур, например, микрочастиц.
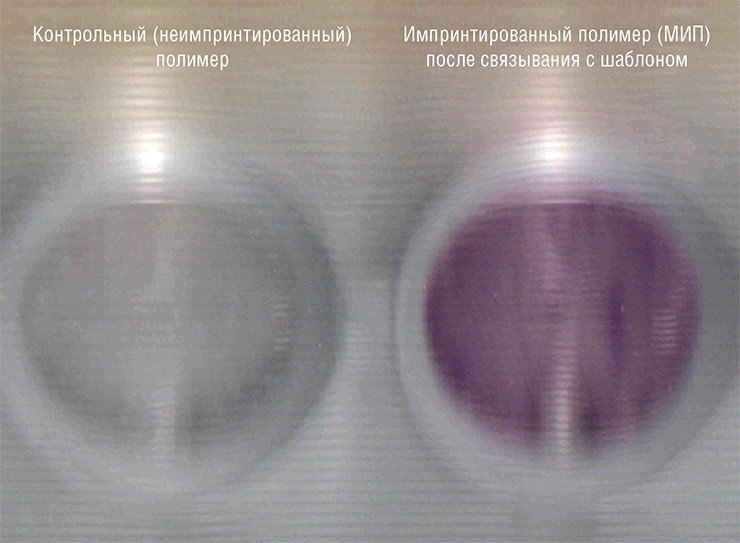
В случаях использования объемных сложноорганизованных шаблонов наиболее удобным является двумерный формат импринтинга, поскольку именно в этом случае специфические сайты полимерного каркаса наиболее доступны для взаимодействия с крупными белковыми молекулами. Кроме того, из таких полимеров проще удалить молекулярный шаблон после импринтинга, а также «пойманные» молекулы перед повторным использованием МИПа.
В таком двумерном формате (пленки, нанесенные на плоские поверхности или пористые фильтры) уже получены капроновые МИПы для связывания целого ряда белков: гемоглобина, бычьего сывороточного альбумина, сывороточного альбумина человека, яичного альбумина и др. А учитывая относительную простоту разработанного в ИХБФМ подхода, по предложенной схеме могут быть созданы МИПы на любые другие высокомолекулярные шаблоны.
Хотя многие ученые до сих пор скептически относятся к теории возникновения у полимеров «молекулярной памяти», число публикаций, им посвященных, стремительно растет. При этом наиболее значимыми импринтируемыми объектами сегодня становятся сложные биомолекулярные шаблоны.

«Памятливые» полимеры привлекают внимание широкого круга исследователей и технологов, поскольку могут быть использованы для самых разных целей: для выделения индивидуальных соединений, в качестве катализаторов химических реакций, сорбентов для очистки воды, подложек для анализа биологического материала и т. п.
Уже созданы МИПы для селективного и эффективного связывания низкомолекулярных органических молекул, в том числе обладающих биологической активностью. Ведутся интенсивные разработки химических сенсоров на основе МИПов, предназначенных для измерения содержания лекарственных средств, пестицидов и других соединений в биологических и экологических пробах (Haupt, 2001).
Что касается МИПов с «отпечатками» белков, не говоря уже о «пластиковых» антителах, то на сегодняшний день это направление, безусловно, находится на самом начальном, исследовательском этапе. Однако доказательства самой возможности создания искусственных материалов, демонстрирующих биологическую активность в живых системах, подогревает интерес к поиску эффективных путей получения таких «памятливых» полимеров. Ведь их практическое применение открывает перед человечеством перспективы. которые сегодня даже трудно себе представить!
Литература
Гендриксон О. Д., Жердев А. В., Дзантиев Б. Б. Молекулярно импринтированные полимеры и их применение в биохимическом анализе // Успехи биологической химии. 2006. Т. 46. С. 149—192.
Патент № 2385889 РФ / Дмитриенко Е. В., Пышная И. А., Рогоза А. В., Пышный Д. В. Новосибирск; опубл. 10.04.2010. Бюл. № 10.
Haupt K. Molecularly imprinted polymers in analytical chemistry // Analyst. 2001. V. 126, P. 747—756.
Hoshino Y., Koide H., Urakami T., et al. Recognition, Neutralization and clearance of target peptides in the bloodstream of living mice by molecularly imprinted polymer nanoparticles: a plastic antibody // J. Amer. Chem. Soc. 2010. V. 132. P. 6644—6645.
Hayden O., Lieberzeit P., Blaas D., et al. Artificial antibodies for bioanalyte detection – sensing viruses and proteins // Adv. Funct. Mater. 2006. V. 16. P. 1269—1278.