Биотехнологии – медицине будущего
Новый выпуск журнала «НАУКА из первых рук» вышел «по следам» всероссийской конференции с международным участием «Биотехнология – медицине будущего», состоявшейся в новосибирском Академгородке в июле 2017 г. Среди организаторов научного форума – Институт химической биологии и фундаментальной медицины и Институт цитологии и генетики СО РАН, а также Новосибирский национальный исследовательский государственный университет, где биомедицинские исследования ведутся в рамках стратегической академической единицы «Синтетическая биология», объединяющей ряд российских и зарубежных участников, в первую очередь институты СО РАН биологического профиля. В первой, вводной статье выпуска ее авторы дают обзор самых актуальных направлений и перспективных результатов исследований, связанных с разработкой и внедрением в практическую медицину новых генно-инженерных, клеточных, тканевых, иммунобиологических и цифровых технологий, часть из которых детально представлена в других статьях номера
Стремительное развитие биологической науки, обусловленное появлением высокопроизводительных приборов и созданием методов манипулирования информационными биополимерами и клетками, подготовило фундамент для развития медицины будущего. В результате исследований последних лет были разработаны эффективные диагностические методы, появились возможности для рационального конструирования противовирусных, противобактериальных и противоопухолевых препаратов, средств генотерапии и геномного редактирования. Современные биомедицинские технологии все в большей степени начинают влиять на экономику и определять качество жизни людей.
К настоящему времени детально исследованы строение и функции основных биологических молекул и разработаны методы синтеза белков и нуклеиновых кислот. Эти биополимеры по своей природе являются «интеллектуальными» материалами, так как способны высокоспецифично «узнавать» и воздействовать на определенные биологические мишени. Путем направленного «программирования» таких макромолекул можно создавать рецепторные молекулярные конструкции для аналитических систем, а также лекарственные препараты, избирательно воздействующие на конкретные генетические программы или белки.
«Интеллектуальные препараты», созданные методами синтетической биологии, открывают возможности для таргетной (целенаправленной) терапии аутоиммунных, онкологических, наследственных и инфекционных заболеваний. Это дает основание говорить о внедрении в медицинскую практику подходов персонализированной медицины, ориентированной на лечение конкретного человека.
С помощью современных медицинских технологий и фармпрепаратов сегодня удается излечивать многие болезни, представлявшие в прошлом огромную медицинскую проблему. Но с развитием практической медицины и ростом продолжительности жизни все более актуальной становится задача здравоохранения в самом прямом смысле этого слова: не просто бороться с болезнями, но поддерживать имеющееся здоровье, чтобы человек мог вести активный образ жизни и оставаться полноценным членом общества до глубокой старости.
БУДЕМ ЗДОРОВЫ!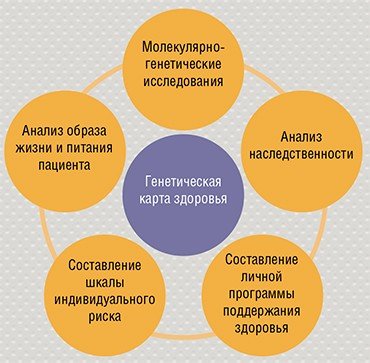 Современные методы геномного секвенирования широко внедряются в медицину, и в ближайшем будущем все пациенты будут иметь генетические паспорта. Сведения о наследственных особенностях пациента – основа прогностической персонализированной медицины. Предупрежденный, как известно, вооружен. Человек, осведомленный о возможных рисках, может организовать свою жизнь таким образом, чтобы не допустить развития заболевания. Это касается и образа жизни, и выбора продуктов питания и терапевтических препаратов.
Современные методы геномного секвенирования широко внедряются в медицину, и в ближайшем будущем все пациенты будут иметь генетические паспорта. Сведения о наследственных особенностях пациента – основа прогностической персонализированной медицины. Предупрежденный, как известно, вооружен. Человек, осведомленный о возможных рисках, может организовать свою жизнь таким образом, чтобы не допустить развития заболевания. Это касается и образа жизни, и выбора продуктов питания и терапевтических препаратов.
При условии постоянного отслеживания набора маркеров, сигнализирующих об отклонениях в работе организма, можно вовремя провести их коррекцию. Уже сейчас существует множество методов мониторинга состояния организма: например, с помощью датчиков, следящих за работой сердечно-сосудистой системы и качеством сна или устройств, анализирующих газообразные продукты в выдыхаемом человеком воздухе. Огромные возможности открываются в связи с развитием малоинвазивных технологий жидкостной биопсии и технологий анализа белков и пептидов, циркулирующих в кровотоке. На ранних стадиях болезни корректировать состояние организма во многих случаях можно «мягкими» методами: меняя характер питания, используя добавочные микроэлементы, витамины и пробиотики. В последнее время особое внимание уделяется возможностям корректировки отклонений в составе кишечной микрофлоры человека, которые ассоциированы с развитием большого числа патологических состояний.
Подробнее
Такую задачу можно решить, обеспечив постоянный эффективный контроль за состоянием организма, который позволил бы избегать действия неблагоприятных факторов и предупреждать развитие заболевания, выявляя патологический процесс на самом раннем этапе, и ликвидировать саму причину возникновения болезни.
В этом смысле основную задачу медицины будущего можно сформулировать как «управление здоровьем». Сделать это вполне реально, если иметь полную информацию о наследственности человека и обеспечить мониторинг ключевых показателей состояния организма.
«Умная» диагностика
Для управления здоровьем необходимо иметь эффективные и простые малоинвазивные методы ранней диагностики заболеваний и определения индивидуальной чувствительности к терапевтическим препаратам, а также факторам внешней среды. Например, должны быть решены (и уже решаются) такие задачи, как создание систем для генной диагностики и выявления возбудителей инфекционных заболеваний человека, разработка методов количественного определения белков и нуклеиновых кислот – маркеров заболеваний.
 Отдельно стоит выделить создание методов ранней неинвазивной диагностики (жидкостная биопсия) опухолевых заболеваний, основанных на анализе внеклеточной ДНК и РНК. Источником таких нуклеиновых кислот служат как погибшие, так и живые клетки. В норме их концентрация относительно низка, но обычно возрастает при стрессе и развитии патологических процессов. При возникновении злокачественной опухоли в кровоток попадают нуклеиновые кислоты, выделяемые раковыми клетками, и такие характерные циркулирующие РНК и ДНК могут служить маркерами заболевания.
Отдельно стоит выделить создание методов ранней неинвазивной диагностики (жидкостная биопсия) опухолевых заболеваний, основанных на анализе внеклеточной ДНК и РНК. Источником таких нуклеиновых кислот служат как погибшие, так и живые клетки. В норме их концентрация относительно низка, но обычно возрастает при стрессе и развитии патологических процессов. При возникновении злокачественной опухоли в кровоток попадают нуклеиновые кислоты, выделяемые раковыми клетками, и такие характерные циркулирующие РНК и ДНК могут служить маркерами заболевания.
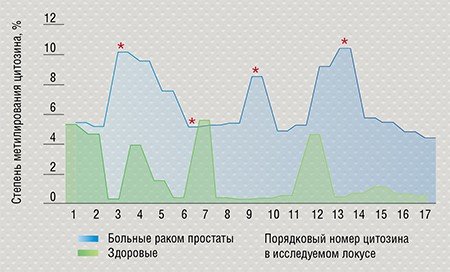
Сейчас на основе подобных маркеров разрабатываются подходы к ранней диагностике рака, методы прогнозирования риска его развития, а также оценки степени тяжести течения болезни и эффективности терапии. Например, в Институте химической биологии и фундаментальной медицины СО РАН было показано, что при раке предстательной железы повышается степень метилирования определенных участков ДНК. Был разработан метод, позволяющий выделить из образцов крови циркулирующую ДНК и проанализировать характер ее метилирования. Этот способ может стать основой точной неинвазивной диагностики рака простаты, которой на сегодня не существует.
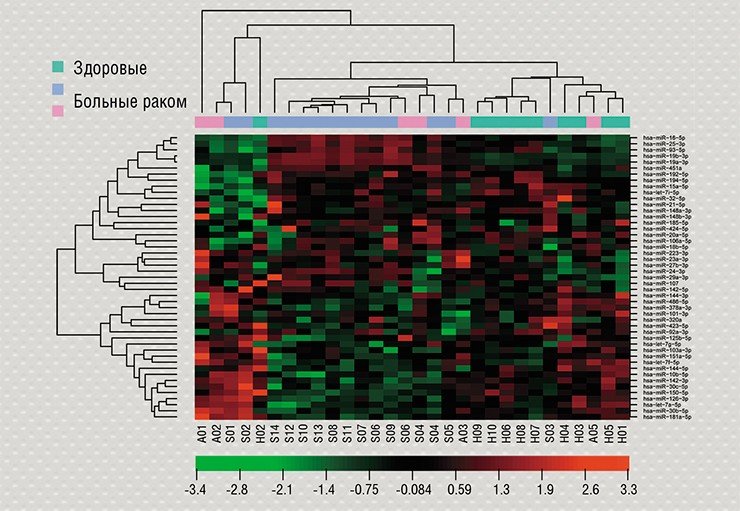
Важным источником информации о состоянии здоровья могут служить так называемые некодирующие РНК, т. е. те РНК, которые не являются матрицей для синтеза белков. За последние годы было установлено, что в клетках образуется множество различных некодирующих РНК, участвующих в регуляции самых разных процессов на уровне клеток и целого организма. Изучение спектра микроРНК и длинных некодирующих РНК при различных состояниях открывает широкие возможности для быстрой и эффективной диагностики. В Институте молекулярной и клеточной биологии СО РАН (ИМКБ СО РАН, Новосибирск) и ИХБФМ СО РАН идентифицирован ряд микроРНК – перспективных маркеров опухолевых заболеваний.
УЗНАТЬ ВРАГА В ЛИЦО Современные технологии с применением биологических микрочипов позволяют быстро и эффективно идентифицировать возбудителей ряда болезней (туберкулеза, СПИДа, гепатитов В и С, сибирской язвы, инфекций новорожденных), фиксировать наличие определенных биотоксинов, определять хромосомные транслокации при лейкозах, регистрировать белковые маркеры онкозаболеваний, определять генетическую предрасположенность к болезням и индивидуальную чувствительность к некоторым типам терапии. Технологии также можно использовать для генетической идентификации личности при проведении судебно-генетических экспертиз и формирования баз данных ДНК.ИХБФМ СО РАН участвовал в реализации двух крупных международных проектов по разработке олигонуклеотидных микрочипов, финансировавшихся американской Программой сотрудничества в области биотехнологий Департамента здравоохранения США (Biotechnology Engagement Program, US Department of Health and Human Services, BTEP/DHHS). В рамках первого проекта с участием специалистов ИМБ им. В. А. Энгельгардта созданы микрочипы, позволяющие точно идентифицировать различные штаммы вирусов оспы и герпеса. Были разработаны два варианта конструкции микрочипов (на стеклянной подложке и с гелевыми спотами), а также портативный флуоресцентный детектор для их анализа. В рамках второго проекта был создан универсальный микрочип для типирования вируса гриппа А, позволяющий достоверно различать 30 подтипов этого вируса на основе определения двух поверхностных белков вируса – гемагглютинина и нейраминидазы
С помощью современных технологий секвенирования РНК и ДНК может быть создана платформа для диагностики и прогноза онкологических заболеваний человека на основе анализа содержания микроРНК и генотипирования, т. е. установления конкретных генетических вариантов того или иного гена, а также для определения профилей экспрессии (активности) генов. Такой подход предполагает возможность быстрого и одновременного проведения множества анализов с помощью современных устройств – биологических микрочипов.
 Биочипы представляют собой миниатюрные приборы для параллельного анализа специфических биологических макромолекул. Идея создания подобных устройств родилась в Институте молекулярной биологии им. В. А. Энгельгардта Российской академии наук (Москва) еще в конце 1980-х гг. За короткое время биочиповые технологии выделились в самостоятельную область анализа с огромным спектром практических приложений, от исследования фундаментальных проблем молекулярной биологии и молекулярной эволюции до выявления лекарственно устойчивых штаммов бактерий.
Биочипы представляют собой миниатюрные приборы для параллельного анализа специфических биологических макромолекул. Идея создания подобных устройств родилась в Институте молекулярной биологии им. В. А. Энгельгардта Российской академии наук (Москва) еще в конце 1980-х гг. За короткое время биочиповые технологии выделились в самостоятельную область анализа с огромным спектром практических приложений, от исследования фундаментальных проблем молекулярной биологии и молекулярной эволюции до выявления лекарственно устойчивых штаммов бактерий.
Сегодня в ИМБ РАН производятся и используются в медицинской практике оригинальные тест-системы для идентификации возбудителей ряда социально значимых инфекций, в том числе таких как туберкулез, с одновременным выявлением их резистентности к антимикробным препаратам; тест-системы для оценки индивидуальной переносимости препаратов группы цитостатиков и многое другое.
Мировой лидер «биочипостроения» – американская компания Affymetrix Inc. – производит биочипы с высокой плотностью молекулярных зондов, основываясь на фотолитографических технологиях, использующихся для получения полупроводниковых микросхем. На одном таком чипе на площади менее 2 см2 могут располагаться миллионы точек-спотов размером в несколько микрон. Каждая подобная точка содержит несколько миллионов одинаковых олигонуклеотидов, ковалентно связанных с поверхностью микрочипаРазвитие биоаналитических диагностических методов требует постоянного повышения чувствительности – способности давать достоверный сигнал при регистрации малых количеств детектируемого вещества. Биосенсоры – это новое поколение устройств, позволяющих специфично анализировать содержание различных маркеров заболеваний в образцах сложного состава, что особенно важно при диагностике заболеваний.
ИХБФМ СО РАН в сотрудничестве с новосибирским Институтом физики полупроводников СО РАН разрабатывает микробиосенсоры на основе полевых транзисторов, являющихся одними из самых чувствительных аналитических устройств. Такой биосенсор позволяет в реальном времени отслеживать взаимодействие биомолекул. Его составной частью является одна из таких взаимодействующих молекул, которая играет роль молекулярного зонда. Зонд захватывает из анализируемого раствора молекулярную мишень, по наличию которой можно судить о конкретных характеристиках здоровья пациента.
«Комплементарное» лекарство
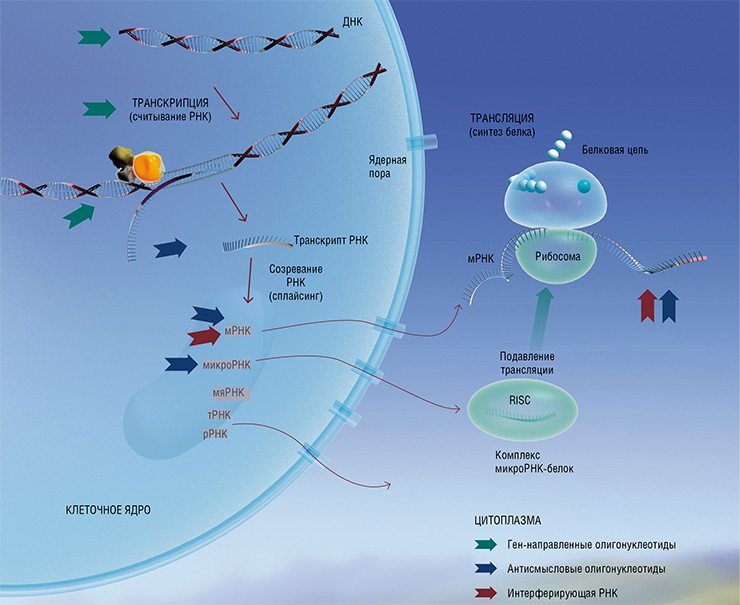
Расшифровка геномов человека и возбудителей различных инфекций открыла дорогу для разработки радикальных подходов к терапии болезней путем направленного воздействия на их первопричину – генетические программы, ответственные за развитие патологических процессов. Глубокое понимание механизма возникновения заболевания, в который вовлечены нуклеиновые кислоты, дает возможность сконструировать терапевтические нуклеиновые кислоты, восполняющие утраченную функцию либо блокирующие возникшую патологию.
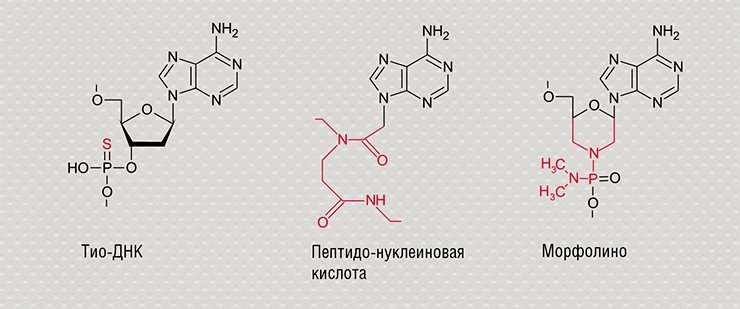
Такое воздействие может быть осуществлено с помощью фрагментов нуклеиновых кислот – синтетических олигонуклеотидов, способных избирательно взаимодействовать с определенными нуклеотидными последовательностями в составе генов-мишеней по принципу комплементарности. Сама идея использовать олигонуклеотиды для направленного воздействия на гены была впервые выдвинута в лаборатории природных полимеров (впоследствии – отдел биохимии) Новосибирского института биоорганической химии СО РАН (ныне – Институт химической биологии и фундаментальной медицины СО РАН). В Новосибирске были созданы и первые препараты ген-направленного действия для избирательной инактивации вирусных и некоторых клеточных РНК.
Подобные ген-направленные терапевтические препараты сегодня активно разрабатываются на основе нуклеиновых кислот, их аналогов и конъюгатов (антисмысловых олигонуклеотидов, интерферирующих РНК, аптамеров, систем геномного редактирования). Исследования последних лет показали, что на основе антисмысловых олигонуклеотидов можно получить широкий спектр биологически активных веществ, действующих на различные генетические структуры и запускающих процессы, приводящие к временному «выключению» генов либо изменению генетических программ – появлению мутаций. Было доказано, что с помощью подобных соединений можно подавить функционирование определенных матричных РНК живой клетки, воздействуя на синтез белков, а также защитить клетки от вирусной инфекции.
Подробнее
Сегодня антисмысловые олигонуклеотиды и РНК, подавляющие функции мРНК и вирусных РНК, применяются не только в биологических исследованиях. Ведутся испытания ряда противовирусных и противовоспалительных препаратов, созданных на основе искусственных аналогов олигонуклеотидов, а некоторые из них уже начинают внедряться в клиническую практику.
Лаборатория биомедицинской химии ИХБФМ СО РАН, работающая в этом направлении, была создана в 2013 г. благодаря научному мегагранту Правительства РФ. Ее организатором стал профессор Йельского университета, Нобелевский лауреат С. Альтман. В лаборатории ведутся исследования физико-химических и биологических свойств новых перспективных искусственных олигонуклеотидов, на основе которых разрабатываются РНК-направленные противобактериальные и противовирусные препараты.
 В рамках проекта, руководимого С. Альтманом, было выполнено масштабное систематическое исследование воздействия различных искусственных аналогов олигонуклеотидов на патогенные микроорганизмы: синегнойную палочку, сальмонеллу, золотистый стафилококк, а также вирус гриппа. Были определены гены-мишени, воздействием на которые можно наиболее эффективно подавить эти патогены; проводится оценка технологических и терапевтических характеристик самых действующих аналогов олигонуклеотидов, в том числе проявляющих антибактериальную и противовирусную активность.
В рамках проекта, руководимого С. Альтманом, было выполнено масштабное систематическое исследование воздействия различных искусственных аналогов олигонуклеотидов на патогенные микроорганизмы: синегнойную палочку, сальмонеллу, золотистый стафилококк, а также вирус гриппа. Были определены гены-мишени, воздействием на которые можно наиболее эффективно подавить эти патогены; проводится оценка технологических и терапевтических характеристик самых действующих аналогов олигонуклеотидов, в том числе проявляющих антибактериальную и противовирусную активность.
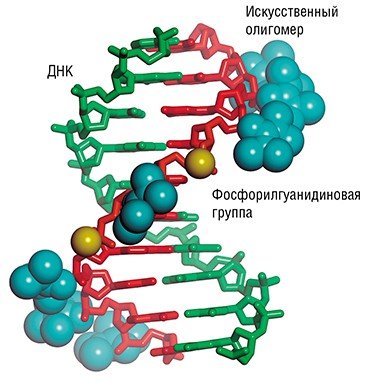
В ИХБФМ СО РАН впервые в мире были синтезированы фосфорилгуанидиновые производные олигонуклеотидов. Эти новые соединения электронейтральны, устойчивы в биологических средах и прочно связываются с РНК- и ДНК-мишенями в широком диапазоне условий. Благодаря спектру уникальных свойств они перспективны для применения в качестве терапевтических агентов, а также могут быть использованы для повышения эффективности средств диагностики, основанных на биочиповых технологиях.
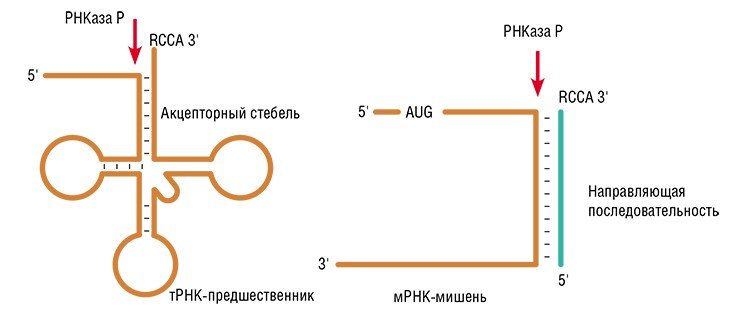
Среди коммерческих фирм лидером в создании терапевтических нуклеиновых кислот является американская компания Ionis Pharmaceuticals, Inc. (США). После многолетних клинических исследований были введены в медицинскую практику антисмысловые препараты: Kynamro – снижающий уровень «плохого» холестерина, Alicaforsen – для лечения язвенного колита и Spinraza – для терапии дистрофии Дюшенна. Препараты Ionis против ряда других заболеваний проходят клинические испытания. Лидер в создании терапевтических интерферирующих РНК – компания Alnylam Pharmaceuticals – также проводит клинические испытания целой серии препаратов для лечения тяжелых заболеваний (таких как наследственный амилоидоз, тяжелые формы гиперхолестеролемии, гемофилия), эффективные методы терапии которых в настоящее время отсутствуют«Антисмысловое» воздействие на матричные РНК не ограничивается простым блокированием сплайсинга (процесса «созревания» РНК) или синтеза белка. Более эффективным является ферментативное разрезание мРНК, спровоцированное связыванием терапевтического олигонуклеотида с мишенью. При этом олигонуклеотид – индуктор расщепления – может в дальнейшем связаться с другой молекулой РНК и повторить свое действие. В ИХБФМ СО РАН исследовали действие олигонуклеотидов, образующих при связывании с мРНК комплексы, которые могут служить субстратами фермента РНКазы Р. Этот фермент и сам представляет собой РНК с каталитическими свойствами (рибозим).
Чрезвычайно мощным средством подавления активности генов оказались не только антисмысловые нуклеотиды, но и двуцепочечные РНК, действующие по механизму РНК-интерференции. Суть этого явления в том, что, попадая в клетку, длинные дцРНК разрезаются на короткие фрагменты (так называемые малые интерферирующие РНК, siPНК), комплементарные определенному участку матричной РНК. Связываясь с такой мРНК, siPНК запускают действие ферментативного механизма, разрушающего молекулу-мишень.
Использование этого механизма открывает новые возможности для создания широкого спектра высокоэффективных нетоксичных препаратов для подавления экспрессии практически любых, в том числе вирусных, генов. В ИХБФМ СО РАН на основе малых интерферирующих РНК сконструированы перспективные противоопухолевые препараты, показавшие хорошие результаты в экспериментах на животных. Одна из интересных находок – двуцепочечные РНК оригинального строения, стимулирующие в организме производство интерферона, эффективно подавляющие процесс метастазирования опухолей. Хорошее проникновение препарата в клетки обеспечивают носители – новые катионные липосомы (липидные пузырьки), разработанные совместно со специалистами Московского государственного университета тонких химических технологий имени М. В. Ломоносова.
Новые роли нуклеиновых кислот
Разработка метода полимеразной цепной реакции, позволяющего в неограниченных количествах размножать нуклеиновые кислоты – ДНК и РНК, и появление технологий молекулярной селекции нуклеиновых кислот сделали возможным создание искусственных РНК и ДНК с заданными свойствами. Молекулы нуклеиновых кислот, избирательно связывающие определенные вещества, называются аптамерами. На их основе могут быть получены препараты, блокирующие функции любых белков: ферментов, рецепторов или регуляторов активности генов. В настоящее время получены уже тысячи самых разных аптамеров, находящих широкое применение в медицине и технике.
Один из мировых лидеров в этой области – американская компания Soma Logic Inc. – создает так называемые сомамеры, которые селективно отбирают из библиотек химически модифицированных нуклеиновых кислот по уровню сродства к тем или иным мишеням. Модификации по азотистому основанию придают таким аптамерам дополнительную «белковоподобную» функциональность, что обеспечивает высокую стабильность их комплексам с мишенями. Кроме того, это увеличивает вероятность успешного отбора сомамеров к тем соединениям, к которым подобрать обычные аптамеры не удалось.
Примером развития микрочиповых технологий могут служить американская фирма LC Sciences и немецкая Febit Gmbh. Биочиповый реактор производства LC Sciences с использованием стандартных реагентов для олигонуклеотидного синтеза позволяет одновременно синтезировать 4—8 тыс. разных олигонуклеотидов. Микрочиповый реактор фирмы Febit Gmbh состоит из 8 независимых фрагментов, на каждом из которых одновременно синтезируется до 15 тыс. разных олигонуклеотидов. За сутки таким образом можно получить до полумиллиона олигонуклеотидов – строительных блоков будущих генов
Среди аптамеров, имеющих сродство к клинически значимым мишеням, к настоящему времени имеются кандидаты на терапевтические препараты, достигшие третьей, ключевой фазы клинических испытаний. Один из них – Macugen – уже используется в клинической практике для терапии заболеваний сетчатки глаза; препарат для лечения возрастной макулярной дегенерации сетчатки Fovista успешно заканчивает испытания. И на очереди множество подобных препаратов.
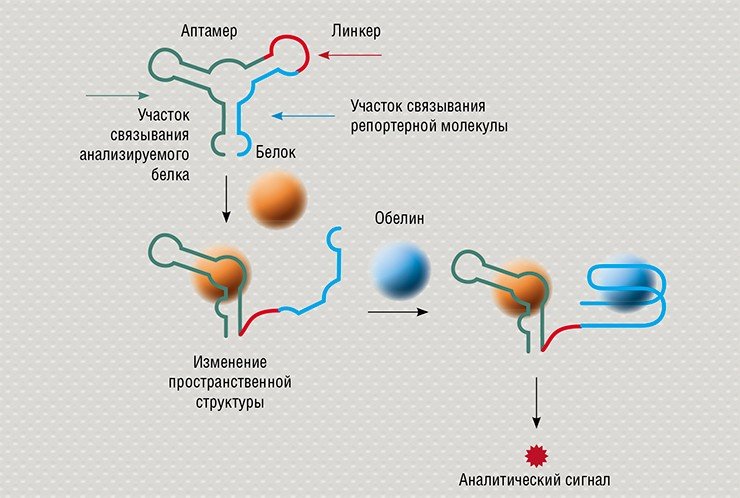
Но терапия – это не единственное предназначение аптамеров: они вызывают огромный интерес у биоаналитиков в качестве распознающих молекул при создании аптамерных биосенсоров.
В ИХБФМ совместно с Институтом биофизики СО РАН (Красноярск) разрабатываются биолюминесцентные аптасенсоры с переключаемой структурой. Получены аптамеры, которые играют роль репортерного блока сенсора, к Са2+-активируемому фотопротеину обелину, представляющему собой удобную биолюминесцентную метку. Этот сенсор способен «улавливать» молекулы лишь определенных белков, которые необходимо детектировать в образце. В настоящее время по этой схеме конструируются переключаемые биосенсоры к модифицированным белкам крови, служащим маркерами диабета.
Новым объектом среди терапевтических нуклеиновых кислот является и сама матричная (информационная) РНК. Компания Moderna Therapeutics (США) сейчас проводит масштабные клинические исследования мРНК. При попадании в клетку мРНК действуют в ней как ее собственные. В результате клетка получает возможность производить белки, которые могут предотвратить или остановить развитие заболевания. Большая часть таких потенциальных терапевтических препаратов направлена против инфекционных (вирус гриппа, вирус Зика, цитомегаловирус и др.) и онкологических заболеваний.
Белки как лекарство
Огромные успехи синтетической биологии за последние годы отразились и в разработке технологий производства терапевтических белков, уже широко применяющихся в клинике. В первую очередь это относится к противоопухолевым антителам, с помощью которых стала возможной эффективная терапия целого ряда онкологических заболеваний.
Сейчас появляются все новые противоопухолевые белковые препараты. Примером может служить препарат лактаптин, созданный в ИХБФМ СО РАН на основе фрагмента одного из основных белков молока человека. Исследователи обнаружили, что этот пептид индуцирует апоптоз («самоубийство») клеток стандартной опухолевой клеточной культуры – аденокарциномы молочной железы человека. С использованием методов генной инженерии был получен ряд структурных аналогов лактаптина, из которых был выбран наиболее эффективный.
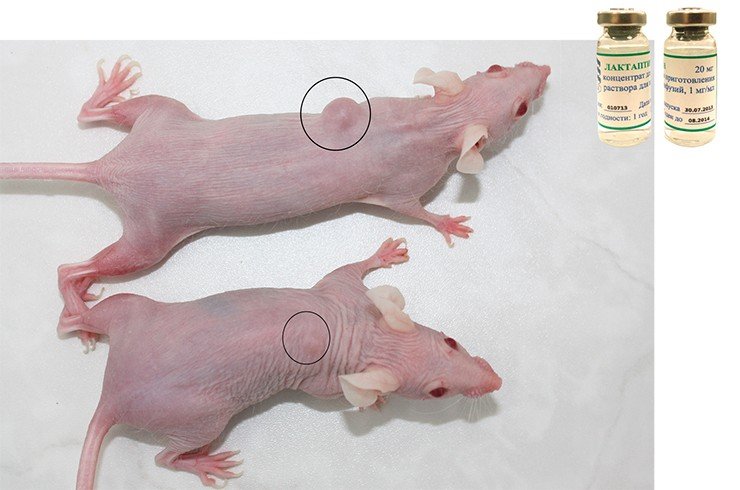
Испытания на лабораторных животных подтвердили безопасность препарата и его противоопухолевую и антиметастатическую активность в отношении ряда опухолей человека. Уже разработана технология получения лактаптина в субстанции и лекарственной форме, изготовлены первые экспериментальные партии препарата.
Терапевтические антитела все шире применяются и для лечения вирусных инфекций. Специалистам ИХБФМ СО РАН удалось генно-инженерными методами создать гуманизированное антитело против вируса клещевого энцефалита. Препарат прошел все доклинические испытания, доказав свою высокую эффективность. Оказалось, что защитные свойства искусственного антитела в сто раз выше, чем коммерческого препарата антител, получаемого из сыворотки доноров.
Вторжение в наследственность
Открытия последних лет расширили возможности генотерапии, которые до недавнего времени представлялась фантастикой. Технологии геномного редактирования, основанные на применении РНК-белковой системы CRISPR/Cas, способны распознавать определенные последовательности ДНК и вносить в них разрывы. При «ремонте» (репарации) таких нарушений можно исправлять мутации, ответственные за заболевания, или вводить в терапевтических целях новые генетические элементы.
Редактирование генов открывает перспективы радикального решения проблемы генетических заболеваний путем модификации генома при использовании экстракорпорального оплодотворения. Принципиальная возможность направленного изменения генов эмбриона человека уже доказана экспериментально, и создание технологии, обеспечивающей появление на свет детей, свободных от наследственных заболеваний, задача ближайшего будущего.
С помощью геномного редактирования можно не только «исправлять» гены: этот подход можно использовать для борьбы с вирусными инфекциями, не поддающимися обычной терапии. Речь идет о вирусах, встраивающих свой геном в клеточные структуры организма, где он оказывается недоступным для современных противовирусных препаратов. К таким вирусам относятся ВИЧ‑1, вирусы гепатита В, папилломавирусы, полиомавирусы и ряд других. Системы геномного редактирования могут инактивировать вирусную ДНК внутри клетки, разрезав ее на безопасные фрагменты либо внеся в нее инактивирующие мутации.
Очевидно, что применение системы CRISPR/Cas в качестве средства коррекции мутаций человека станет возможным лишь после ее усовершенствования с целью обеспечения высокого уровня специфичности и проведения широкого спектра испытаний. Кроме того, для успешной борьбы с опасными вирусными инфекциями необходимо решить проблему эффективной доставки терапевтических агентов в целевые клетки.
Сначала была клетка – стволовая
Одним из наиболее быстро развивающихся направлений в медицине является клеточная терапия. В ведущих странах уже проходят клинические испытания клеточных технологий, разработанных для лечения аутоиммунных, аллергических, онкологических и хронических вирусных заболеваний.
В России пионерные работы по созданию средств терапии на основе стволовых клеток и клеточных вакцин были выполнены в Институте фундаментальной и клинической иммунологии СО РАН (Новосибирск). В результате исследований были разработаны методы лечения онкологических заболеваний, гепатита В и аутоиммунных заболеваний, которые уже начали применяться в клинике в экспериментальном режиме.
Чрезвычайно актуальными в наши дни стали проекты создания банков культур клеток пациентов с наследственными и онкологическими заболеваниями для тестирования фармакологических препаратов. В Новосибирском научном центре такой проект уже реализуется межинститутским коллективом под руководством проф. С. М. Закияна. Новосибирские специалисты отработали технологии внесения мутаций в культивируемые клетки человека, в результате чего были получены клеточные модели таких заболеваний, как боковой амиотрофический склероз, болезнь Альцгеймера, спинальная мышечная атрофия, синдром удлиненного интервала QT и гипертрофическая кардиомиопатия.
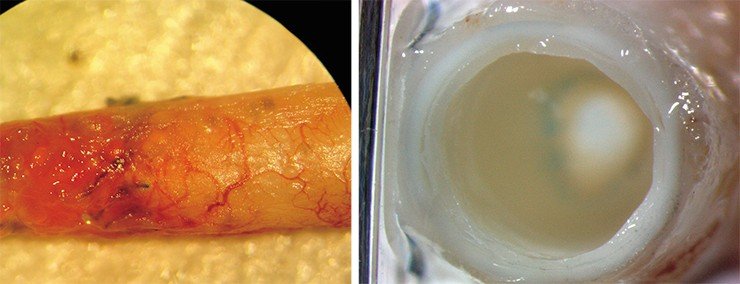
Разработка методов получения из обычных соматических клеток плюрипотентных стволовых, способных превратиться в любую клетку взрослого организма, привела и к появлению клеточной инженерии, позволяющей восстанавливать пораженные структуры организма. Удивительно быстро развиваются технологии получения трехмерных структур для клеточной и тканевой инженерии на основе биоразрушаемых полимеров: протезов сосудов, трехмерных матриксов для выращивания хрящевой ткани и конструирования искусственных органов.
Так, специалисты ИХБФМ СО РАН и Национального медицинского исследовательского центра им. Е. Н. Мешалкина (Новосибирск) разработали технологию создания протезов сосудов и сердечных клапанов методом электроспиннинга. С помощью этой технологии из раствора полимера можно получить волокна толщиной от десятков нанометров до нескольких микрон. В результате серии экспериментов удалось отобрать изделия с выдающимися физическими характеристиками, которые сейчас успешно проходят доклинические испытания. Благодаря высокой био- и гемосовместимости такие протезы со временем замещаются собственными тканями организма.
Микробиом как объект и субъект терапии
К настоящему времени хорошо изучены и расшифрованы геномы многих микроорганизмов, поражающих человека. Ведутся исследования и сложных микробиологических сообществ, постоянно связанных с человеком, – микробиомов.
Существенный вклад в эту область исследований внесли и отечественные ученые. Так, специалисты ГНЦ ВБ «Вектор» (Кольцово, Новосибирская обл.) впервые в мире расшифровали геномы вирусов Марбург и натуральной оспы, а ученые ИХБФМ СО РАН – геномы вируса клещевого энцефалита, возбудителей клещевого боррелиоза, распространенных на территории РФ. Также были изучены микробные сообщества, ассоциированные с различными видами опасных для человека клещей.
В развитых странах сегодня активно ведутся работы, направленные на создание средств регуляции микробиома организма человека, в первую очередь его пищеварительного тракта. Как оказалось, от состава микробиома кишечника в огромной степени зависит состояние здоровья. Методы воздействия на микробиом уже существуют: например, обогащение его новыми терапевтическими бактериями, использование пробиотиков, благоприятствующих размножению полезных бактерий, а также прием бактериофагов (вирусов бактерий), избирательно убивающих «вредные» микроорганизмы.
В последнее время работы по созданию средств терапии на основе бактериофагов активизировались во всем мире в связи с проблемой распространения лекарственно-устойчивых бактерий. Россия – одна из немногих стран, где применение бактериофагов в медицине разрешено. В РФ существует промышленное производство препаратов, разработанных еще в советское время, и чтобы получать более эффективные бактериофаги, необходимо их совершенствовать, и эта задача может быть решена методами синтетической биологии.
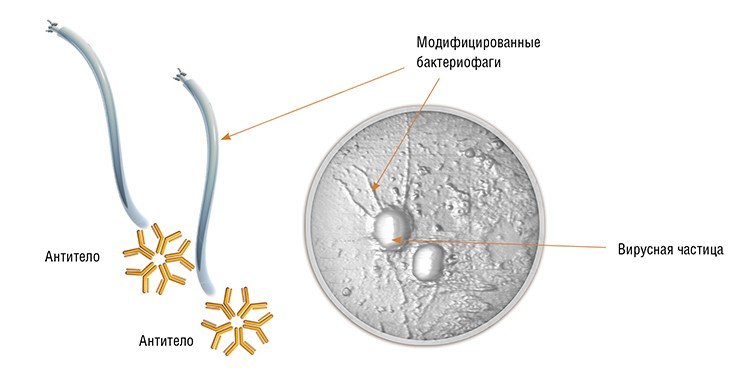
Решением ее занимаются в ряде научно-исследовательских организаций РФ, в том числе в ИХБФМ СО РАН. В институте охарактеризованы промышленно производимые в РФ фаговые препараты, расшифрованы геномы ряда бактериофагов, а также создана их коллекция, в которую вошли и уникальные вирусы, перспективные для применения в медицине. В клинике института отрабатываются механизмы оказания персонализированной помощи больным, страдающим от бактериальных инфекций, вызванных лекарственно-устойчивыми микроорганизмами. Последние возникают при лечении диабетической стопы, а также в результате пролежней или послеоперационных осложнений. Разрабатываются и методы коррекции нарушений состава микробиома человека.
Совершенно новые возможности использования вирусов открываются в связи с созданием технологий получения интеллектуальных систем высокоизбирательного действия на определенные клетки. Речь идет об онколитических вирусах, способных поражать только опухолевые клетки. В экспериментальном режиме несколько таких вирусов уже применяются в Китае и США. Работы в этой области ведутся и в России, в них принимают участие специалисты из московских и новосибирских научно-исследовательских организаций: ИМБ РАН, ГНЦ ВБ «Вектор», Новосибирского государственного университета и ИХБФМ СО РАН.
 Быстрое развитие синтетической биологии дает основание ожидать в ближайшие годы важных открытий и появления новых биомедицинских технологий, которые избавят человечество от многих проблем и позволят реально управлять здоровьем, а не только лечить наследственные и «благоприобретенные» заболевания.
Быстрое развитие синтетической биологии дает основание ожидать в ближайшие годы важных открытий и появления новых биомедицинских технологий, которые избавят человечество от многих проблем и позволят реально управлять здоровьем, а не только лечить наследственные и «благоприобретенные» заболевания.
Фронт исследований в этой области чрезвычайно широк. Уже сейчас доступные гаджеты представляют собой не просто игрушки, но реально полезные приборы, ежедневно обеспечивающие человека информацией, необходимой для контроля и поддержания здоровья. Новые технологии быстрого углубленного обследования дают возможность предсказать или своевременно обнаружить развитие болезни, а персонализированные препараты на основе «умных» информационных биополимеров позволят радикально решить проблемы борьбы с инфекционными и генетическими заболеваниями в самом ближайшем будущем.
Литература
Брызгунова О. Е., Лактионов П. П. Внеклеточные нуклеиновые кислоты мочи: источники, состав, использование в диагностике // Acta Naturae. 2015. Т. 7. № 3(26). С. 54—60.
Власов В. В., еще две фамилии и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // НАУКА из первых рук. 2014. T. 55. № 1. С. 38—49.
Власов В. В., Воробьев П. Е., Пышный Д. В. и др. Правда о фаготерапии, или памятка врачу и пациенту // НАУКА из первых рук. 2016. Т. 70. № 4. С. 58—65.
Власов В. В., Закиян С. М., Медведев С. П. «Редакторы геномов». От «цинковых пальцев» до CRISPR // НАУКА из первых рук. 2014. Т. 56. № 2. С. 44—53.
Лифшиц Г. И., Слепухина А. А., Субботовская А. И. и др. Измерение параметров гемостаза: приборная база и перспективы развития // Медицинская техника. 2016. Т. 298. № 4. С. 48—52.
Рихтер В. А. Женское молоко – источник потенциального лекарства от рака // НАУКА из первых рук. 2013. Т. 52. № 4. С. 26—31.
Kupryushkin M. S., Pyshnyi D. V., Stetsenko D. A. Phosphoryl guanidines: a new type of nucleic Acid analogues // Acta Naturae. 2014. V. 6. № 4(23). P. 116—118.
Nasedkina T. V., Guseva N. A., Gra O. A. et al. Diagnostic microarrays in hematologic oncology: applications of high- and low-density arrays // Mol Diagn Ther. 2009. V. 13. N. 2. P. 91—102.
Ponomaryova A. A., Morozkin E. S., Rykova E. Y. et al. Dynamic changes in circulating miRNA levels in response to antitumor therapy of lung cancer // Experimental Lung Research. 2016. V. 42 N. 2. P. 95—102.
Vorobyeva M., Vorobjev P. and Venyaminova A. Multivalent Aptamers: Versatile Tools for Diagnostic and Therapeutic Applications // Molecules. 2016. V. 21 N. 12. P. 1612—1633.