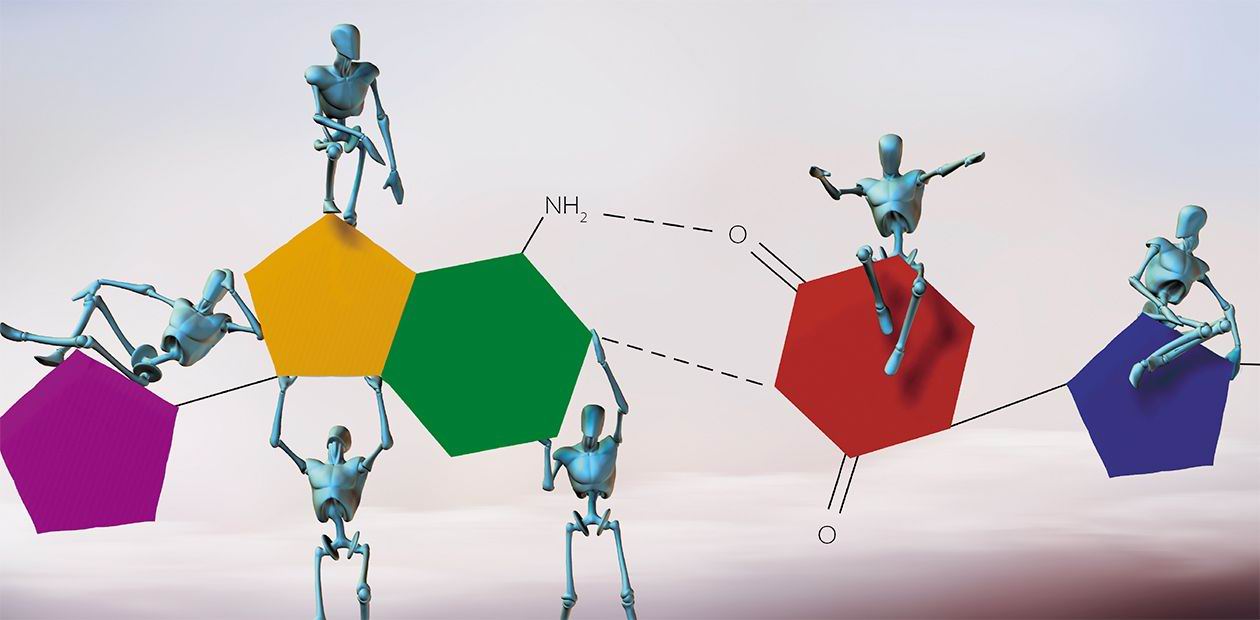
Синтетическая биология
Что такое «синтетическая биология»? Это новая и быстро развивающаяся отрасль молекулярной биологии, которая позволяет не только манипулировать с реальными генами и геномами, но и создавать совершенно новые последовательности ДНК и новые, никогда не существовавшие в природе биологические системы. Такие в прямом смысле сверхъестественные способности обязаны своим появлением стремительной эволюции молекулярных и компьютерных технологий, благодаря которым сегодня можно не только виртуально «сконструировать» любую генетическую последовательность, но и воплотить ее в жизнь. Так, еще в 2002 г. появился на свет первый полностью искусственный вирус, а еще через 8 лет – Синтия, первая жизнеспособная бактерия с полностью искусственным геномом. Эти достижения свидетельствуют о практически безграничных возможностях перепрограммирования ДНК, которые открывают не менее безграничные перспективы в самых разных областях науки и жизни, начиная от производства новых биотехнологических материалов до создания культурных растений с «улучшенным» фотосинтезом. Другое дело, что распорядиться этими «милостями не от природы» человечество должно с умом
В равноправном партнерстве с природой
 Сама идея синтетической биологии развивается «вокруг» геномной инженерии. За последние годы появились новые, крайне удобные молекулярные инструменты, с помощью которых можно каким угодно образом изменить геном практически любого организма. Да, это, может быть, дорого, можно при этом уткнуться в какую-то пока не известную проблему, но даже на текущем уровне развития технологий молекулярной биологии можно поэтапно за, условно говоря, «триллион долларов» слона превратить в мамонта, возродив этот прекрасный вымерший вид.
Сама идея синтетической биологии развивается «вокруг» геномной инженерии. За последние годы появились новые, крайне удобные молекулярные инструменты, с помощью которых можно каким угодно образом изменить геном практически любого организма. Да, это, может быть, дорого, можно при этом уткнуться в какую-то пока не известную проблему, но даже на текущем уровне развития технологий молекулярной биологии можно поэтапно за, условно говоря, «триллион долларов» слона превратить в мамонта, возродив этот прекрасный вымерший вид.
Другое дело, надо ли это делать? Ведь у синтетической биологии много других, намного более актуальных и важных задач, связанных, к примеру, с созданием средств диагностики, профилактики и лечения болезней человека, в том числе с применением персонализированного подхода, а также обеспечением продовольственной безопасности и повышения качества продуктов питания. Именно эти задачи легли в основу актуальных направлений исследований в рамках проекта САЕ «Синтетическая биология» Новосибирского государственного университета.
Когда речь зашла о заявке на прорывной проект от нашей САЕ, нам не пришлось долго думать: ее предметом стала разработка новых средств для геномного редактирования и их применение для направленного изменения человеческих клеток. Технологии геномного редактирования, появившись в последние несколько лет, произвели настоящую революцию как в науках о жизни, так и в практических областях, включая медицину, сельское хозяйство и промышленные биотехнологии. Без быстрого освоения подобных технологий Россия рискует оказаться в числе аутсайдеров.
Дьявол сидит в деталях
Первый блок нашего проекта – фундаментальный – направлен на изучение процессов, происходящих в клетке в процессе ее «редактирования»; второй – на усовершенствование инструментов редактирования, включая разработку новых ферментов, способов доставки генетического материала и методов управления внутриклеточными процессами; третий – на получение практических результатов.
 Почему так важна эта первая, фундаментальная часть? Главная проблема геномного редактирования состоит в доступности и кажущейся легкости самой технологии, в результате чего темпы ее использования намного опередили темпы «понимания» ее механизмов. Целенаправленной модификацией генома любых организмов, от бактерий до человека, сейчас может заниматься практически любая хорошо оснащенная биологическая лаборатория. Однако не более двух десятков исследовательских групп в мире реально занимаются исследованием соответствующих молекулярных механизмов и клеточных процессов, пытаются разобраться, что в действительности происходит в клетке при редактировании генов. Говорят, что дьявол сидит в деталях. Недостаток понимания приводит к низкой эффективности, что приходится компенсировать деньгами. Условно говоря, сейчас, чтобы добиться поставленной цели, приходится буквально «тыкать наугад» и вместо десяти планшетов с клетками задействовать тысячу.
Почему так важна эта первая, фундаментальная часть? Главная проблема геномного редактирования состоит в доступности и кажущейся легкости самой технологии, в результате чего темпы ее использования намного опередили темпы «понимания» ее механизмов. Целенаправленной модификацией генома любых организмов, от бактерий до человека, сейчас может заниматься практически любая хорошо оснащенная биологическая лаборатория. Однако не более двух десятков исследовательских групп в мире реально занимаются исследованием соответствующих молекулярных механизмов и клеточных процессов, пытаются разобраться, что в действительности происходит в клетке при редактировании генов. Говорят, что дьявол сидит в деталях. Недостаток понимания приводит к низкой эффективности, что приходится компенсировать деньгами. Условно говоря, сейчас, чтобы добиться поставленной цели, приходится буквально «тыкать наугад» и вместо десяти планшетов с клетками задействовать тысячу.
Если говорить про самую популярную на сегодня систему геномного редактирования CRISPR/Cas9, то пока более-менее известно, и то не до конца, лишь как работает белок Cas9, который вносит разрыв в ДНК. В том числе не очень понятно, как этот фермент находит свою мишень в геноме, так как в пробирке Cas9 работает крайне неэффективно по сравнению с большинством других ферментов: реакция требует длительного времени и многократного избытка фермента по отношению к ДНК-мишени.
В ПЕРСПЕКТИВЕ – ИНСТИТУТ! В деятельность САЕ «Синтетическая биология» сейчас вовлечена практически вся биологическая часть факультета естественных наук НГУ. Одно из важнейших направлений работы – модернизация образования. В первую очередь это создание новых магистерских программ. Яркий пример – программа «Биотехнология», созданная под руководством заведующего лабораторией бионанотехнологии, микробиологии и вирусологии, чл.-корр. РАН С. В. Нетесова в сотрудничестве с ГНЦВБ «Вектор», Институтом химической и фундаментальной биологии СО РАН и Биотехнопарком Кольцово.
В деятельность САЕ «Синтетическая биология» сейчас вовлечена практически вся биологическая часть факультета естественных наук НГУ. Одно из важнейших направлений работы – модернизация образования. В первую очередь это создание новых магистерских программ. Яркий пример – программа «Биотехнология», созданная под руководством заведующего лабораторией бионанотехнологии, микробиологии и вирусологии, чл.-корр. РАН С. В. Нетесова в сотрудничестве с ГНЦВБ «Вектор», Институтом химической и фундаментальной биологии СО РАН и Биотехнопарком Кольцово.
В мае 2016 г. началась работа по созданию магистерской программы «Структурная биоинформатика» под руководством заведующей лабораторией структурной биоинформатики и молекулярного моделирования НГУ А.Ю. Бакулиной. Эта деятельность оказалась настолько эффективной, что уже в сентябре были набраны первые магистранты, преимущественно выпускники механико-математического факультета НГУ. Междисциплинарный характер новых магистерских программ – не случайность, а одна из основных тенденций в развитии САЕ.
Обязательное условие программы САЕ – партнерство. НГУ всегда тесно взаимодействовал с СО РАН, но сейчас этого недостаточно. Очень важно привлечь к совместной работе представителей бизнеса, тем более что у нас есть такие соседи, как Технопарк Новосибирского академгородка и Биотехнопарк Кольцово. У нас много общих интересов в области науки и образования. Научное сообщество по-прежнему заинтересовано в повышении эффективности практического использования научных разработок. А представители бизнеса видят в НГУ источник квалифицированных кадров и готовы участвовать в разработке специализированных инжиниринговых магистерских программ. В результате САЕ должна стать неким сплавом науки, образования и бизнес-структур, привлекательным для студентов не только из нашей страны и ближнего зарубежья.
Сейчас мы занимаемся переоборудованием небольших учебных помещений, где будут располагаться лаборатории Центра перспективных биомедицинских исследований НГУ, а в более долгосрочных планах – создание при университете отдельного Института синтетической биологии
Следующий шаг при геномном редактировании – внесение в клетку нового генетического материала, который предполагается встроить в разрыв ДНК. На сегодня процесс генетической рекомбинации (перестройки ДНК) на основе такого нового искусственного олигонуклеотида – это настоящий «черный ящик». В принципе мы уже довольно много знаем о механизмах рекомбинации у человека, но только в «штатных» ситуациях. И знаем, что хотя рекомбинация при формировании половых клеток или при репарации («ремонте») поврежденной ДНК идет по одной и той же принципиальной схеме, детали этих механизмов совершенно различны. Чтобы разобраться в механизмах рекомбинации при геномном редактировании, узнать, насколько в них задействована система обычной рекомбинации, а насколько какие-то новые элементы, потребуется еще лет двадцать.
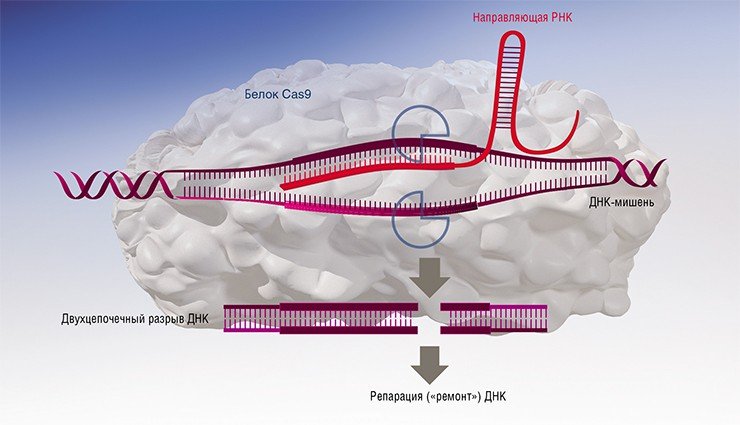
Но зато когда мы сможем во всем этом разобраться, то получим возможность регулировать сам путь, по которому идет редактирование. Как известно, целью обычно является выключение гена или изменение его функции. Выключить проще, потому что в данном случае достаточно внести разрыв, который клетка «заштопает», обычно с ошибками. Причем клетка предпочтет этот простой путь и тогда, когда мы планируем провести замену фрагмента с рекомбинацией: клеточные системы в этом случае «норовят» не заменить, а выключить мишень. Сейчас многие исследователи работают над решением этой проблемы, начиная с таких простых вещей, как ингибирование ферментов, которые в этом процессе участвуют. Например, оказалось, что один из таких ферментов ингибируется обычным кофеином, и если клетки получают такую «дозу», рекомбинация идет лучше.
Что касается усовершенствования инструментария редактирования генома, то я вижу здесь два принципиальных пути. Во-первых, можно каким-то образом модифицировать и улучшать уже известные ферменты, такие как Cas9. Структура этих белков хорошо изучена, и можно вносить в нее мутации для повышения их точности или эффективности. Кроме того, в качестве адресующих структур, которые ищут и распознают нужный фрагмент гена, можно использовать не обычные направляющие РНК, а модифицированные нуклеиновые кислоты, благодаря которым можно повысить скорость или точность поиска мишени. В нашем проекте над этой задачей будет работать группа под руководством чл.-кор. РАН Д. В.Пышного.
Второй путь – поиск принципиально новых способов геномного редактирования. Мы сейчас довольно много знаем о том, как белки взаимодействуют с ДНК, более того, с конца прошлого века накопилось довольно много описаний интересных феноменов в этой области, которые в то время были непоняты и не объяснены. Например, было обнаружено, что в клетках с определенной эффективностью будут происходить мутации и геномные замены даже в том случае, если их просто обработать олигонуклеотидами! Сейчас в наших руках есть все необходимые технологии, чтобы исследовать процессы, которые при этом происходят.
Чем заменить хорька?
Ценность всех наших исследований, включая фундаментальные, еще и в том, что их результаты могут стать основой новых технологий, не подпадающих под уже имеющиеся патенты. Дело в том, что вся область геномного редактирования сейчас полностью «покрыта» патентами людей, которые эти технологии создали и чье финансирование исчисляется миллиардами долларов. В этом смысле нам с ними тягаться бесполезно – выгоднее попытаться найти собственные обходные пути.
Практическим выходом наших работ должен стать не возрожденный мамонт, на которого в любом случае денег не хватит, а вполне реальные новые клеточные линии, которые могут быть использованы в различных фармакологических исследованиях для поиска лекарств против таких широко распространенных заболеваний, как грипп, болезнь Паркинсона и рак молочной железы.
САЕ представляют собой своего рода научно-образовательные консорциумы, объединяющие многих участников. В случае «Синтетической биологии» партнерами НГУ стали все институты биологического профиля Сибирского отделения РАН, а также Сколковский институт науки и технологий (Москва), где работает один из лучших в России специалистов по геномному редактированию, профессор К. В. Северинов. Были привлечены и давние партнеры из Университета Париж-XI, специализирующегося на точных науках, который станет частью «суперуниверситета», создаваемого на основе нескольких парижских и провинциальных вузов в рамках французской академической реформыНапример, сегодня наиболее подходящей моделью для поисков и тестирования лекарств от гриппа считаются не лабораторные мыши, которые от него гибнут, а гораздо более крупные и требовательные животные – хорьки. У этих животных клетки легочного эпителия схожи с человеческими, поэтому они в высшей степени восприимчивы к вирусу гриппа человека и издавна используются фармакологами. Если нам удастся при помощи геномного редактирования создать линии человеческих клеток с разной чувствительностью к вирусам гриппа, это намного упростит поиск соответствующих лекарств.
 Еще одна подзадача – получение клеточных линий для тестирования токсичности новых химических соединений, которых ежегодно синтезируется сотни тысяч. Все эти вещества необходимо тестировать на безопасность для человека, для чего обычно предпочитают использовать лабораторных животных. Дело в том, что при тестировании на токсичность традиционно предпочитают «перебдеть, чем недобдеть», а результаты, полученные на стандартных клеточных линиях, обычно искажают показания в сторону меньшей токсичности по сравнению с данными, полученными на животных. Действительно, отдельные клетки оказываются более устойчивыми к негативным воздействиям, так как в организме, как правило, есть свое «слабое звено» – небольшие клеточные популяции особо «ранимых» клеток (например, стволовых), которые и будут определять устойчивость всей особи. Так как сейчас движение за отказ от использования животных в подобных исследованиях набирает обороты, новые генетически модифицированные линии клеток с повышенной восприимчивостью смогут стать адекватной заменой.
Еще одна подзадача – получение клеточных линий для тестирования токсичности новых химических соединений, которых ежегодно синтезируется сотни тысяч. Все эти вещества необходимо тестировать на безопасность для человека, для чего обычно предпочитают использовать лабораторных животных. Дело в том, что при тестировании на токсичность традиционно предпочитают «перебдеть, чем недобдеть», а результаты, полученные на стандартных клеточных линиях, обычно искажают показания в сторону меньшей токсичности по сравнению с данными, полученными на животных. Действительно, отдельные клетки оказываются более устойчивыми к негативным воздействиям, так как в организме, как правило, есть свое «слабое звено» – небольшие клеточные популяции особо «ранимых» клеток (например, стволовых), которые и будут определять устойчивость всей особи. Так как сейчас движение за отказ от использования животных в подобных исследованиях набирает обороты, новые генетически модифицированные линии клеток с повышенной восприимчивостью смогут стать адекватной заменой.
Если мы не выиграем конкурс прорывных проектов, это не означает, что вся наша деятельность в области геномного редактирования прекратится. Исследования, безусловно, будут развиваться, только меньшими темпами.
Уже в рамках текущего финансирования мы создали новую структуру под названием «Центр перспективных биомедицинских исследований», которая объединит шесть университетских лабораторий, имеющих отношение к геномному редактированию. И хотя на какие-либо фантастические результаты в этом случае рассчитывать не приходится, но, опираясь на интеллектуальные и материальные ресурсы институтов СО РАН, мы способны создать, возможно, лучший в России центр в этой области.
В этом смысле конкурентов у нас немного, за исключением того же Сколково, отечественных научных групп, занимающихся фундаментальными работами по геномному редактированию, очень мало.
Д.б.н., профессор РАН Д. О. Жарков
Семь раз примерь, один – синтезируй!

Среди всех участников САЕ НГУ «Синтетическая биология» мне хотелось бы в первую очередь отметить лабораторию структурной биоинформатики и молекулярного моделирования НГУ, возглавляемую А. Ю. Бакулиной, с которой мы поддерживаем тесное сотрудничество. Занимается она разработкой и применением технологий компьютерного моделирования применительно к биологическим макромолекулам – я считаю это направление одним из самых важных в современной синтетической биологии.
Традиционный подход в создании новых соединений состоит в том, что проводится много синтезов, получают массу вариантов, а из них уже выбирают подходящие. Благодаря же расчетным технологиям мы сначала можем спрогнозировать свойства будущего соединения, «спроектировать» его, а уже потом его создавать. То есть исследователь может заранее просчитать и оценить результат. Значимость этого трудно переоценить, когда речь идет о таких сложных молекулах, как производные олигонуклеотидов (коротких фрагментов нуклеиновых кислот), и вы хотите, к примеру, знать, будут ли они адекватно соответствовать структуре двойной спирали ДНК по размеру, прочности и другим структурным характеристикам.
Конкретная задача, которой занимаются физики из нашей лаборатории биомедицинской химии, – отработка методик и расчетов, которые лягут в основу таких компьютерных алгоритмов. И хотя полностью она еще не решена, успехи уже есть.
Нужно сказать, что технологии молекулярного докинга (метода молекулярного моделирования, позволяющего предсказать ориентацию и положение молекул, наиболее выгодные для образования устойчивого комплекса) в мире сейчас очень популярны, и в первую очередь в связи с поиском и созданием новых лекарственных соединений. Например, с помощью этих компьютерных технологий можно отобрать молекулы, способные с высокой эффективностью связываться с определенным участком белка-фермента и тем самым блокировать его работу.
Такие технологии, безусловно, нужно развивать, причем в более «глобальном» формате. Под последним я подразумеваю обращение к олигомерам (молекулам в виде цепочки из небольшого числа однотипных составных звеньев), тогда как в случае традиционного докинга речь идет, как правило, о низкомолекулярных соединениях. В качестве таких «среднемолекулярных» соединений могут выступать не только стандартные олигонуклеотиды, но и любые другие искусственно созданные молекулярные блоки в виде самых разных олигомерных цепочек. И в этом случае на первый план выходит компьютерное моделирование, так как число вариантов при этом резко возрастает.
Что касается химических методов получения искусственных олигомеров, то технический базис для этого у нас уже имеется. Хотя пока мы используем эти технологии с целью повысить функциональность тех же олигонуклеотидов для придания им дополнительной гидрофобности, введения репортерной метки и т. п. Ведь в этой области также есть еще много нерешенных вопросов, таких как доставка соединений в живые клетки. К примеру, для этой цели часто используется вариант, когда к олигонуклеотиду присоединяют специальные химические группировки (например, остаток холестерина), но это не всегда оправданно и эффективно. А ведь для модификации олигонуклеотидов можно использовать те же самые дополнительные ненуклеотидные цепочки, звенья которых сами по себе будут играть роль функциональных группировок с нужными свойствами.
Этот подход в перспективе может привести к созданию нового типа олигомерных агентов ненуклеотидной природы, для которых будет характерно огромное потенциальное разнообразие функциональных свойств отдельных звеньев, вероятно, даже большее, чем в случае использования аминокислот. И, конечно, есть задумка когда-нибудь окончательно отказаться от олигонуклеотидов и создать на основе уже хорошо «проработанной» нуклеотидной химии что-то совершенно новое вроде мультифункциональных олигомеров.
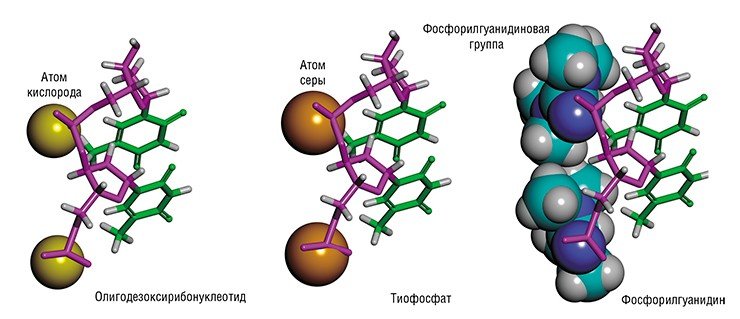
В качестве примера практических результатов в области синтетической биологии хочу привести фосфорилгуанидины – созданные в ИХБФМ СО РАН новые химические аналоги нуклеиновых кислот, прикладными приложениями которых сейчас активно занимаются в лаборатории химии нуклеиновых кислот (руководитель к. х. н. Д. А. Стеценко) и в нашей лаборатории биомедицинской химии.
В фосфорилгуанидинах – искусственных аналогах нуклеиновых кислот – «мостиками» между звеньями-нуклеотидами служат не отрицательно заряженные фосфатные группы, а «нейтральные» фосфорилгуанидиновые. Такая химическая трансформация облегчает им проникновение сквозь липидные мембраны живых клеток, придает устойчивость к разрушающему действию ферментов и способность образовывать прочные комплексы с клеточными ДНК и РНК. Благодаря этим свойствам фосфорилгуанидиновые олигонуклеотиды могут стать основой для создания средств медицинской диагностики и лекарственных препаратов нового поколенияТак, совместно с британскими учеными уже подана заявка на патент на использование этих соединений при терапии тяжелого генетического заболевания – мышечной дистрофии Дюшенна, которая приводит к полной потере способности двигаться и в итоге к смерти. Причина болезни – мутация, следствием которой служит нарушение процесса сплайсинга (вырезания фрагментов) при созревании информационной РНК, в результате чего в клетках синтезируется «неправильный» белок дистрофин, являющийся важным структурным компонентом мышечной ткани.
Корректировать этот патологический процесс можно с помощью олигонуклеотидов, и, как показали исследования на лабораторных животных, для этой цели хорошо подходят наши фосфорилгуанидины. Последние работают не хуже, чем морфолиновые олигомеры, совсем недавно разрешенные в США к практическому применению. В обоих этих случаях был реализован один и тот же принцип, хотя и на разных платформах. Конечно, такая терапия означает пожизненные уколы, но альтернативным вариантом является лишь редактирование генома, которое на сегодняшний день недоступно, хотя и становится все более реальным с течением времени.
На основе фосфорилгуанидинов можно создавать противобактериальные препараты нового поколения. Идея в том, что обычный антибиотик является низкомолекулярным соединением, к которому бактерии довольно быстро вырабатывают устойчивость. В случае же олигонуклеотидов и их аналогов, являющихся ген-направленными соединениями, мы воздействуем непосредственно на первопричину, т.е. на геном возбудителя. Работы по созданию таких антибиотиков, к которым бактериям не так просто выработать устойчивость, уже ведутсяСегодня мы сконцентрировались на еще одном очень важном практическом применении фосфорилгуанидинов – диагностике заболеваний. Есть тип диагностических сенсоров на основе полупроводниковых нанопроволок, работающих по принципу полевых транзисторов. Проводимость такого нанопроводника меняется, когда на его поверхности появляется заряд. Молекула же фосфорилгуанидинового олигонуклеотида, в отличие от обычного, сама по себе не имеет заряда. Иммобилизованный на поверхности проводника, такой олигонуклеотид способен специфично связаться с заряженной РНК-мишенью – нуклеотидным маркером того или иного заболевания. При этом детекция сигнала с проводника будет идти лишь в случае успешного связывания с мишенью, несущей электрический заряд. В экспериментах, проводимых совместно с новосибирским Институтом физики полупроводников им. А. В. Ржанова СО РАН было доказано, что с помощью сенсора, на который «посажены» производные фосфорилгуанидинов, можно действительно без дополнительных меток получать прямой диагностический сигнал.
Возвращаясь к технологиям компьютерного моделирования, напомню, что в состав «Центра перспективных биомедицинских исследований», созданного в НГУ в рамках САЕ «Синтетическая биология», войдет новая лаборатория белковой инженерии. Как видно из названия, она будет заниматься созданием новых ферментов и других белков с измененными свойствами, которые предполагается использовать для нужд биотехнологии либо в качестве терапевтических препаратов или молекулярных инструментов. Ведь виртуально «спроектировав» и изучив ту или иную нужную белковую молекулу, нужно затем обратиться к методам генной инженерии, чтобы начать ее реально производить. То есть встает конкретная задача синтезировать соответствующие генные последовательности – искусственные гены.
Чтобы «собрать» один такой ген, требуется в определенном порядке соединить несколько сотен искусственно синтезированных нуклеотидных цепочек! Отмечу, что в России подобных технологий практически нет, как нет и научных коллективов, которые занимаются этой проблематикой. Исключением служит группа к. х. н. А. Н. Синякова из нашей лаборатории, которая добилась немалых успехов в разработке методов синтеза олигонуклеотидов на поверхности специальных чипов – небольших кремниевых пластинок со множеством ячеек, где можно одновременно синтезировать большое число нуклеотидных последовательностей разного состава.
Наши исследователи совместно со специалистами из Института физики полупроводников им. А. В. Ржанова и Института автоматики и электрометрии СО РАН разработали и уже апробировали чиповую технологию синтеза олигонуклеотидов, основанную на использовании фотолабильных защитных групп или фотогенераторов кислот. В дальнейшем набор этих олигонуклеотидов подвергают ряду специальных обработок, чтобы в итоге получить целевую генную последовательность.
Заметим, что поскольку технологии эффективного синтеза искусственной ДНК открывают новые возможности не только в промышленности, медицине и сельском хозяйстве, но и в создании биологического оружия, в мире предпринимаются практические действия по ограничению их распространения. Это означает, что подобные установки в нашу страну экспортироваться не будут. Создание же отечественного микрочипового синтезатора – это наш реальный шаг к созданию искусственных генов, что является одним из краеугольных камней синтетической биологии. А от этого недалеко и до создания искусственных живых клеток, а в более отдаленной перспективе – и целых организмов.
Член-кор. РАН, д.х.н. Д. В. Пышный
Когда репарация под запретом

Научно-исследовательское подразделение по исследованию защитных репарационных систем, которым я руковожу в рамках САЕ «Синтетическая биология» НГУ, фактически состоит из тех сотрудников трех лабораторий Института химической биологии и фундаментальной медицины СО РАН, которые наиболее тесно сотрудничают с университетом, – моей лаборатории биоорганической химии ферментов, лаборатории исследования модификации биополимеров (руководитель – д. х. н. О. С. Федорова) и лаборатории ферментов репарации (руководитель – д. х. н. Г. А. Невинский).
Мы занимаемся фундаментальными исследованиями систем репарации ДНК, результаты которых важны для понимания механизмов старения и могут стать основой для конструирования ингибиторов ферментов репарации («ремонта») ДНК, представляющих интерес для медицины. Все эти работы основаны на междисциплинарном сотрудничестве, которое раньше поддерживалось специальными интеграционными проектами СО РАН, а теперь переместилось на площадку университета. Этому очень важному вопросу посвятил свой доклад ректор НГУ, чл.-корр. РАН М. П. Федорук на последней научной сессии Общего собрания СО РАН. Он назвал такой переход новым вектором развития Новосибирского академгородка. САЕ позволяет не только более эффективно организовать междисциплинарное сотрудничество, но и активно включать в исследования студентов и магистров НГУ.
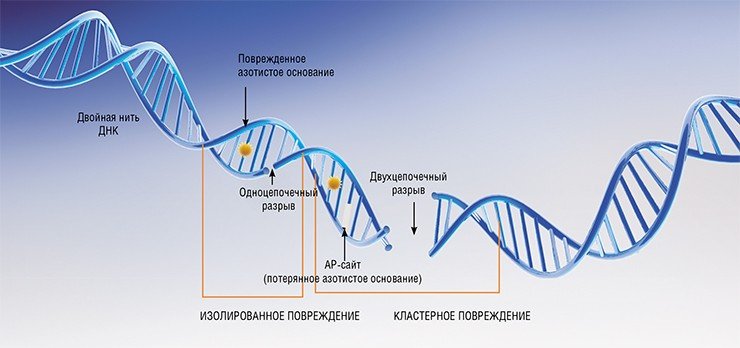
Возвращаясь к системам репарации ДНК, нужно сказать, что сейчас мы отчетливо понимаем, что все белки репарационной системы, ответственной за исправления повреждений ДНК, представляют собой потенциальные мишени для лекарственных препаратов. Универсальной мишенью является, к примеру, ядерный белок поли(АДФ-рибоза)-полимераза 1 (PARP1) – важнейший регулятор репарации ДНК, ингибирование которого может дать выраженный эффект при онкологических заболеваниях, а также ишемическом инсульте и других патологиях.
PARP1 является «сенсором» повреждений ДНК: он первым распознает ее разрывы и присоединяется к этим местам, начиная активно синтезировать олиго- или поли(АDP)-рибозные цепочки, которые ковалентно связываются с разными акцепторными белками и в том числе с самой PARP1. В результате в месте разрыва происходит деконденсация хроматина, что облегчает доступ ферментов репарации. Таким образом, PARP1 способствует восстановлению повреждений ДНК, в том числе и в раковых клетках при традиционной химио- или радиотерапии, что отрицательно сказывается на эффективности лечения.
Что касается случаев нарушения мозгового кровообращения в результате ишемии, то при множественных повреждениях генома гиперактивация PARP1 приводит к быстрому истощению имеющихся в них энергетических запасов в виде молекул АТФ, что чревато необратимой гибелью нейронов.
Идея ингибировать в подобных ситуациях активность PARP1 как универсального регулятора процессов репарации на первый взгляд представляется очень привлекательной. Но не надо забывать, что этот фермент является многофункциональным белком, и, как показывают многочисленные исследования, подавляя его репарационную активность, мы одновременно подавляем и другие его функции. Сегодня на основе ингибитора PARP-1 выпускается лекарство олапариб (линпарза), которое применяется для лечения некоторых видов рака, включая рак яичника. Тем не менее его рекомендовано применять с осторожностью из-за большого числа нежелательных побочных эффектов.
Поэтому в своих исследованиях мы работаем не только с этой универсальной, но и с другой, специфической мишенью – ферментом репарации тирозил-ДНК-фосфодиэстеразой 1 (Tdp1).
Дело в том, что в клетке существуют ферменты топоизомеразы, участвующие в динамичном поддержании определенной конформации двойной спирали ДНК. Топоизомеразы типа I вносят разрыв в цепь ДНК, ковалентно соединяясь с одним из его концов, после чего в дальнейшем происходит восстановление цепи. Противораковые препараты на основе камптотецина стабилизируют продукты этого ковалентного присоединения, не давая «залатать» повреждение, вносимое топоизомеразой, в результате чего опухолевая клетка погибает. Однако Tdp1 способен «снимать» эту стабилизацию, поэтому использование ингибиторов этого фермента даст возможность усилить эффективность основной противоопухолевой терапии.
Эта работа выполняется нами совместно с лабораторий физиологически активных веществ Новосибирского института органической химии им Н. Н. Ворожцова СО РАН (руководитель – д. х. н. Н. Ф. Салахутдинов), а также с группой к.б.н. Н. А. Поповой из Инстититута цитологии и генетики СО РАН. В экспериментах на лабораторных животных с привитой опухолью благодаря применению самого эффективного из разработанных ингибиторов удалось добиться значительного (до 50 %) уменьшения основной опухоли и практически полного исчезновения метастазов. Сейчас мы пытаемся получить финансирование для проведения уже клинических испытаний этого перспективного противоракового препарата.
И конечно, нужно отметить такое очень важное направление, как геномное редактирование с использованием системы CRISPR/Cas9, с помощью которого можно «выключать» сами гены, отвечающие за возникновение болезней. На этом переднем крае науки мы отстаем, тогда как в Европе и США уже создано множество коммерческих фирм, где эти технологии используются для создания нужных мутаций в целевых генах. Тем не менее, совершенно необходимо продолжать заниматься научно-исследовательскими разработками, которые повысят эффективность этого подхода.
Сегодня НГУ является не только «питомником» будущих исследователей – в его рамках активно идет развитие исследовательских структур. На мой взгляд, именно на таких университетских площадках и нужно создавать возможности для формирования новых научных подразделений под руководством перспективных молодых ученых. Почему, чтобы получить мегагранты, нам сегодня нужно приглашать специалистов из-за рубежа, зачастую наших бывших соотечественников, которые уже не могут там работать в силу своего возраста? В это же время лучшие представители нашей научной молодежи, не получая достаточного финансирования для своих работ, вынуждены искать себе место за границей. Почему мы не поддерживаем молодые таланты, которые выросли в нашей стране? Или мы собираемся вернуть их, когда они достигнут пенсионного возраста? Такой подход выглядит очень странным.Обратная сторона этого явления – невозможность пригласить на длительный срок молодого зарубежного специалиста, как это делается во всем мире. Сегодня нельзя организовать долгосрочную визу, рабочее место больше, чем на два-три месяца. В результате у нас нет нормального обмена молодыми кадрами с зарубежными лабораториями, и «зеленый свет» реально дан лишь в одну сторону – за границу. Поэтому и средства, которые наша страна вкладывает в образование, «отрабатывают» не у нас, а за рубежом. Эту проблему также пока никто не собирается серьезно решать.
То же самое можно сказать и о многих других проблемах, связанных с обеспечением эффективности отечественных научных исследований (трудности с заказами реактивов и их своевременной поставкой из-за рубежа, непомерно высокие цены и т. д.). Надо начинать с фундамента – подвиги не могут длиться десятилетиями
В рамках САЕ «Синтетическая биология» мы будем сотрудничать с НГУ как раз в этом направлении, конкретно – с лабораторией геномных технологий, которой заведует д.б.н. Д. О. Жарков. Одна из задач, решением которой будет заниматься к.х.н. Н.А. Кузнецов, касается исследования детальной кинетики функционирования белковых комплексов именно в этой системе геномного редактирования. Другими словами, предстоит изучить, как в термодинамическом режиме происходит на ДНК сборка комплекса CRISPR/Cas9 из отдельных компонентов. Это будет по-настоящему пионерная работа, так как в современном мире зачастую больше обращают внимание на конечный результат, а не на особенности самого процесса, что неправильно, так как понимание механизма помогает усовершенствовать практические технологии.
CRISPR/Cas9 – это, действительно, очень хороший инструмент для исследовательских и, безусловно, медицинских целей. В то же время нужно отдавать себе отчет, что результат не всегда будет однозначным, по крайней мере, не для всех болезней. Например, за возникновение раковых опухолей отвечает не один ген, поэтому попасть «в яблочко» в таких случаях не так просто. При своем появлении каждый новый метод всегда вызывает только восторженные отклики, но чем больше его применяют, тем больше вскрывается недостатков. Поэтому понимание механизмов, лежащих в его основе, будет далеко не лишним.
К примеру, разрыв нити ДНК в процессе «редактирования» – результат работы белка Cas9, может «залатываться» системами репарации, которыми мы занимаемся. Кстати, любой разрыв в ДНК очень эффективно распознает как раз та самая, интенсивно нами изучаемая PARP1. Этот фермент может влиять на процесс направленной модификации гена-мишени, так как он участвует в регуляции системы «ремонта» двойных разрывов нитей ДНК и влияет на соотношение процессов негомологичной и гомологичной рекомбинации. Поэтому исследования систем репарации очень важны для повышения эффективности работы систем редактирования генома, которые играют столь большую роль в современной синтетической биологии.
Член-кор. РАН, д.х.н. О. И. Лаврик
Литература
Власов В. В., Жарков Д. О., Пышный Д. В. Приручение древней молекулы // НАУКА из первых рук. 2014. № 3—4. С. 84—91.
Купрюшкин М. С., Пышный Д. В., Стеценко Д. А. Фосфорилгуанидины. Новый класс аналогов нуклеиновых кислот // Acta Naturae. 2014. Т. 6. № 4(23). С. 53—55.
Немудрый А. А., Валетдинова К. Р., Медведев С. П., Закиян С. М. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3. С. 20—42.
Пышный Д. В., Cтеценко Д. А. Фосфорилгуанидины – новые химические аналоги нуклеиновых кислот. // Наука из первых рук. 2014. № 5. C. 6—9.
Ширяева А. А., Северинов К. В. Системы CRISPR/Cas бактерий и архей. Как компоненты адаптивной иммунной системы прокариот стали универсальным и эффективным инструментом модификации геномов, исследования эпигеномов и управления транскрипцией генов? / Редактирование генов и геномов. Ред. С. М. Закиян, С. П. Медведев, Е. В. Дементьева, В. В. Власов Новосибирск: Издательство СО РАН, 2016. С. 133—169.
Barrangou R., Doudna J. A. Applications of CRISPR technologies in research and beyond // Nat. Biotechnol. 2016. V. 34. N. 9. P. 933—941.