Зачем «читать» геном Synedra acus?
Кремний играет особую роль в жизни диатомовых водорослей, клетки которых покрывают прозрачные панцири из кремнезема: его содержание в общей биомассе водорослей может достигать 50%. Диатомее нужно решить сразу несколько очень непростых проблем: сначала добыть кремниевую кислоту из окружающей среды – морской или пресной воды, и какое-то время хранить ее в клетке, а затем доставить в определенные точки формирующейся створки клеточного панциря, где она должна полимеризоваться. Весь процесс отложения кремнезема внутри клеток диатомей должен очень точно регулироваться, однако до сих пор молекулярные биологи не имеют полного представления о путях реализации информации, записанной в их геномах
В 2015 г. наша исследовательская группа из Лимнологического института СО РАН опубликовала расшифрованный геном диатомовой водоросли Synedra acus, обитающей в Байкале. И хотя сейчас «прочитать» геном живого организма гораздо проще и дешевле, чем лет десять назад, эта работа по-прежнему требует сложного оборудования и дорогостоящих реактивов. Почему же ученые из ЛИНа взялись за этот масштабный проект, и почему именно диатомовая водоросль была выбрана в качестве объекта исследования?
Диатомовые водоросли представляют большой интерес для ученых из самых разных областей науки. Благодаря своей многочисленности, разнообразию и широкому распространению – от океанов и озер до торфяных болот и антарктических льдов – диатомеи обеспечивают до 20 % первичной продукции биосферы Земли, к тому же клетки этих водорослей заключены в кремнеземные створки сложной наноразмерной структуры, хорошо сохраняющиеся в геологических отложениях. Тем не менее на данный момент опубликованы геномы всего шести видов диатомей, включая нашу синедру, а это очень мало для такой огромной группы (Armbrust et al., 2004; Bowler et al., 2008; Tanaka et al., 2015; Галачьянц и др. 2015).
К примеру, в близкой к диатомеям группе оомицетов – сходных с грибами организмов с многоядерным мицелием, y одного только рода фитофтора было отсеквенировано четыре вида из сотни. Дело в том, что фитофторы – это печально известные патогены культурных растений, и если анализ их генома позволит разработать более эффективные методы борьбы с ними, то потраченные на это средства тут же окупятся стократно. Диатомеи же до последнего времени интересовали преимущественно фундаментальную науку. С другой стороны, если ученым удастся «реконструировать» механизмы формирования кремнеземных створок, это станет настоящим прорывом в нанотехнологиях, но не раньше, чем исследования будут завершены. Сейчас же геномикой диатомей во всем мире занимается меньше десятка лабораторий.
Геном как ключ к эволюции диатомей
Секвенирование генома позволяет решать ряд важных задач, которые нельзя или затруднительно решить с помощью других методов исследования, таких как микроскопия или биохимический анализ.
С помощью метода молекулярных часов удалось установить, что диатомовые водоросли появились около 230 млн лет назад. Вероятно, первые диатомеи были обнаженными жгутиковыми клетками (в настоящее время их относят к Heterokonta – разножгутиковым, так как на некоторых стадиях жизненного цикла они имеют один жгутик с тончайшими волосками).
Самые ранние отложения диатомей были найдены в Корее, в осадках, сформировавшихся на суше. Была высказана гипотеза, что океан, отступивший около 230 млн лет назад, оставил за собой лужи, где и обитали жгутиковые диатомеи. Они стали использовать кремнезем, тормозящий процесс старения, чтобы переживать в стадии покоя неблагоприятные условия.
Древние диатомеи потребляли так много кремнезема, что он начал осаждаться в клетках, по-видимому, сначала в виде маленьких чешуек, которые выдавливались из клеток и создавали вокруг них защитную оболочку, препятствующую обезвоживанию при высыхании мелководных водоемов» (Медлин, Симс, 2006, с. 28)
Во-первых, благодаря знанию генетической информации становится гораздо проще искать белки, отвечающие за те или иные функции (Галачьянц и др., 2015). После завершения геномного проекта у исследователя имеется несколько десятков тысяч «прочтенных» генов и, соответственно, предсказанных белков. Часть этих генов может быть опознана сразу, потому что аналогичные им уже были изучены и описаны у других организмов. Для остальных можно, по крайней мере, оценить массу белков, которые они кодируют, а также провести поиск «родственников» в других геномах. Также несложно выяснить, является ли искомый белок трансмембранным или нет, и в какую клеточную органеллу он направится после синтеза. А при наличии транскриптомов (совокупности всех «считанных» с генов нуклеотидных последовательностей, включая мРНК и некодирующие РНК, которые клетка синтезирует в тот или иной период времени) можно узнать, при каких обстоятельствах экспрессируется, т. е. начинает работать тот или иной ген.
Нашу группу в первую очередь интересуют гены, вовлеченные в метаболизм кремния, в то время как основная цель, например, группы японского исследователя Т. Танаки, «прочитавшей» геном Fistulifera solaris, состояла в использовании этой морской диатомовой водоросли в качестве продуцента биотоплива (Tanaka et al., 2015).
Во-вторых, лишь при наличии полных геномов (именно во множественном числе!) можно изучать некоторые аспекты эволюции, которая у группы водорослей-гетероконтов, к которым относятся диатомеи, очень интригующая.
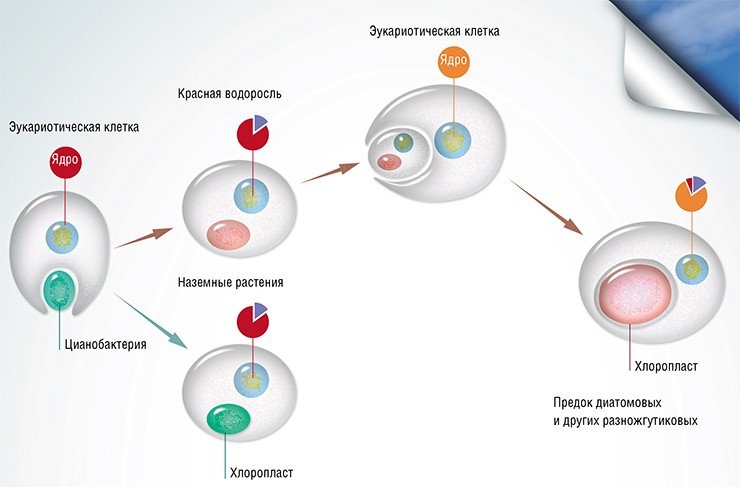
На сегодня считается доказанным, что хлоропласты растений, в которых происходит фотосинтез, обязаны своим происхождением эндосимбиозу: некогда клетка цианобактерии была поглощена эукариотической клеткой, но не переварилась, а стала функционировать внутри хозяина, постепенно упростившись до вида современной внутриклеточной органеллы. При этом большая часть генов эндосимбионта была перенесена в геном хозяина. Что же касается гетероконтов и, в частности, диатомовых водорослей, то предполагается, что их предки проглотили, в свою очередь, уже эукариотическую красную водоросль вместе с ее хлоропластом. Подтверждением этой теории служит наличие четырех (вместо обычных двух) мембран, окружающих хлоропласты диатомовых, а также открытие в их геноме свыше 170 генов красных водорослей (Bowler et al., 2008). Именно поэтому в геномах диатомей присутствуют гены, восходящие к участникам обоих эндосимбиозов. Кроме того, в них были обнаружены гены различных прокариот (протеобактерий, архей и др.), попавшие путем так называемого горизонтального переноса, а также большое количество уникальных генов, аналогов которым нет у других живых организмов.
Чтобы установить историю отдельного гена, достаточно отсеквенировать один лишь этот ген для определенной выборки организмов, что гораздо быстрее и дешевле секвенирования полного генома и позволяет включить в анализ гораздо больше видов. Но реконструкция сложных эволюционных событий требует изучения истории всех генов у всех представителей группы, и эту информацию могут дать только полные геномные исследования.
В нашем случае выбор объекта исследования был связан в первую очередь с тем, что Synedra acus является пресноводным видом. И тот факт, что она извлекает необходимое ей количество кремния даже из байкальской воды, известной своей низкой минерализацией, делает синедру идеальным кандидатом для исследования механизмов импорта этого элемента, а также других адаптаций к пресноводному образу жизни. Во-вторых, эта водоросль стала первым отсеквенированным представителем крупной группы бесшовных пеннатных диатомей, что открывает возможность проследить историю формирования тех или иных молекулярных механизмов и особенностей генома среди разных таксонов диатомовых.
Наша работа с геномом синедры не заканчивается публикацией результатов секвенирования. Уже получены многообещающие данные о структуре отдельных генов, участвующих в метаболизме кремния, и ведутся исследования соответствующих белков. В планах – получение транскриптома, что позволит оценить экспрессию интересующих нас генов и расширить знания об их регуляции.
Литература
Галачьянц Ю. П. и др. Определение нуклеотидной последовательности полного генома бесшовной пеннатной диатомеи Synedra acus subsp. Radians из озера Байкал // Докл. РАН. 2015. Т., 461 № (3). С. 348—352.
Armbrust E. V. et al. The Genome of the Diatom Thalassiosira pseudonana: Ecology, Evolution and Metabolism // Science. 2004. Vol. 306 (5693). P. 79—86.
Bhattacharya D., Qui H., Price D. C. Why we need more algal genomes. // J. Phycol. 2015. Vol. 51 N.(5). P. 1—5.
Bowler C. et al. The Phaeodactylum genome reveals the evolutionary history of diatom genomes //Nature. 2008. 456: 239—244.
Tanaka T. et al. Oil accumulation by the Oleaginous Diatom Fistulifera Solaris as Revealed by the Genome and Transcriptome // The Plant Cell. 2015. Vol. 27 N.(1). P. 162—176