Новый вариант «редактора» генома – против болезнетворных мутаций
Метод редактирования генома CRISPR/Cas, разработанный в начале 2010-х гг., открыл принципиально новые возможности для манипуляций с геномом. Ученые продолжают модифицировать первоначальный вариант, добиваясь большей эффективности и безопасности этого инструмента, оказавшегося не таким совершенным, как ожидалось
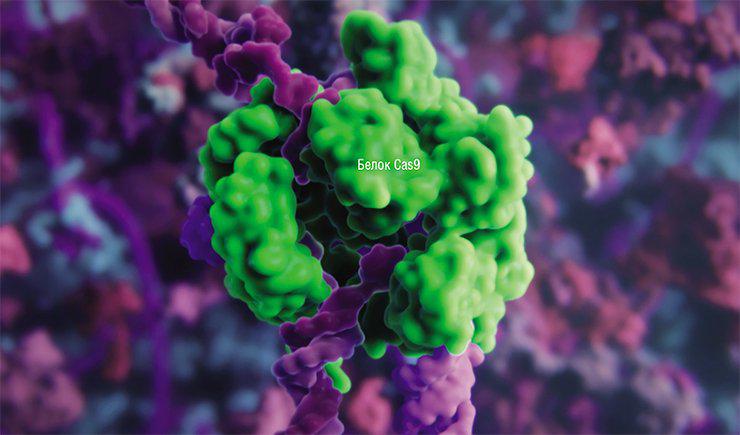
Основой революционной технологии редактирования геномов CRISPR/Cas, с помощью которой можно лечить генетические заболевания, модифицировать микроорганизмы и создавать новые породы и сорта животных и растений, стала система так называемого «иммунитета» бактерий. С ее помощью бактерии могут распознавать атаковавших их вирусов-бактериофагов и эффективно им противодействовать, уничтожая чужеродную ДНК.
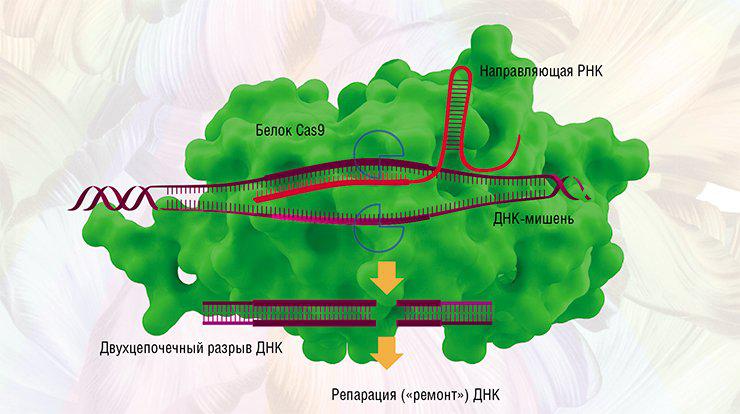
В «классическом» варианте системы редактирования генов CRISPR/Cas белок-фермент Cas9 с помощью специальной («гидовой») молекулы РНК направляют к целевой последовательности ДНК, где он комплементарно соединяется с участком-мишенью. Cas9 разрезает две нити ДНК, которые «ремонтируются» системами клеточной репарации, и в этот момент в ДНК можно встроить донорную молекулу, чтобы, к примеру, исправить мутацию.
Теоретически все выглядит замечательно, однако на практике результат не всегда совпадает с ожидаемым. Из-за неправильного «ремонта» в последовательности ДНК могут возникать ошибки. Кроме того, фермент может разрезать ДНК не в нужном месте, а в другом, похожем, что может привести к непредсказуемым последствиям.
Чтобы избавиться от таких недочетов, были созданы несколько вариантов методики. К примеру, при использовании редакторов оснований фермент исправляет в ДНК только одну «букву» (азотистое основание). Этот вариант эффективен и реже приводит к нежелательным изменениям в ДНК, но с его помощью можно воздействовать лишь на точечные мутации.
Ученые пошли дальше и два года назад разработали метод праймированного редактирования, при котором в ДНК вносятся только одноцепочечные разрывы. В этом случае «гидовая» молекула РНК несет еще одну функцию – в ней содержится генетическая информация, которую нужно встроить в ДНК. И после разрыва одной цепочки ДНК фермент обратная траснкриптаза, доставленная системой редактирования, достраивает ее в соответствии с этим образцом. В результате в нужном месте одна из двух цепочек ДНК оказывается «переписанной». Если цикл повторить, нацелив другую гидовую РНК на вторую цепочку, редактируемый участок можно «переписать» полностью.
Сейчас исследователи из Нидерландов протестировали этот метод на культивированных стволовых клетках человека. Сначала им удалось с его помощью внести в клетки онкогенные мутации.
Исследователи также работали с органоидами кишечника человека – крошечными трехмерными клеточными структурами, имитирующими функциональный кишечник. Эти клетки несли мутации в гене CFTR, кодирующем белок–трансмембранный регулятор муковисцидоза, участвующий в транспорте ионов хлора через клеточную мембрану.
Муковисцидоз – одно из распространенных генетических заболеваний, характеризующееся повышенной вязкостью секретов желез. Такая слизь закупоривает выводные железистые протоки в легких, поджелудочной железе, печени и кишечнике, вызывая воспалительный процесс. И хотя способы разжижения слизи существуют, в целом муковисцидоз неизлечим. После применения праймированного редактирования органоиды стали «здоровыми», что позволило сделать вывод о высокой эффективности методики.
Полногеномное секвенирование (определение всей последовательности нуклеотидов в ДНК) в клетках этих органоидов не выявило заметных нецелевых эффектов воздействия, хотя некоторые нежелательные мутации все же были обнаружены. Но, по мнению ученых, этот вариант является более безопасным, чем традиционный CRISPR/Cas.
Таким образом, метод праймированного редактирования можно использовать как для создания моделей заболеваний, так и для исправления болезнетворных мутаций в стволовых клетках взрослого человека. Тем не менее он все еще требует дальнейшей оптимизации, чтобы его можно было использовать в медицинской практике.
Фото: https://www.flickr.com