Часовые генома
Каждую секунду в клетках нашего тела возникает множество повреждений ДНК - число их измеряется квадриллионами. К счастью, лишь очень немногие из них приводят к последствиям в виде мутаций или возникновения раковых опухолей. Каким образом исправляется подавляющее большинство повреждений? Что происходит, когда системы их коррекции дают сбой? Об этом и о многом другом рассказывает эта статья
Эта история началась как в персидской поэме-сказке «Восемь райских садов» Амира Хосрова Дехлеви, написанной еще в XIV в. Жили некогда три брата-принца на острове Цейлон, именуемом тогда Серендипом. И была у них особенность – когда они что-то искали, то находили совершенно другое, но при этом еще более нужное. Почти пять столетий спустя это сказание прочел английский писатель Г. Уолпол и придумал слово serendipity. Считается, что оно входит в список десяти английских слов, самых трудных для перевода, но суть его понятна из легенды – это способность делать неожиданные удачные открытия «по случаю». Неудивительно, что именно в научном мире слово это употребляется особенно часто.
Вот так «по-серендипски» все и произошло… В 1946 г. А. Кельнер из знаменитой лаборатории молекулярной биологии в Колд-Спринг-Харборе занимался важным делом – искал новые антибиотики. Дело было сразу после войны, и успех пенициллина был у всех на слуху. Работая с бактериями стрептомицетами, Кельнер решил проверить, можно ли каким-то стрессовым воздействием заставить их вырабатывать больше нужного продукта. В качестве стрессового фактора он использовал облучение ультрафиолетом. Но вот беда – ему никак не удавалось подобрать нужную дозу облучения, при которой бактерии выживали. Данные по выживаемости стрептомицетов, оцененной по росту их колоний, «скакали» в зависимости от условий, в которых они находились после облучения.
К счастью, будучи очень аккуратным, Кельнер скрупулезно записывал мельчайшие детали своих экспериментов. Оказалось, что сразу после облучения выживаемость стрептомицетов была низкой. Ситуация не особенно улучшалась, если их затем держали какое-то время в темноте. А вот на свету выживаемость постепенно увеличивалась, и чем больше света – тем быстрее!
Перепроверка всех результатов заняла у Кельнера три года. А тем временем инактивацию ультрафиолетом бактериофагов (вирусов бактерий) изучал Р. Дульбекко, будущий нобелевский лауреат (в то время он был молодым научным сотрудником в группе С. Лурии, тоже будущего нобелевского лауреата). Ученый пришел точно к таким же выводам, как и Кельнер.
Удивительное совпадение: когда Кельнер написал статью о своих результатах, он послал ее именно Лурии для прочтения и критики. К чести Дульбекко и Лурии, они не стали зажимать работу конкурента, а, напротив, поделились с ним своими достижениями. Статьи обоих ученых вышли в одно и то же время. В общем-то, уже тогда было известно, что ультрафиолет повреждает генетический материал клетки. Результаты исследований свидетельствовали, что видимый свет помогает ему восстанавливаться. Этот процесс назвали фотореактивацией.
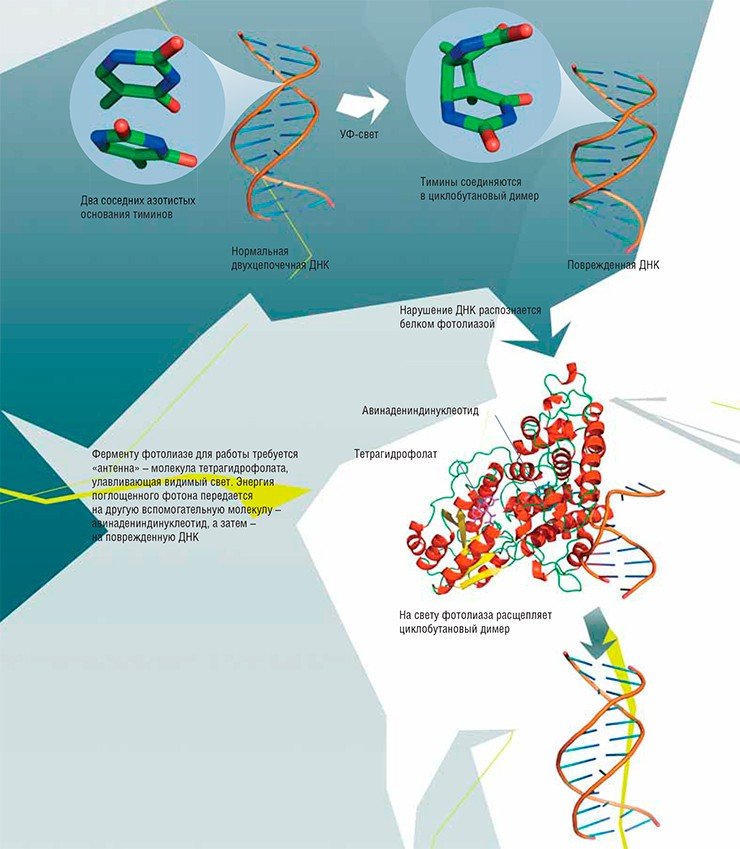
Вот так, совершенно случайно и «попутно» было сделано открытие процесса репарации ДНК, не менее важного, чем широко известные другие молекулярно-генетические процессы репликации, транскрипции и трансляции генетического материала. История принцев Серендипа в очередной раз повторилась...
Зачем это нужно?
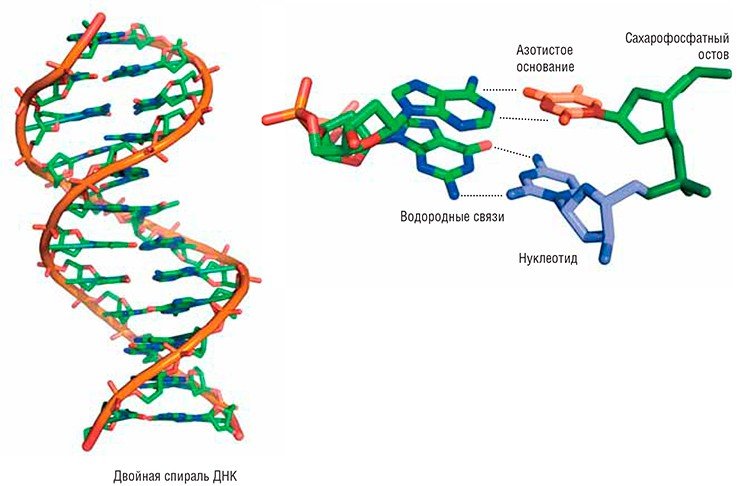
Как известно, ДНК состоит из азотистых оснований четырех разных типов и сахарофосфатного остова, образующего непрерывную цепочку, на которую эти основания навешены. Повреждаться могут как основания, так и остов. Всего насчитывают около сотни возможных различных повреждений, механизмы возникновения которых также различаются.
Например, при дезаминировании (отщеплении аминогруппы NH2) из обычного для ДНК основания цитозина возникает урацил, в норме встречающийся только в РНК. Основания ДНК могут подвергаться окислению. К некоторым позициям в основаниях охотно присоединяются другие углеродсодержащие группы – происходит алкилирование. Под влиянием ультрафиолетового света соседние тимины могут сшиваться друг с другом, образуя димеры. Очень часто основания отрываются от остова ДНК: так возникают АП-сайты. А ионизирующая радиация приводит к появлению в цепи ДНК одно- или двухцепочечных разрывов.
Повреждения ДНК, особенно если их много, могут вызывать не только мутации, но и гибель клетки. Тут необходимо отметить, что повреждение ДНК и мутация – не одно и то же. Чтобы повреждение превратилось в мутацию, нужно, чтобы произошла репликация – синтез новой цепочки ДНК на матрице «старой». Обычно при репликации соблюдается принцип комплементарности. Однако если в матрице есть поврежденное звено, то напротив него в дочернюю цепь включится совсем не то, что нужно.
Например, напротив АП-сайта может включиться в принципе все, что угодно – ведь на матрице нет основания-подсказки. Вот так и возникнет мутация, т. е. отклонение последовательности ДНК от исходной. Мутации в половых клетках передаются следующему поколению, а в остальных клетках организма могут приводить к раку. Как полагают сейчас многие ученые, и самая неизлечимая «болезнь» – старение – тоже тесно связана с накоплением мутаций в клетках нашего тела.
Кстати сказать, еще одним источником появления ошибок в ДНК служит неправильное включение нуклеотидов при самой репликации. Ферменты ДНК-полимеразы делают такие ошибки с частотой примерно 0,001—0,00001. Частично полимеразы могут сами исправлять свои ошибки, сразу вырезая неправильно включенное звено, что повышает их надежность еще в 100—1000 раз. Однако даже такая точность соответствует десяткам или даже сотням ошибок, которые возникают в каждой нашей клетке при ее делении.
Все ошибки, возникшие в нуклеотидной последовательности ДНК, необходимо исправлять. Поэтому в процессе эволюции возникли несколько систем, известных под общим названием «системы репарации ДНК», защищающие нас от мутаций, вызванных повреждениями наследственного материала. Дать их даже очень схематичное описание в небольшой статье – задача практически невыполнимая. А полное их описание в главном талмуде ученых-репарационщиков – книге Э. Фридберга «Мутагенез и репарация ДНК» (2006 г.) – занимает полторы тысячи страниц убористого текста. Тем не менее получить общее представление о работе этих систем вполне возможно.
Врачу, исцелися сам!
При штатной работе систем репарации наш геном вполне стабилен. Однако, как и в любой достаточно сложной схеме, у них есть свои слабые точки, неполадки в которых приводят к сбою всего механизма.
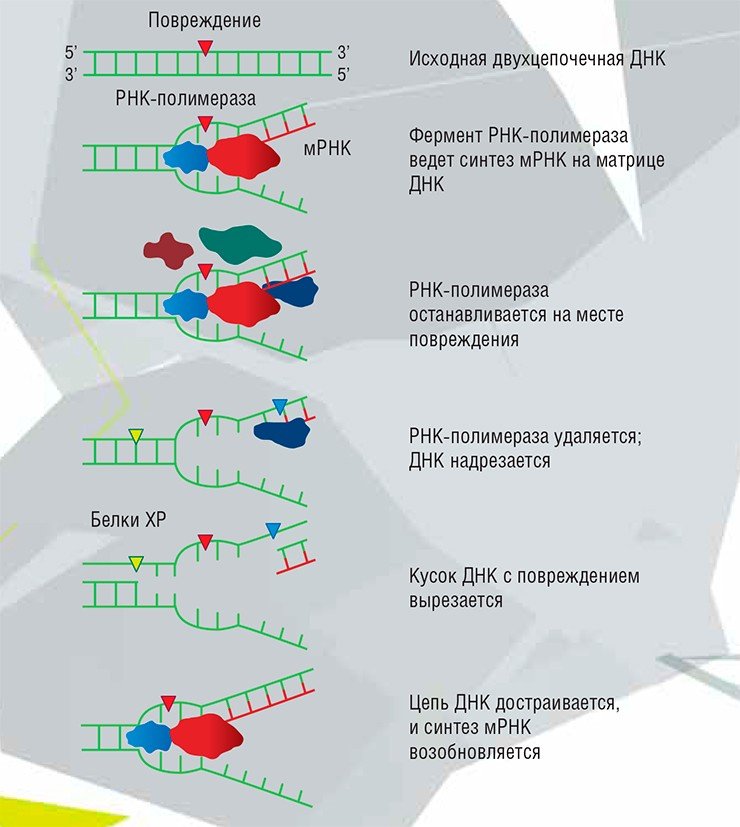
Гены, кодирующие белки репарации, ничем не отличаются от других генов – в них тоже могут происходить мутации. Если такая мутация не позволяет белку нормально функционировать, соответствующий путь репарации отключается. Тогда в организме проявляется так называемый мутаторный фенотип, в котором новые мутации появляются гораздо легче, со всеми вытекающими отсюда неприятными последствиями. Дефекты определенных генов репарации проявляются как наследственные болезни, для которых обычно повышен риск возникновения рака, но вообще их проявления могут быть достаточно разнообразны.
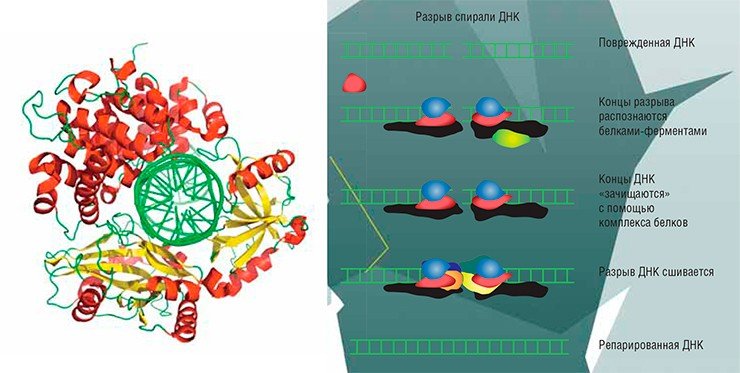
РЕМОНТНАЯ МАСТЕРСКАЯ ДНК: УЧИМ МАТЧАСТЬВ глобальной геномной репарации основную роль играют белки, названия которых начинаются с букв XP (по латинскому названию болезни пигментной ксеродермы, которая вызывается нарушениями в их работе). Повреждение распознается, двойная спираль ДНК разделяется на отдельные цепи. Потом из такого «глазка» в ДНК вырезается кусок размером 27—29 нуклеотидов, а на его месте достраивается «правильный» недостающий участок.
Транскрипционнозависимая репарация чуть-чуть попроще, происходит во время синтеза мРНК, в дальнейшем служащей матрицей для синтеза белка. Повреждение при этом находится РНК-полимеразой, которая попросту застревает на аварийном участке в ходе синтеза РНК
Эту работу выполняет комплекс белков, который ищет ближайший разрыв в цепочках ДНК – с большой вероятностью это будет как раз то место, где находится ДНК-полимераза, виноватая в ошибке. Значит, именно эта цепь и была неправильно синтезирована. Вся дочерняя цепь ДНК до гетеродуплекса включительно разрушается, и синтез идет заново
Однако при этом теряется часть ДНК, где находился разрыв. Поэтому такой процесс характерен в основном для клеток высших организмов, у которых основную часть генома составляет нефункциональная ДНК, и риск потери смысловой ДНК невелик. Такая репарация необходима также при переформировании генов, кодирующих иммуноглобулины, целью которого является создание новых последовательностей ДНК
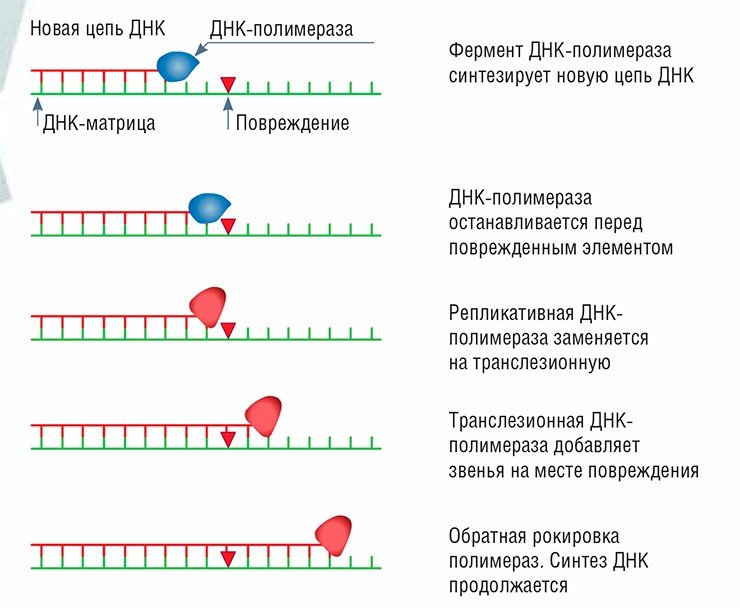
Специальная полимераза вставляет один-два случайных нуклеотида на месте повреждения, а потом за работу вновь принимается обычная. При этом повреждение не удаляется, и на его месте в будущем может возникнуть мутация. Но клетка, тем не менее, выживает
Пожалуй, самая известная и хорошо изученная из таких болезней – пигментная ксеродерма. Она даже оставила следы в художественной литературе: любители триллеров Д. Кунца могут вспомнить, что именно ей страдает детектив-любитель Кристофер Сноу, главный герой цикла «Лунная бухта». На самом деле это даже не одно заболевание, а целых восемь, но с довольно схожими проявлениями. Большая часть случаев связана с неисправностями системы эксцизионной репарации нуклеотидов (недостатком любого из семи белков XPA–XPG, в ней участвующих) либо белка XPV, который представляет собой ДНК-полимеразу, участвующую в транслезионном синтезе.
Фотографиями людей, больных пигментной ксеродермой, специалисты по репарации любят пугать аудиторию на лекциях или научных конференциях. Главный признак болезни – тяжелые ожоги, остающиеся на коже после самого непродолжительного пребывания на солнце. После ожогов быстро появляются пигментные пятна, кожа сохнет и растрескивается, а кончается все раком кожи, который развивается примерно к 7—8 годам. Поражаются и глаза, которые очень болезненно реагируют на солнечный свет. Менее половины больных пигментной ксеродермой доживают до 20 лет. Хорошо, что болезнь эта встречается довольно редко: среди европейцев – примерно у 4 человек из миллиона. А вот у японцев частота встречаемости пигментной ксеродермы в шесть раз выше.
Внимание ученых эта болезнь привлекает в том числе и своей многоликостью. Нечасто бывает, что повреждение одного и того же гена вызывает разные заболевания, но в данном случае дела обстоят именно так. Причина в том, что один и тот же белок может входить в состав разных белковых комплексов, выполняющих в клетке разные функции. И одна мутация может нарушать только способность белка работать в одних комплексах, в других же он будет вполне работоспособен.
Например, некоторые мутации в гене, кодирующем репарационный белок XPD, вызывают типичную ксеродерму, а другие мутации в том же гене – совершенно другую болезнь, синдром Кокейн, при которой в первые два года жизни начинаются проблемы с ростом и развитием. В результате у таких детей развивается карликовость и истощение, а лицо приобретает характерную «птичью» форму – ввалившиеся глаза и выдающийся нос. Разрушаются оболочки нервных волокон, многие нейроны отмирают, в сосудах головного мозга откладываются соли кальция – создается впечатление, что нервная система при этом синдроме стареет намного быстрее остального организма. Средняя продолжительность жизни таких больных еще меньше – около 12 лет.
А еще мутация в том же самом гене может вызывать и третью болезнь – трихотиодистрофию, при которой репарация ДНК происходит практически нормально, но при этом в организме нарушается синтез некоторых белков-кератинов. Результат – ломкие волосы, чешуйчатая кожа и почти полное отсутствие жировой ткани на лице.
Всего насчитывают несколько десятков наследственных заболеваний, связанных с неисправностями систем репарации. По большей части такие болезни, как и следовало ожидать для мутаторного фенотипа, отличаются повышенным риском развития рака и зачастую – ускоренным старением.
В частности, синдром Вернера, при котором не работает одна из ферментов-геликаз репарации, практически точно воспроизводит картину нормального старения. Вот только обычный срок человеческой жизни при этом сжат до 30—50 лет… А еще дефекты репарации часто проявляются в нейродегенеративных заболеваниях. Все знают, что «нервные клетки не восстанавливаются», и хотя это на самом деле не совсем так, но все же типичный нейрон действительно должен служить человеку всю жизнь. А за это время в его ДНК возникает множество повреждений.
Крем с ферментами
Разумеется, такие мощные и специфичные защитные средства, как ферменты репарации, не могли пройти мимо внимания медиков. Хорошо было бы научиться использовать их для предохранения нашего генома от повреждений! Теоретически это возможно, но есть огромная проблема: пока что никто не придумал способа, с помощью которого молекулы белка, используемые в качестве лекарства, могли бы проникать во все клетки тела. Более того, белки вообще плохо проникают в клетки – для этого приходится использовать всяческие ухищрения. Например, их можно запаковать в специальные мембранные пузырьки – липосомы, которые будут сливаться с клеточными мембранами и высвобождать свое содержимое внутрь клетки.
Однако этим способом пока можно доставить терапевтические ферменты не во все ткани, а лишь в такие легкодоступные места, как кожа. Тут ферменты репарации действительно уже нашли применение в медицине – ведь кожа, частенько находящаяся под действием солнечного света, принадлежит к числу органов, больше всего страдающих от генотоксического стресса.
Американская компания AGI Dermatics выпускает кремы с липосомами, содержащими фотолиазу и эндонуклеазу V – два фермента, участвующие в репарации циклобутановых димеров, образующихся в ДНК под действием ультрафиолета. Небольшая баночка крема стоит около сотни долларов, и, по уверениям фирмы, ее продукт работает гораздо лучше обычных защитных кремов. Возможно, это действительно так: в отличие от большинства косметических продуктов, которые никогда не проходили жесткого тестирования, обязательного для лекарств, липосомы AGI Dermatics сейчас находятся на последней стадии клинических испытаний по профилактике рака кожи, в том числе и у больных пигментной ксеродермой.
По-видимому, использование ферментов репарации для предохранения барьерных тканей (кожи и слизистых оболочек) от генотоксического стресса имеет большое будущее. Уже сейчас ДНК-гликозилазы, исправляющие окислительные повреждения ДНК, испытываются (пока на животных) в качестве средств для предупреждения рака легких – органа, подвергающегося самой массированной атаке кислородными радикалами.
Репарацию у врага – подавить!
Итак, если у нас работают системы репарации – это хорошо. Плохо, когда они работают у наших врагов – болезнетворнх бактерий, вирусов и опухолевых клеток. Можно ли каким-то образом на них воздействовать, подавив в них репарацию? Такие примеры уже имеются.
Проще всего, как ни странно, оказалось использовать системы репарации в качестве мишени для лекарств при онкологических заболеваниях. Как известно, очень многие химиопрепараты действуют, повреждая ДНК раковой клетки. При этом эти повреждения, разумеется, подвергаются репарации, что снижает эффективность действия лекарств. Поэтому ингибирование репарации рассматривается сейчас как перспективный метод усиления действенности химиотерапии. Например, на последней стадии клинических испытаний находится бензилгуанин – ингибитор фермента-самоубийцы MGMT, который «ремонтирует» алкилированные основания ДНК и тем самым мешает работе таких широко применяемых противоопухолевых агентов, как кармустин и темозоломид.
Ингибиторы репарации для борьбы с бактериями и вирусами существуют пока только в проекте. Однако известно, что некоторые вирусы, например поксвирусы (в том числе вирус натуральной оспы), герпесвирусы (вирусы простого герпеса и ветряной оспы) и лентивирусы (ВИЧ), нуждаются для своего размножения в репарационном ферменте урацил-ДНК-гликозилазе, либо собственной, либо заимствованной у хозяина. Ингибиторы этого фермента также уже испытываются как противовирусные лекарства.
Что касается болезнетворных бактерий, то наши иммунные клетки-макрофаги при встрече с ними пытаются убить интервентов «окислительным взрывом», выбрасывая огромное количество кислородных и азотных радикалов, повреждающих бактериальную ДНК. Только мощная система репарации помогает бактериям выжить в таком столкновении; если ее удастся подавить, собственным защитникам человеческого организма будет легче справиться с инфекцией.
ДНК, как здоровье?
То, что повреждение ДНК может доставить массу неприятностей – понятно. А есть ли способ как-то оценить «здоровье» ДНК, померить, сколько в ней «ошибок»? Это очень важно, например, для оценки потенциальной степени мутагенности окружающей среды, влияния нового лекарства на человеческий организм, да мало ли еще для чего…

Один такой способ изобрел в 1988 г. Нарендра Сингх из американского Национального института старения. Речь идет о кометографии, или методе кометного хвоста. В самом простом варианте при этом измеряется число двухцепочечных разрывов в ДНК. Отдельные клетки (например, лейкоциты крови) заплавляют в агарозную плашку, разрушают их оболочку особыми реагентами и помещают в электрическое поле – ведут знакомый всем биохимикам электрофорез. Молекула ДНК, заряженная отрицательно, движется к аноду. Но так как она очень длинная, то с места почти не сдвигается. Но если в ДНК есть разрывы, то более короткие фрагменты быстро «убегают», за ними тянутся более длинные и т. д. Так что если окрасить ДНК специальными красителями, то будет видна характерная фигура – «кометный хвост». Чем хвост длиннее, тем больше в ДНК коротких фрагментов, тем больше разрывов и тем сильнее она повреждена.
С момента изобретения кометографии придумали множество ее разновидностей для обнаружения разных видов повреждений. Например, если вести электрофорез в щелочных условиях, то двойная спираль ДНК разделяется на отдельные цепочки. В результате можно увидеть не только двухцепочечные, но и одноцепочечные разрывы и даже АП-сайты. А если всю плашку предварительно хорошенько замочить в растворе, содержащем какую-нибудь ДНК-гликозилазу, то можно будет установить, сколько в ДНК было поврежденных оснований, которые этот фермент вырезает.
Помимо совершенствования методов кометографии постоянно ищутся и новые объекты. Например, несколько лет назад немецкие исследователи предложили для оценки состояния природных водоемов проводить кометографию на пресноводных губках, которые легко «разобрать» на отдельные клетки. Немцы даже приезжали на Байкал, собрали там губки и удостоверились, что байкальская вода генам на пользу.
Легко и быстро оценивать генотоксичность внешней среды помогает система, основанная на SOS-ответе бактерий. Известно, что некоторые бактериальные гены, в том числе гены репарации, включаются только при повреждении ДНК. В начале всех таких генов есть специальный регуляторный элемент – SOS-бокс. Если под него вместо штатного гена подставить какой-нибудь репортерный элемент (например, ген, кодирующий излюбленный биохимиками зеленый флуоресцентный белок), то в условиях, повреждающих ДНК, бактерия будет давать соответствующий цветной сигнал. Таким образом, светящиеся бактерии будут свидетельствовать об опасности для человеческих генов.

Сегодня насчитывается несколько десятков конструкций подобных биосенсоров – некоторые посылали даже в космос для исследования повреждающего действия космических лучей.
Практически закончив писать эту статью, автор зашел в базу данных PubMed, где собраны аннотации почти всех статей по биомедицинской тематике, когда-либо выходивших в мире.
Беглый поиск выдал 33 646 публикаций по тематике «репарация ДНК». Почти все новые «горячие» направления в биологии так или иначе пересекаются с репарацией – есть работы и по репарации в стволовых клетках, и по генотоксичности наночастиц… Как видно, интерес к этой теме огромен, и он будет только расти, ведь безопасность личного генома волнует нас всех.
И, будем надеяться, чудесная особенность принцев Серендипа, с которой началась история открытия репарации ДНК, еще не раз послужит ученым, работающим в этой области.
Литература
Жарков Д. О. Загадки «ржавой» ДНК // Наука из первых рук. – 2006. –№ 6. – С. 24—35.
Ходырева С. Н., Лаврик О. И. Как клетка ремонтирует ДНК // Наука из первых рук. – 2007. –№ 3. – С. 82—89.
Автор и редакция благодарят К. Баумштарк-Хан (Институт аэрокосмической биологии, Германия) за помощь в подготовке иллюстраций