Как вирусы помогут вылечить рак
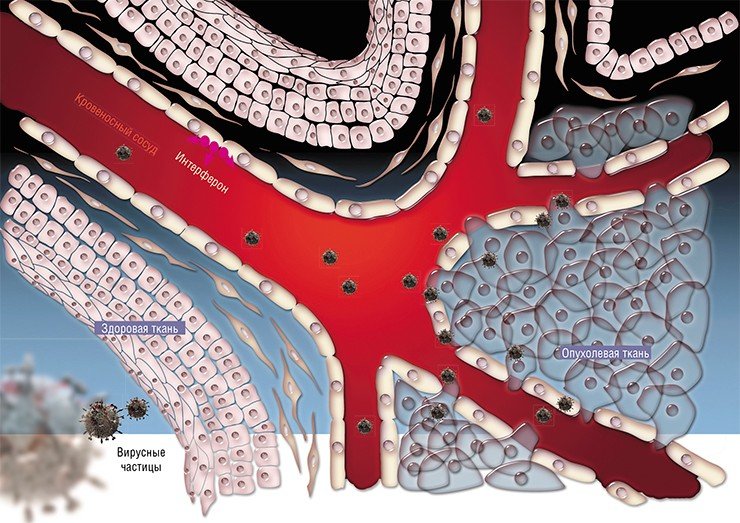
В развитых странах онкологические заболевания являются второй причиной смертности после сердечно-сосудистых, но, судя по всему, скоро они станут лидерами. Это связано с тем, что причины сердечно-сосудистых патологий в основном выявлены, и со многими из них научились эффективно бороться. С онкозаболеваниями все гораздо сложнее: молекулярно-генетических и экологических причин их возникновения немало, профилактика возможна не всегда, а для целого ряда опухолей методов лечения либо не существует, либо они малоэффективны. Идея использовать против опухолей вирусы кажется на первый взгляд странной, ведь слово «вирус» само по себе ассоциируется с болезнью. Но при ближайшем рассмотрении эта идея оказывается многообещающей, если заставить болеть только раковые клетки
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
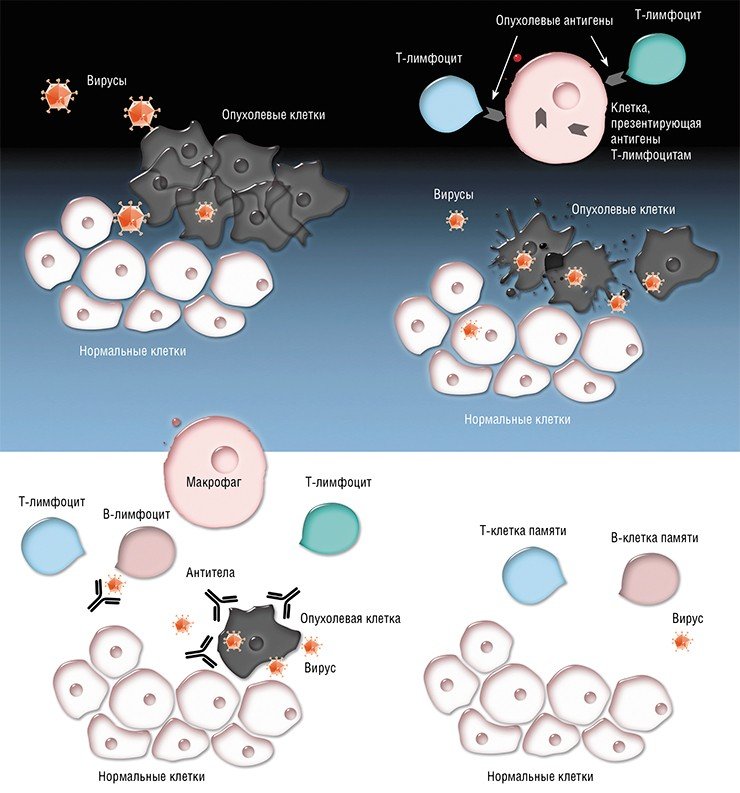
В 1990-е гг. начала развиваться более осознанная концепция создания онколитических вирусов. Произошло это после того, как удалось частично выяснить механизм противораковой активности полученного в США штамма аденовируса ONYX‑015. Дело в том, что один из главных «стражей порядка» клетки – белок р53, обнаружив в ней вирус, запускает апоптоз (программируемую смерть), чтобы вирус не смог размножиться и заразить окружающие клетки. В клетках многих опухолей ген белка р53 поврежден, и размножение вируса ничего не сдерживает. У аденовируса, в свою очередь, имеется белок Е1В‑55К, который связывает р53 и не дает ему запускать апоптоз. Если ген, кодирующий этот белок, из вирусного генома удалить, то вирус сможет размножаться только в клетках опухоли, где к тому же р53 в большинстве случаев не работает.
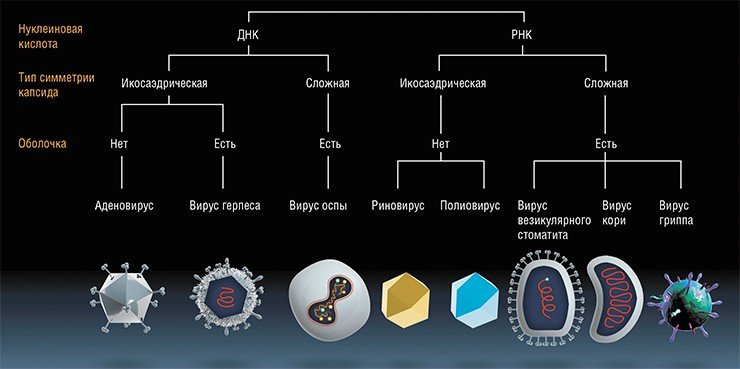
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
 Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
ВИРУСЫ: «ЗДОРОВАЯ» КОНКУРЕНЦИЯ «До недавнего времени было общепринято мнение, что все вирусы являются возбудителями тех или иных болезней и должны рассматриваться в качестве вредных для общества патогенных агентов, требующих только мер борьбы с ними… В начале 50-х годов появились сомнения в правильности такого суждения. В процессе экспериментов по изоляции вирусов из фекалий у здоровых детей, а также при изучении их свойств в опытах на обезьянах, других животных и в культурах тканей начали накапливаться данные, свидетельствующие о том, что некоторые условно патогенные и полностью непатогенные кишечные вирусы (энтеровирусы) могут обладать определенными полезными для организма свойствами <…>
В наших наблюдениях у большинства вакцинированных* детей были получены хорошие результаты, но у некоторых из них вакцинный вирус не «приживлялся» в кишечнике и антитела в крови детей не появлялись. Вирусологические исследования, проведенные как в нашей, так и во многих других лабораториях, показали, что на успех пероральной иммунизации против полиомиелита живой вакциной Сэбина неблагоприятно влияет конкуренция со стороны неполиомиелитных типов энтеровирусов, обитающих в кишечнике у многих детей с момента рождения и не влияющих на состояние их здоровья. Этот факт дал нам возможность подтвердить наличие симбиоза с организмом человека некоторых рас непатогенных сапрофитных энтеровирусов, способных в среде обитания конкурировать с живой вакциной Сэбина, а также с болезнетворными вирусами при соответствующих условиях <…>
Нами был предложен новый принцип борьбы с энтеровирусными болезнями путем вытеснения болезнетворных вирусов конкурирующими в среде обитания непатогенными энтеровирусами-симбионтами, и на их основе М. К. Ворошиловой были разработаны так называемые живые энтеровирусные вакцины (ЖЭВ) <…>
В результате наших наблюдений и ряда исследований впервые было доказано существование нового для науки феномена – эффективного подавления болезнетворных вирусов непатогенными расами энтеровирусов-симбионтов кишечника благодаря конкуренции за среду обитания и интерферирующему воздействию с одновременной стимуляцией нескольких защитных систем организма. Селекционированные полезные вирусы-симбионты оказались способными вызывать онколиз (разрушение некоторых видов опухолевых клеток) и, кроме того, защищать в некоторых случаях лейкоцитарную систему в организме от губительного действия радиоактивного излучения. Это открытие имеет как общебиологическое теоретическое, так и медицинское практическое значение, обеспечивая новые возможности для профилактики и лечения ряда заболеваний»
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
В 1998—2003 гг. в Государственном научном центре вирусологии и биотехнологии «Вектор» (Новосибирск) был получен вариант аденовируса 5 серотипа с полностью удаленным геном Е1В. Препарат на его основе был назван канцеролизином (Kachko et al., 2003). Было показано, что он обладает онколитическими свойствами, сходными с ONYX‑015 и онкорином. После проведения полного цикла доклинических испытаний этот штамм был допущен к клиническим испытаниям I фазы (Vdovichenko et al., 2006), которые прошли в 2007 г. в Российском онкологическом научном центре им. Н. Н. Блохина на восьми пациентах-добровольцах. Испытания показали хорошую переносимость препарата, а в одном случае наблюдался лечебный эффект, несмотря на то, что у всех больных была IV неизлечимая стадия болезни. Но найти источник финансирования последующих испытаний не удалось, а спустя несколько лет это стало неактуальным из-за появления вирусных онколитиков нового поколения.
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
Также в 2015 г. получил разрешение на проведение III фазы клинических испытаний препарат на основе рекомбинантного штамма вируса осповакцины Пекса-Век (Pexa-Vec, JX‑594) для лечения гепатоцеллюлярной карциномы (рака печени). Этот препарат был получен из штамма вируса осповакцины Wyeth, у которого для уменьшения побочных реакций удалили ген тимидинкиназы и добавили ген гранулоцит-макрофаг-колониестимулирующего фактора человека. Препарат сейчас интенсивно исследуют на добровольцах (информация об этом – на сайте http://www.pexavectrials.com). Результаты нескольких независимых клинических испытаний I и II фазы положительны, а испытания III фазы проводятся в клиниках нескольких десятков стран мира.
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
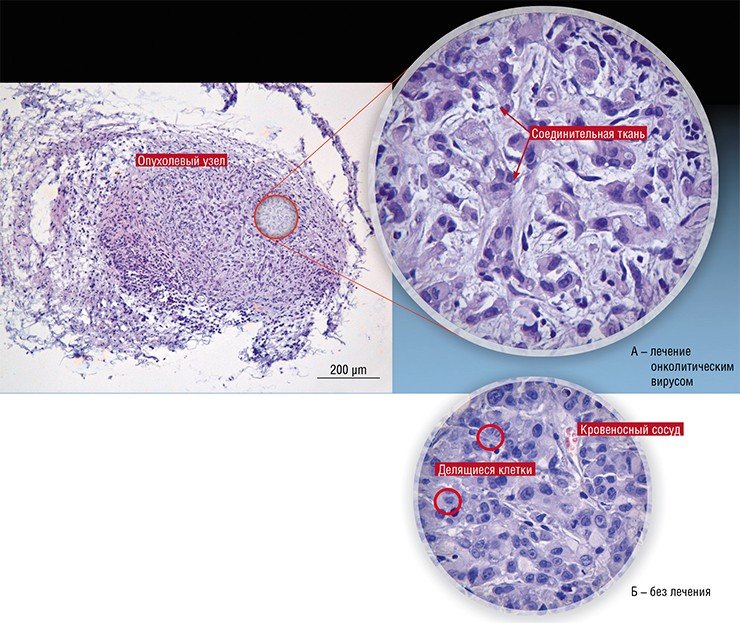
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
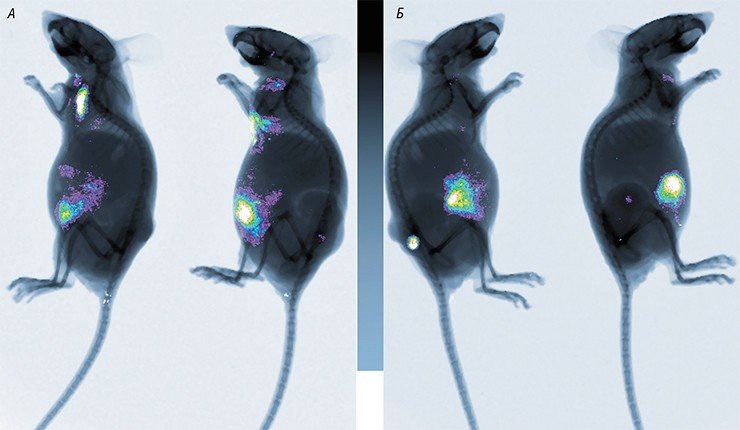
К сожалению, существенного финансирования в последующие годы добиться не удалось. Тем не менее усилиями неформального коллектива сотрудников НГУ, ГНЦ ВБ «Вектор» и Института химической биологии и фундаментальной медицины СО РАН уже вне рамок мегагранта получены рекомбинантные штаммы вируса осповакцины с противораковыми свойствами, показавшие перспективность на животных моделях (Kochneva et al., 2014; Kochneva et al., 2017). Охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай (Matveeva et al., 2015), сконструированы плазмиды с геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками генов, усиливающих лизис опухоли.
Сегодня у отечественных исследователей есть все основания работать дальше, проводить полноразмерные доклинические исследования и клинические испытания онколитических вирусных штаммов. Очень важно, преодолев предубеждения, дать «зеленый свет» и финансирование исследованиям этих крайне перспективных препаратов, разработанных в России.
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Литература
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.
Kochneva G.V., Tkacheva A.V., Sivolobova G.F. et al. Antitumor potential of recombinant vaccinia virus strain, which produces a secreted chimera protein, composed of human GM-CSF and oncotoxic peptide lactaptin // Russian Journal of Biopharmaceuticals. 2017. V. 9. N. 1. P. 11—21.
Tarasova M. V., Demidova E. V., Kochneva G.V. et al. The construction of adenovirus type 6 vector with replication control under the human telomerase reverse transcriptase promoter. Collaborative Congress of the European-Society-of-Gene-and-Cell-Therapy (ESGCT) and Finnish-Society-of-Gene-Therapy. Helsinki, Finland. SEP 17-20, 2015. HUMAN GENE THERAPY. V. 26. № 10. P. A101-A102.
Voroshilova M.K. Potential use of nonpathogenic enteroviruses for control of human disease // Prog. Med. Virol. 1989. V. 36. P. 191—202.
Vdovichenko G.V., Petrishchenko V.A., Sergeev A.A. et al. Preclinical studies of the anticancer adenovirus cancerolysin preparation // Vopr. Virusol. 2006. V. 51. N. 6. P. 39—42.