Жить с коронавирусом
30 января 2020 г. Всемирная организация здравоохранения объявила вспышку в Китае новой коронавирусной инфекции чрезвычайной ситуацией международного уровня. С тех пор прошло немало времени, но, по словам директора Европейского регионального бюро ВОЗ Х. Клюге, мы победим пандемию лишь тогда, когда научимся жить с вирусом. На каждом этапе изучения нового инфекционного агента ученые и медики подводят итоги, пусть и предварительные. Сегодня свое видение ситуации с коронавирусом SARS-CoV-2 представляет известный вирусолог, специалист в области изучения структуры и функций геномов вирусов и наш постоянный автор, профессор С. В. Нетесов
Судя по официальной статистике, число жертв коронавируса SARS-CoV‑2 уже за первые шесть месяцев пандемии оказалось не меньше, чем за полтора года эпидемии печально известного свиного гриппа в 2009—2011 гг., когда из 0,7—1,4 млрд заболевших погибло, по разным оценкам, от 150 тыс. до полумиллиона человек. Что касается COVID‑19, то в сентябре официальное число заболевших превысило 33 млн человек, а число смертей – 1 млн.
SARS-CoV‑2 оказался для человечества крепким орешком. С одной стороны, пандемия COVID‑19 с самого начала сопровождалась беспрецедентно быстрым накоплением фактических данных и ростом числа научных публикаций по этой проблеме (уже к началу июня 2020 г. их число превысило 200 тыс.), а ВОЗ зарегистрировала более полутора сотен кандидатных вакцин. С другой стороны, до сих пор не появилось ни одного действительно эффективного лекарства против возбудителя болезни, а механизмы взаимодействия SARS-CoV‑2 c организмом и возникновения широкого спектра патологических проявлений все еще продолжают изучаться.
Тем не менее за прошедшие месяцы специалисты не только узнали много полезной информации о новой коронавирусной инфекции, но по-иному взглянули на привычные нам ОРВИ – острые респираторные вирусные инфекции, например на известный феномен бессимптомности, на который раньше не обращали особого внимания. Сейчас же становится ясно, что такая особенность присуща не только нынешнему коронавирусу.
Так что нам уже пора извлекать уроки из нашей борьбы с пандемией и думать, как жить дальше. В любом случае первостепенная задача человечества – сделать все возможное, чтобы минимизировать влияние этой болезни на повседневную жизнь и экономику.
От летучих мышей – к человеку
Коронавирусы были открыты еще в середине 1960-х гг. Их название (от лат. corona – солнечная корона) обусловлено формой вирионов, которых впервые увидела в электронном микроскопе британский вирусолог-микроскопист Джун Алмейда. «Корона» образована поверхностными белками-шипами, которые обеспечивают проникновение вируса в клетку, связываясь с трансмембранными рецепторами – молекулами ангиотензинпревращающего фермента 2 (АПФ2, или ACE2).
С тех же 1960-х гг. мы стали постепенно знакомиться с обычными коронавирусами, давно поражающими человека. Два из них – это альфакоронавирусы NL63 и 229E; еще два – бетакоронавирусы HKU 1 и OC 43. К последним относятся и вирус атипичной пневмонии SARS-CoV‑1, и нынешний SARS-CoV‑2.
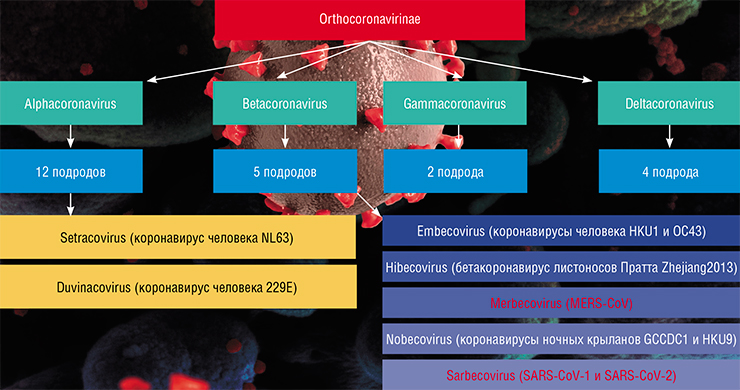
До начала нынешнего века коронавирусы служили причиной обычных сезонных ОРВИ, но в 2000-х гг. ситуация начала меняться. Возбудитель атипичной пневмонии SARS-CoV‑1 был впервые «опознан» в ноябре 2002 г. в китайской провинции Гуандун. Произошел он от коронавируса летучих мышей, а его промежуточным хозяином, по-видимому, была гималайская циветта (виверра). Эти животные, поедая кофейные плоды, «перерабатывают» их в копи-лювак – один из самых дорогих сортов кофе в мире; кроме того, у них вкусное мясо, красивый мех, а некоторые внутренние органы и части тела применяются в китайской народной медицине. Поэтому в свое время циветт начали усиленно разводить в Китае и других странах Юго-Восточной Азии. Случайная адаптация вируса, пришедшего к ним от летучих мышей, а затем к человеку, привела в 2003 г. к более чем 8 тыс. случаев заражения и почти 800 смертельным исходам в 37 странах мира.
MERS-CoV был впервые идентифицирован в Саудовской Аравии в 2012 г. Он произошел от коронавируса египетских розеттовых летучих мышей и начал поражать людей, пройдя через промежуточного хозяина – одногорбого верблюда. За восемь лет (с сентября 2012 г. до января 2020 г.) этот патоген вызвал более 2,5 тыс. лабораторно подтвержденных случаев инфекции, из которых около 800 (более 35 %!) оказались летальными. Заболевали преимущественно люди, контактировавшие с верблюдами, однако известны и случаи заражения от человека к человеку. Широкую огласку получила вспышка этого заболевания в Южной Корее, где от одного больного последовательно заразилось более 150 человек
За последнее десятилетие китайские и американские ученые детально изучили геномы десятков вирусов подковоносых летучих мышей, включая коронавирусы, поэтому им удалось довольно быстро определить новый возбудитель. Уже к 10 января 2020 г. специалисты Китайского центра по контролю и профилактике заболеваний (Пекин) расшифровали геномы 9 изолятов SARS-CoV‑2, полученные от пациентов. Выяснилось, что новый вирус генетически отличается как от вируса атипичной пневмонии SARS-CoV‑1 (около 79 % сходства), так и от MERS-CoV (около 50 % сходства). Различия весьма серьезные.
Однако SARS-CoV‑2 – это вовсе не чертик из табакерки. Все его охарактеризованные изоляты оказались генетически близки (со сходством более 88 %) двум известным ранее коронавирусам летучих мышей, обнаруженным в 2018 г. в Восточном Китае. А места связывания этого вируса с человеческими клетками оказались схожи с таковыми у вируса атипичной пневмонии. Чуть позже у летучих мышей был выявлен штамм RatG13, еще более близкий к новому патогену, со сходством более 96 %.
Восемь первых полных геномов SARS-CoV‑2 оказались идентичны друг другу более чем на 99,98 %, что указывало на его недавнее появление в человеческой популяции. При этом до сих пор так и не установлено, были ли «инкубатором» для него непосредственно летучие мыши. По поводу происхождения этого вируса выдвинута масса гипотез, наиболее реальной признается та, согласно которой вирус стал патогенным для людей, «пройдя» через организм промежуточного хозяина, вероятнее всего, панголина – дальнего «родственника» броненосцев.
Что касается споров относительно искусственного происхождения SARS-CoV‑2, то в пользу этой теории «диванные» вирусологи указывают на гибрид, описанный в статье в журнале Nature в 2015 г., где говорится об эксперименте, имитирующем естественную эволюцию коронавирусов. Главный объект этого исследования – один из коронавирусов летучих мышей, в геном которого был вставлен немного модифицированный ген, кодирующий белок-шип вируса SARS-CoV‑1. Основная модификация состояла в том, что ученые встроили в его геном участок, ответственный за связывание с человеческим рецептором АПФ2.
Этот рекомбинантный вирус был сконструирован в Университете Северной Каролины (США), а протестирован в Уханьском институте вирусологии (КНР). Особенности такой химеры проверили на культуре клеток, и оказалось, что она потенциально опасна для человека. Кстати сказать, подобные опыты с английским названием Gain-of-Function за последние десять лет дважды запрещались и дважды разрешались мировым научным сообществом.
Однако этот гибридный вирус значительно отличается от пандемического SARS-CoV‑2 – генетическое сходство не более 87 %. Согласно еще одному «конспирологическому» варианту развития событий, из центра в Ухане могли случайно выпустить другой вирус летучих мышей – RatG13, сходство с которым у SARS-CoV‑2 намного выше.
Конспирология – увлекательное и очень заразительное занятие, но она не поможет в борьбе с патогеном, в отличие от грамотного научного расследования происхождения и распространения нового инфекционного агента.

К примеру, при проверке на чувствительность к SARS-CoV‑2 различных животных, живущих в контакте с человеком, выяснилось, что он очень плохо размножается в организмах собак, свиней, цыплят и уток, но хорошо – у хорьков и кошек и может передаваться между животными респираторным путем, а от зараженных животных –людям. Так случилось на норковых фермах в Дании и некоторых других странах, причем норки могли заразиться вирусом только от человека. Поэтому необходимо и дальше изучать диких и домашних животных как возможные резервуары коронавирусных инфекций.
Как остановить эпидемию
Важнейшей характеристикой любого патогена является его трансмиссивность (заразность), описываемая основным репродуктивным числом (Ro), равным среднему числу людей, которых может заразить один больной человек. У обычного вируса гриппа Ro – чуть больше единицы, у сильно эпидемичных его штаммов – до 1,4, а у нового коронавируса – предположительно, от трех до пяти. Этот показатель постепенно уточняется, а разброс связан с тем, что в разных странах его определяют немного по-разному.
Одной из самых успешных стран по выходу из эпидемической ситуации оказалась ФРГ. В мае 2020 г. немецкие исследователи оценили кривую снижения Ro в зависимости от проведения различных противоэпидемических мероприятий. Оказалось, что ни изоляция больных, ни социальное дистанцирование без использования масок, ни закрытие школ не принесли значимого результата. Максимальный эффект был получен от запрета массовых мероприятий, введения жесткого, со штрафами, масочного режима и закрытия организаций, где идет интенсивное общение. В результате этих мер репродуктивное число опустилось ниже единицы, и эпидемия начала стихать.
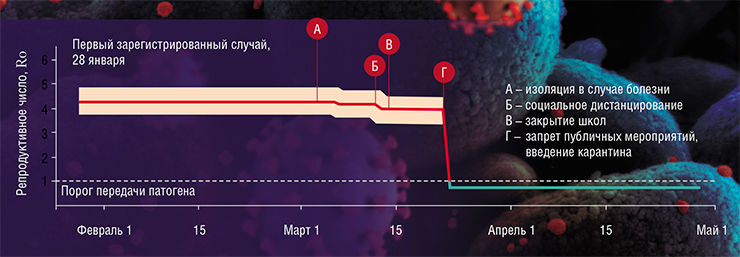
Похожая ситуация наблюдалась в Австрии, Норвегии, Италии и других европейских странах. Там также оказалось малоэффективным закрытие школ (школьники активно общаются и вне учебных заведений), а основной вклад в остановку эпидемии внесло ношение масок, отказ от массовых акций, социальное дистанцирование и изоляция больных. При этом в Швеции, где подобные меры были введены не сразу и не в полном объеме, уровень смертности, в первую очередь среди пожилых, оказался одним из самых высоких в Европе. А в Иране, Ираке, Саудовской Аравии после ослабления карантинных мероприятий началась вторая волна заболеваемости.
В г. Нью-Йорк 77 % умерших пациентов с диагнозом «коронавирус» имели также диабет, болезни легких, сердечно-сосудистые заболевания, включая гипертонию и астму, и лишь 1,5 % погибших были относительно здоровы. Для справки: около 66 % людей в США имеют избыточный вес или высокую степень ожирения, что увеличивает риск смерти при заражении коронавирусом. К тому же около половины взрослого населения в г. Нью-Йорк имеет повышенное кровяное давлениеНаиболее яркий пример эффективности противоэпидемических мер дали США. Речь идет о действиях администраций двух крупнейших американских городов: Сан-Франциско и Нью-Йорка. Руководство Сан-Франциско (губернатор Калифорнии и мэр города) 16 марта объявило о введении в штате жестких карантинных мер, включая самоизоляцию, ношение масок и почти полное прекращение деловой активности. В Нью-Йорке то же самое было сделано лишь спустя шесть дней. В результате в этом самом большом городе США в течение двух месяцев умерли около 20 тыс. человек, а в Сан-Франциско, втором по плотности и тринадцатом по численности, было лишь 35 смертельных случаев. Это наглядно показывает, насколько масштабными могут быть последствия даже небольшой задержки в принятии противовирусных профилактических мер.
Ковид или нет?
Коронавирус относится к РНК-содержащим вирусам и, помимо самой рибонуклеиновой кислоты, содержит еще липиды и вирус-специфические белки. Диагностировать его можно разными путями. Во-первых, по наличию в образцах из носоглотки больного компонентов самого вируса: РНК (метод ПЦР с обратной транскрипцией, ОТ-ПЦР) и вирусного антигена – поверхностного S-белка (иммуноферментный анализ).
Другой способ – оценить компоненты иммунитета организма, например выработку специфических антител. Для этого одновременно с возникновением симптомов в пробах крови пациента измеряют содержание «первичных» антител класса IgM. Уже прошедшее заболевание можно выявить по наличию «вторичных» антител класса IgG. Эти тесты также проводятся методом иммуноферментного анализа.
Эксперименты с заражением человека инфекционными агентами являются преступлением почти во всех странах мира. Поэтому до сих не определена инфицирующая доза вируса для человека, т. е. число вирусных частиц, которые должны попасть в организм, чтобы вызвать заболевание. Неизвестно, сколько вируса выделяют больные люди в окружающую среду в единицу времени, сколько частиц вируса попадает на пальцы во время соприкосновения с поверхностью столов, кнопок и других предметов быта. Но зато мы теперь знаем, как быстро и при каких условиях вирус в среде инактивируется: для этого этических норм нарушать не нужно.
К примеру, датские ученые выявили коронавирус в сточных канализационных водах района, где было много инфицированных, причем еще до того, как эти люди почувствовали первые симптомы заболевания. При этом для обнаружения вируса в канализационных водах используют практически те же тесты, что и при тестировании людей. Но всегда надо помнить, что с их помощью в пробах выявляют лишь наличие вирусной РНК, а не «живых» вирусных частиц. Поэтому исследователям стоит время от времени сверять результаты ПЦР-тестов с реальным выявлением живых вирусов на культурах клеток
На 20 августа 2020 г. в России было зарегистрировано 157 различных тест-систем: 126 выявляют антитела к коронавирусу, 31 – вирусную РНК. Но почему при таком внушительном количестве мы говорим о ненадежности диагностикумов?
Во-первых, в случае применения тест-систем на вирусную РНК очень важно правильно взять материал из носоглотки, который к тому же надо быстро поместить в специальную жидкость для выделения и консервации вирусной РНК, для чего требуются специальные пробоотборники. Во-вторых, сегодня лабораторий, где проводятся тесты, много, но далеко не во всех все этапы процедуры тестирования выполняются правильно.
В-третьих, вероятность выявить РНК из верхних дыхательных путей снижается на поздних стадиях заболевания из-за «ухода» вируса из носоглотки. Наконец, оказалось, что ОТ-ПЦР-тест нередко долгое время дает положительный результат даже после выздоровления больного. Предполагается, что причина заключается в следующем: в организме продолжают циркулировать не живые вирусы, а фрагменты вирусной РНК.
Надежные тест-системы на вирусный антиген разработаны и введены в медицинскую практику недавно, но уже показали свою полезность для точной диагностики больных, потому что в некоторых ситуациях позволяют поставить точный диагноз в случае негативного или неясного результата на вирусную РНК.
Что касается тест-систем на антитела IgG, то некоторые из них могут давать ложноположительные результаты, если человек недавно переболел одним из обычных коронавирусов, вызывающих ОРВИ, а сама тест-система оказалась недостаточно специфичной. В результате нам может казаться, что большая часть нашего населения имеет антитела к SARS-CoV‑2, тогда как в реальности эта доля пока не превышает 10–12 %, судя по данным самых высокоспецифичных тестов.
С другой стороны, даже если у человека отсутствуют антитела класса IgG, это не означает, что он лишен иммунной защиты против вируса. Дополняющим тестом для оценки индивидуальной защищенности является установление наличия/отсутствия специфического Т-клеточного иммунитета, при котором происходит активация иммунных клеток и выявление индукции цитокинов. Однако сложность и стоимость подобной диагностики и анализа на антитела несопоставимы, поэтому их применяют только в научных исследованиях ограниченного масштаба.

Проблемой является и то, что сегодня у нас в России в открытом доступе нет данных сравнительного анализа специфичности и чувствительности уже применяемых диагностикумов, проведенного с использованием контрольных образцов от реальных пациентов и обширных панелей отрицательных сывороток от людей, не болевших COVID‑19, как это было сделано в некоторых зарубежных странах. А такие данные пригодились бы и в Минздраве России, и в региональных органах здравоохранения при принятии решений о закупке тех или иных диагностических средств, потому что в данном случае, как и во многих других, дешевизна не является бесспорным признаком хорошего качества.
Как лечим?
Увы, но эффективных препаратов с доказанным вирусоспецифическим действием против COVID‑19 пока нет, хотя поиски новых средств, включая терапевтические антитела, ведутся с января 2020 г.
Единственное средство, которое было предварительно одобрено Управлением по контролю за продуктами питания и лекарствами США (FDA), – это ремдесивир (производства американской компании Gilead Sciences, Inc.), ингибитор вирусного фермента РНК-полимеразы. В свое время он был разработан для терапии лихорадки Эбола, хотя в этом качестве себя особо не проявил.
Первая группа пациентов с пневмонией, вызванной SARS-CoV‑2, начала официально принимать этот препарат в Китае еще в феврале 2020 г., но тогда он не показал свою эффективность. Однако два клинических испытания, проведенные позже в США, продемонстрировали, что это лекарство сокращает продолжительность тяжелой формы заболевания с 15 до 11 дней и уменьшает летальность на 20—25 %. Однако два других клинических исследования эти результаты не подтвердили. Тем не менее сейчас ремдесивир разрешен для лечения COVID‑19 в США; в России он не зарегистрирован.
Изучается эффективность препаратов другой направленности – ингибиторов интерлейкина-6 (ИЛ‑6), небольшой молекулы, координирующей иммунный и острый воспалительный ответы, которые помогают предотвратить так называемый цитокиновый шторм, когда иммунная система больного «идет вразнос». К подобным средствам относится тоцилизумаб на основе моноклонального антитела. По сообщению итальянских врачей, он облегчает течение болезни за счет предотвращения воспаления легких и полезен в предострой стадии заболевания.
По данным британских врачей, подавить цитокиновый шторм и уменьшить смертность при тяжелом течении болезни позволяет давно известный и намного более дешевый препарат дексаметазон – синтетический глюкокортикостероид с противовоспалительным и иммунодепрессивным действием. В Великобритании этот препарат показал себя очень хорошо, но при легких случаях COVID‑19 его применение противопоказано.
Для лечения вызванной вирусом пневмонии испытывалось и сочетание противомалярийного препарата гидроксихлорохина с антибиотиком азитромицином. Предполагалось, что первый уменьшает воспалительную реакцию в легких, а второй предотвращает присоединенную бактериальную инфекцию. Однако многочисленные публикации о неэффективности первого компонента этого сочетания поставили на нем крест. Более того, гидроксихлорохин и азитромицин сами по себе могут в некоторых случаях увеличивать риск летального исхода из-за сердечно-сосудистых осложнений, а люди с подобными проблемами и так особенно уязвимы перед коронавирусом.
Большие надежды возлагались на препарат на основе фавипиравира, зарегистрированный в 2015 г. в Японии под названием Avigan, как средство для терапии тяжелого гриппа при иммунодефицитных состояниях (его нельзя применять к беременным женщинам из-за тератогенного эффекта). Это вещество является ингибитором РНК-полимераз, как и ремдесивир, причем воздействует только на ферменты РНК-содержащих вирусов, а не на человеческие. В феврале 2020 г. в Китае начались клинические испытания препарата на больных COVID‑19, а в марте было объявлено об эффективности лекарства, при том что никаких разъяснений не последовало.
Срок лицензии на фавипиравир/авиган истек в 2019 г., и три российских производителя летом 2020 г. выпустили на отечественный рынок три препарата на основе фавипиравира: коронавир, авифавир и арепливир, которые позиционируются как лекарства от коронавирусной инфекции. В сентябре эти рецептурные препараты поступили в розничную продажу по цене, сопоставимой с прожиточным минимумом в РФ.
Что касается их эффективности, то недавно в Японии была закончена третья фаза клинических испытаний фавипиравира на коронавирусных больных, которые показали, что при средней тяжести заболевания его прием сокращает продолжительность болезни с 14,7 до 11,9 дней. Эти данные согласуются с результатами российских пилотных исследований: при средней и легкой форме болезни фавипиравир «позволяет сократить период до клинического улучшения» примерно на 3,5 дня и на один-три дня ускорить элиминацию вируса из носовой полости. Остается добавить, что для полного курса терапии требуется 1,5–2 упаковки препарата по 40 таблеток в зависимости от веса.
Вакцинируемся? Или нет?
На конец августа 2020 г. в мире разрабатывалось около 160 кандидатных вакцин, из которых почти полсотни находились на разных стадиях клинических испытаний, в том числе девять – на III фазе. На этом этапе обычно проводятся многоцентровые, тщательно контролируемые исследования с участием больших групп пациентов (как минимум 1–3 тыс. человек) для определения безопасности и оценки защитного эффекта лекарственного средства в условиях реальной эпидемии.
При этом две вакцины в России и Китае были разрешены к ограниченному применению на национальном уровне до окончания клинических испытаний III фазы – случай беспрецедентный.
Во-первых, это вакцина китайской компании CanSino Biologics на основе аденовируса 5-го серотипа, в геном которого вставлен ген коронавирусного белка-шипа. В августе начались клинические испытания III фазы на десятках тысяч добровольцев в Саудовской Аравии по согласованию с Минздравом этой страны. Однако еще 25 июня 2020 г. Министерство обороны Китая официально разрешило использовать эту вакцину в течение года для вакцинации врачей некоторых армейских подразделений. До сих пор неясно, идет ли речь о добровольной или обязательной вакцинации. На сегодня это самая «продвинутая» вакцина из всех аденовирусных вакцин.
Второй «зимней ласточкой» стала двухкомпонентная вакцина «Спутник V», разработанная совместно московским НИЦ эпидемиологии и микробиологии им. Н. Ф. Гамалеи и 48 ЦНИИ Минобороны РФ. Она также создана на основе аденовирусов (5-го и 26-го серотипов человека) со встроенным геном коронавирусного белка S. На такой методологической основе в этом НИЦ ранее уже были разработаны кандидатные вакцины против экзотических для нашей страны лихорадки Эбола и ближневосточного респираторного синдрома, которые прошли клинические испытания I и II фазы.
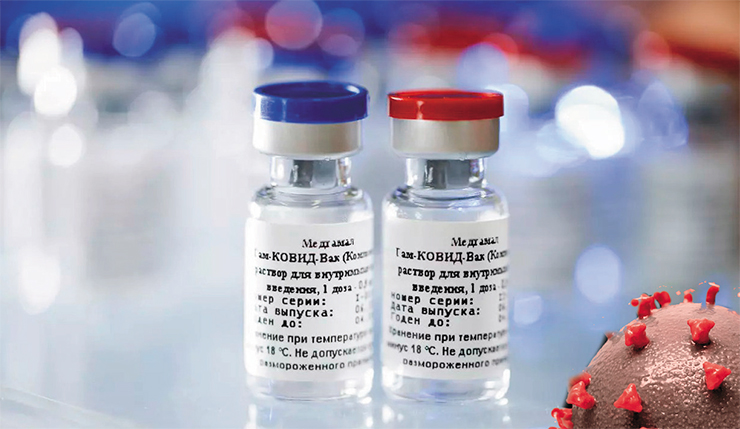
Защитный эффект вакцины в реальных условиях пока еще не оценен, поскольку он изучается именно на III фазе клинических исследований, которая началась во второй декаде сентября. Три фазы клинических испытаний – это обычный, нормальный алгоритм, который в данном случае был нарушен. Так, в ходе II фазы обычно варьируют дозу препарата, однако в уже опубликованных результатах клинических испытаний «Спутника V» таких данных нет.
Что касается III фазы, то у нее также есть свой регламент: каждому участнику испытаний выдается специальный дневник «самочувствия», за ним закрепляется врач-терапевт; все участники испытаний разбиваются минимум на четыре группы, одной из которых вводят плацебо вместо вакцины, другой – похожий вакцинный препарат, третьей – саму вакцину, четвертой – варьированную дозу и т. п. В случае же «Спутника V» мы столкнулись с невиданной до сих пор ситуацией: не дожидаясь начала III фазы клинических испытаний, 8 сентября 2020 г. Минздрав России объявил о разрешении выпустить в гражданский оборот первую партию вакцины – планируется массовая вакцинация населения из групп риска, в том числе в регионах.
Кстати сказать, в той же инструкции к «Спутнику V» указано, что вакцину не разрешено применять к детям, а также к людям старше 60 лет – основной группе риска (смертность среди лиц старше 75 лет составляет 20–30 %)
Все подобные рекомбинантные вакцины создаются на основе относительно безобидных вирусов, которых либо ослабляют (аттенуируют), либо лишают способности размножаться в организме человека. Фактически такие вирусы становятся векторами для доставки в клетки генетического материала патогена и вызывают специфическую иммунную реакцию, как и в случае ДНК- или РНК-вакцин. При попадании такого вируса в клетку его ДНК высвобождается и проникает в клеточное ядро, где на ней синтезируются матричные РНК, на которых собираются вирусные белки, включая поверхностный S-белок коронавируса. Когда эти белки встраиваются в клеточную мембрану, то клетка становится иммуногенной, т. е. способной вызвать в организме формирование специфичного иммунитета.
Что касается конкретной аденовирусной основы вакцины «Спутник V», то в инструкции к ней не приводится информация, каким образом эти вирусы потеряли способность размножаться в организме человека.
Об официальной регистрации «Спутника V» было объявлено 11 августа 2020 г. – почти за месяц до начала III фазы клинических испытаний и опубликования уже полученных результатов I–II фаз. Позднее было объявлено, что данная регистрация носит условный характер, со сроком действия до 1 января 2021 г., а окончательная будет произведена после завершения испытаний, в которых предполагается задействовать до 40 тыс. человек.
Летом 2020 г. на III фазу клинических испытаний вышли еще две вакцины на основе матричной РНК, кодирующей белок-шип коронавируса: одну из них разрабатывает инновационная американская биотехнологическая компания Moderna, другую – совместно компании BionTech (ФРГ), Pfizer (США) и FOSUN Pharma (Китай), а также три вакцины на основе инактивированного вируса SARS-CoV‑2, разработанные в Китае с участием государственных фармацевтических компаний.

Отдельно стоит отметить рекомбинантную вакцину со встроенным геном S-белка, также созданную на основе аденовируса, но не человеческого, а шимпанзе. Ее разработали в Оксфордском университете (Великобритания) совместно с англо-шведским фармгигантом AstraZeneca. III стадия ее клинических испытаний стартовала в начале августа в Бразилии, США и Южной Африке; есть информация, что часть этих испытаний планируется провести и в России.
Почему некоторые разработчики выбирают как основу рекомбинантных вакцин аденовирусы обезьян или редкие серотипы аденовирусов человека? Дело в том, что, согласно недавним исследованиям, довольно большая доля населения может уже иметь антитела к часто встречающемуся 5-му серотипу. Например, такие антитела обнаружены у 67 % людей, обследованных в Китае в рамках проекта по изучению онкозаболеваний, и более чем у 75 % детей из китайской провинции Цинхай, а также у четверти новобранцев армии США. И какова будет эффективность вакцин на основе этого аденовируса у людей, ранее уже с ним контактировавших, неизвестно.
Меньше всего огласки и «пиара» связано с разработками мировых лидеров по производству вакцин: международной биофармацевтической компании со штаб-квартирой в США Merck Sharp & Dohme, международной компании со штабом в Великобритании GlaxoSmithKline и транснационального производителя иммунобиологических препаратов, французской Sanofi-Pasteur.
В России разрабатывается еще несколько кандидатных вакцин на разной основе, в том числе в ГНЦ вирусологии и биотехнологии «Вектор» Роспотребнадзора (Кольцово, Новосибирская область), НИИ гриппа им. А. А. Смородинцева (Санкт-Петербург), а также в Федеральном научном центре исследований и разработки иммунобиологических препаратов им. М. П. Чумакова (Москва). Кроме того, ведутся переговоры с зарубежными разработчиками о производстве их вакцин в России. Так что выбор в 2021 г. у нас будет.
Подводная часть айсберга
Пандемия, вызванная коронавирусом SARS-CoV‑2 в 2020 г., не имеет прецедента по массовости проводимых обследований людей. Неудивительно, что она обнажила и многие проблемы, связанные с пониманием взаимодействия организмов разных людей с патогенными агентами, в первую очередь с вызывающими сезонный грипп и другими ОРВИ.
К примеру, вакцинируясь от гриппа и оставаясь здоровыми во время эпидемии, мы думаем, что избежали заражения. Однако не исключено, что в этом случае вирус гриппа все равно заражает небольшое число клеток верхних дыхательных путей, где «слегка» размножается, не вызывая явных признаков заболевания. И если это так, то даже вакцинированные люди могут быть бессимптомными носителями инфекции, как это уже доказано в случае с SARS-CoV‑2.

Еще десятилетия назад было показано, что все так называемые новые или возникающие инфекции – это плод адаптивной эволюции патогенов животных через «перескоки» от диких зверей к одомашненным, а затем к человеку. Как свидетельствуют молекулярно-генетические исследования вирусных геномов человека и животных, это утверждение справедливо и по отношению к давно известным вирусам кори, паротита, краснухи, гепатита С, ВИЧ. Поэтому в стратегических целях для предотвращения заболеваний человека необходимо не только вакцинировать животных от наиболее опасных заболеваний, но и проводить мониторинговые исследования, чтобы выявить всю гамму патогенов диких зверей, с последующей разработкой мер профилактики новых инфекций у людей.
Не менее важно при промышленном разведении домашних животных защищать их от патогенов диких сородичей. При этом разводить сельскохозяйственных животных нужно только в условиях закрытого содержания, а «дикие» рынки по продаже живых зверей запретить. На современных птицефабриках воздух поступает к птицам через фильтры, работники полностью переодеваются, а корма дезинфицируются. Тех же пальмовых циветт в Китае теперь также разводят только в закрытых питомниках, чтобы никакая летучая мышь туда не проникла
Другая сторона дела: сейчас человечество в принципе способно диагностировать 90 % респираторных инфекций. Но по крайней мере в России мы этого на практике не делаем. Диагнозы ОРВИ и грипп у нас ставят исключительно по симптомам. И это профанация, так как большинство проявлений у ОРВИ практически одинаковые. Грипп, правда, чаще всего проходит без насморка, но это характерно и для некоторых других инфекций, включая COVID‑19. Ответ о конкретной причине (этиологии) ОРВИ может дать лишь точная лабораторная диагностика. Ее сейчас можно сделать, но платно: ПЦР-диагностика ОРВИ не входит в финансирование ОМС.
Так как конкретные случаи «простудных» заболеваний или гриппа у нас определяют на глазок, то мы даже приблизительно не можем сказать, сколько больных с ОРВИ в нашей стране было реально заражено конкретным возбудителем в тот или иной момент времени. А это мешает и оценивать истинный ущерб от каждой из этих инфекций, и определять наиболее опасные и эпидемиологически значимые. Соответственно, мы не разрабатываем новые вакцины и противовирусные препараты против этих патогенов и не отслеживаем долговременные тенденции в их эволюции, за исключением вирусов гриппа. Поэтому неудивительно, что мы далеко не сразу замечаем, как группа возбудителей ОРВИ пополняется новыми вирусами.
Однако в некоторых странах соответствующие исследования проводятся в так называемых пилотных городах, где с помощью ПЦР анализируют пробы всех пациентов с признаками ОРВИ из нескольких поликлиник. Да, это довольно затратно: подобный анализ одной пробы стоит сейчас 7–8 тыс. руб. Но когда вы видите весь спектр возбудителей, становится понятно, против каких инфекций стоит разрабатывать вакцины.
Кстати сказать, среди причин этих болезней лишь 20 % составляют бактериальные инфекции, остальные – вирусные. Вакцины же сегодня разрабатывают и производят только против гриппа, доля которого в этиологии ОРВИ составляет 10–15 %. При этом те же коронавирусные инфекции в некоторых странах встречаются чаще (15–30 %). И эти «привычные» коронавирусы далеко не безобидны: у них так же, как и у COVID‑19, есть три типа течения болезни, включая тяжелую, при которой некоторые пациенты умирают как от последствий самой инфекции, так и от вторичной пневмонии на ИВЛ.

Конечно, делать поголовную диагностику всем больным с ОРВИ для выявления таких вирусных инфекций нет смысла, так как специфического противовирусного лечения нет, оно пока только симптоматическое. Обычный курс терапии будет примерно в 7 раз дешевле самой диагностики. В случае вирусной инфекции выборочные исследования нужно делать по озвученной выше причине: чтобы понять, какие вакцины следует разрабатывать и какие диагностикумы все-таки стоит внедрять в ОМС.
Подобное исследование в Москве, если его правильно организовать, потребовало бы около 15 млн рублей для тестирования в течение года нескольких тысяч пациентов – цена московской «трешки» или не самого дорогого кроссовера Bentley. Однако у Минздрава на подобные предложения ответ один – денег нет.
Главный урок, который дала нам пандемия, вызванная новой коронавирусной инфекцией, – это понимание, что на самом деле мы очень мало знаем о вирусных эпидемиях и инфекциях вообще. Она должна научить нас, как готовиться к таким будущим событиям и эффективно действовать в борьбе с ними. И дело даже уже не в самом COVID‑19, который имеет все шансы превратиться в очередную, пусть и опасную, сезонную инфекцию. Риск возникновения пандемии нового, неизвестного заболевания остается, пока в природе существуют животные и птицы – природные резервуары «диких» патогенов.
Больной COVID-19 начинает распространять инфекцию за два дня до появления первых симптомов. Даже когда заболевание проходит бессимптомно, инфицированные люди могут до двух недель выделять вирус в окружающую среду, причем не только при дыхании, чихании или кашле, но и с фекалиями. Именно поэтому пациентов снимают с карантина только после отрицательных анализов на присутствие вируса
И первое, что нам надо сделать уже сейчас, если мы действительно хотим защитить население, – это выяснить, чем мы все-таки болеем, какие возбудители вызывают у нас, россиян, самые опасные ОРВИ. Необходимо грамотно и эффективно направить на решение проблем здравоохранения больше денег, чем сейчас, чтобы в первую очередь провести мониторинговые исследования в ключевых городах, где особенно много ОРВИ: в Москве, Санкт-Петербурге, Новосибирске, Краснодаре, Екатеринбурге. Казани, Уфе, Владивостоке, а также в других городах-миллионниках.

Что касается SARS-CoV‑2, то, судя по всему, искоренить его с помощью одних противоэпидемических действий вряд ли удастся. Скорее всего, он продолжит циркулировать в человеческой популяции, по крайней мере до широкого внедрения в практику эффективных вакцин. Но у нас также постепенно растет прослойка людей, перенесших это заболевание легко или бессимптомно, которые, предположительно, имеют иммунитет. Вакцинация должна увеличить их число, и тогда эпидемия пойдет на спад.
Пока же массовое ношение масок и социальное дистанцирование могут снизить распространение инфекции, что защитит наиболее уязвимые слои населения. При этом надо учесть, что возвращение к жестким мерам (остановка работы предприятий, школ, вузов, кафе и ресторанов, магазинов) приведет к экономическому коллапсу, а это, в свою очередь, повлечет за собой ухудшение ситуации со здравоохранением.
Литература
Bendavid E., Mulaney B., Sood N. et al. COVID-19 Antibody Seroprevalence in Santa Clara County, California // MedRxiv. 2020. DOI: https://doi.org/10.1101/2020.04.14. 20062463.
Logunov D. Y., Dolzhikova I. V., Zubkova O. V. et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase ½ studies from Russia // Lancet. 2020. V. 396. N. 10255. P. 887–897.
Moghadas S. M., Fitzpatrick M. C., Sah P. et al. The implications of silent transmission for the control of COVID-19 outbreaks // PNAS. 2020. V. 117(30). P. 17513–17515.
Peccia J., Zulli A., Brackney D. E. et al. SARS-CoV-2 RNA concentrations in primary municipal sewage sludge as a leading indicator of COVID-19 outbreak dynamics // MedRxiv. 2020. DOI: https://doi.org/10.1101/2020.05.19.20105999.
Zhanga R., Li Y., Zhang A. L. et al. Identifying airborne transmission as the dominant route for the spread of COVID-19 // PNAS. 2020. V. 117(26). P. 14857–14863.