Вирусы атакуют… опухоль
Слово «вирус» обычно вызывает конкретные и неприятные ассоциации, недаром в переводе с латинского оно означает «яд, ядовитое начало». Опасными, болезнетворными, патогенными, а иногда и смертельными – такими предстают вирусы (по сути, простые мобильные наборы генетической информации, а не полноценные организмы) не только перед обычными людьми, но и медицинскими работниками. Что и неудивительно: не имея собственных систем для размножения, вирусы в обязательном порядке паразитируют в клетках высших организмов. Однако благодаря этому свойству вирусы сыграли важную роль в эволюции живого мира, а в наши дни стали основой генно-инженерных технологий. Но и в своем обычном амплуа вирусы могут стать нам друзьями и целителями – в случае, если зараженные ими клетки окажутся раковыми…
Наше тело является своего рода микрокосмом, средой обитания для множества мельчайших созданий. Но если бактериальное сообщество человеческого организма, в которое входит большое число дружественных нам симбиотических или «нейтральных» видов, интенсивно и успешно изучается, то понятие об аналогичном «вирусном сообществе» пока не принято даже в научных кругах.
Тем не менее имеется много фактов, свидетельствующих в пользу этого утверждения. Взять, к примеру, широко известные пикорнавирусы, которые вызывают такие серьезные заболевания, как полиомиелит и сезонные респираторные инфекции. Оказалось, что эти вирусы встречаются и в кишечнике здоровых людей. Более того, в случае вспышки вирусного заболевания в поисках инфекционного агента обычно обнаруживают не один вирус, а настоящий вирусный «букет», так что порой даже нельзя с абсолютной уверенностью утверждать, какой вирус в данном случае явился возбудителем болезни.
По-видимому, есть вирусы, которые паразитируют на человеке, размножаясь ограниченно в группах клеток и не причиняя видимого вреда своему хозяину. Однако при определенных условиях они могут мутировать с образованием более патогенных вариантов. В этом случае возникает острая вирусная инфекция, которая заканчивается, когда в организме сформируется специфический иммунитет к патогену.
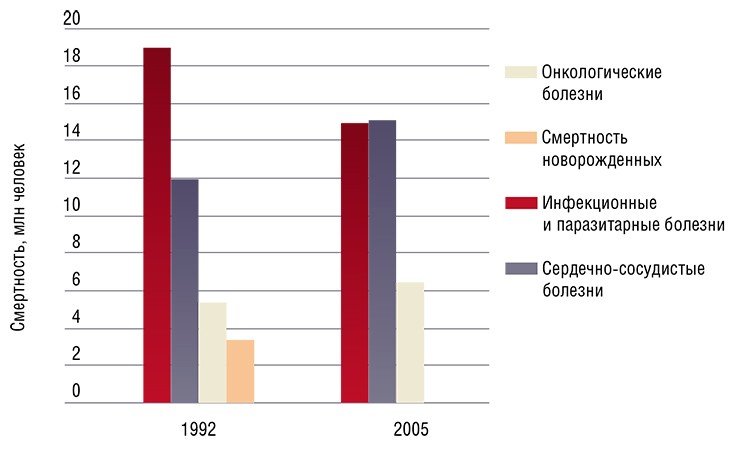
Но несмотря на относительно слабую изученность вирусного сообщества человека, практически сразу после открытия вирусов был обнаружен удивительный факт: у онкобольных вирусная инфекция может повлиять на протекание злокачественного процесса. Были зафиксированы случаи улучшения состояния таких пациентов и даже наступление длительной ремиссии после перенесенного вирусного заболевания либо вакцинации.
На основе этой информации еще в начале XX в. родилась идея использовать вирусы в борьбе с раковыми заболеваниями человека.
Взлеты и падения
Возможность создания принципиально новой формы терапии онкологических заболеваний, основанной на присущей вирусам способности убивать клетки, в которых он размножается, была впервые показана в середине прошлого века на примере рака шейки матки (Newman, 1954).
В России исследования онколитических свойств вирусов начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Нужно отметить, что в то время в стране была развернута большая противополиомиелитная система, в которую входили различные исследовательские лаборатории, связанные общей тематикой. Помимо изучения собственно полиомиелита в них проводились широкие исследования, касающиеся взаимодействий «вирус–вирус» и «вирус–клетка».
В результате удалось выделить и типировать ряд непатогенных для людей энтеровирусов, на основе которых были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. При этом в ряде случаев удалось наблюдать положительный клинический эффект и в отношении злокачественных заболеваний, вплоть до полного исчезновения первичной опухоли и метастазов.

В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса, и у части из них было отмечено улучшение состояния (Ворошилова, Ваганова, 1969; Ворошилова и др., 1977; Ворошилова, 1988).
Однако в 1980-х гг. как отечественные, так и зарубежные работы в этой области были приостановлены: причиной послужил недостаток данных о механизмах этого явления и молекулярной природе как вирусов, так и самого рака, а также технологические сложности с высококачественной очисткой вирусных препаратов, необходимой в интересах безопасности пациентов. Образно выражаясь, восторжествовали опасения «выпустить джина из бутылки».
ВИРУСЫ: «ЗДОРОВАЯ» КОНКУРЕНЦИЯВ наших наблюдениях у большинства вакцинированных* детей были получены хорошие результаты, но у некоторых из них вакцинный вирус не «приживлялся» в кишечнике и антитела в крови детей не появлялись. Вирусологические исследования, проведенные как в нашей, так и во многих других лабораториях, показали, что на успех пероральной иммунизации против полиомиелита живой вакциной Сэбина неблагоприятно влияет конкуренция со стороны неполиомиелитных типов энтеровирусов, обитающих в кишечнике у многих детей с момента рождения, не влияя на состояние их здоровья. Этот факт дал нам возможность подтвердить наличие симбиоза с организмом человека некоторых рас непатогенных сапрофитных энтеровирусов, способных в среде обитания конкурировать с живой вакциной Сэбина, а также с болезнетворными вирусами при соответствующих условиях <…>
Нами был предложен новый принцип борьбы с энтеровирусными болезнями путем вытеснения болезнетворных вирусов конкурирующими в среде обитания непатогенными энтеровирусами-симбионтами, и на их основе М. К. Ворошиловой были разработаны так называемые живые энтеровирусные вакцины (ЖЭВ) <…>
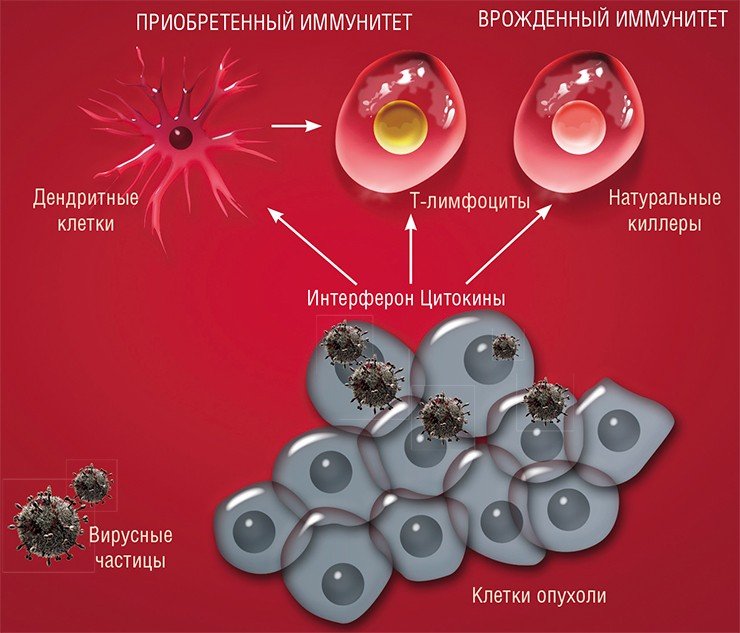
В результате наших наблюдений и ряда исследований впервые было доказано существование нового для науки феномена – эффективного подавления болезнетворных вирусов непатогенными расами энтеровирусов-симбионтов кишечника, благодаря конкуренции за среду обитания и интерферирующему воздействию с одновременной стимуляцией нескольких защитных систем организма. Селекционированные полезные вирусы-симбионты оказались способными вызывать онколиз (разрушение некоторых видов опухолевых клеток) и, кроме того, защищать в некоторых случаях лейкоцитарную систему в организме от губительного действия радиоактивного излучения. Это открытие имеет как общебиологическое теоретическое, так и медицинское практическое значение, обеспечивая новые возможности для профилактики и лечения ряда заболеваний.»
Но уже в начале 1990-х гг. онколитические вирусы вновь стали объектом пристального внимания исследователей после публикации работы, посвященной лечению глиобластомы модифицированным вирусом простого герпеса (Martuza, 1991).
За последующие десятилетия благодаря выдающимся достижениям в молекулярной биологии и генетике и стремительному развитию биотехнологических методов исследования удалось проделать огромную экспериментальную работу по описанию специфических взаимодействий онколитических вирусов с раковымм клетками и выявить перспективные для терапии вирусные штаммы и типы опухолей, которые они могут поражать.
«Беззащитная» опухоль
Почему же вирусы – и не какая-нибудь специфическая группа, а все в целом – поражают в первую очередь именно опухолевую ткань? Причин этому несколько.
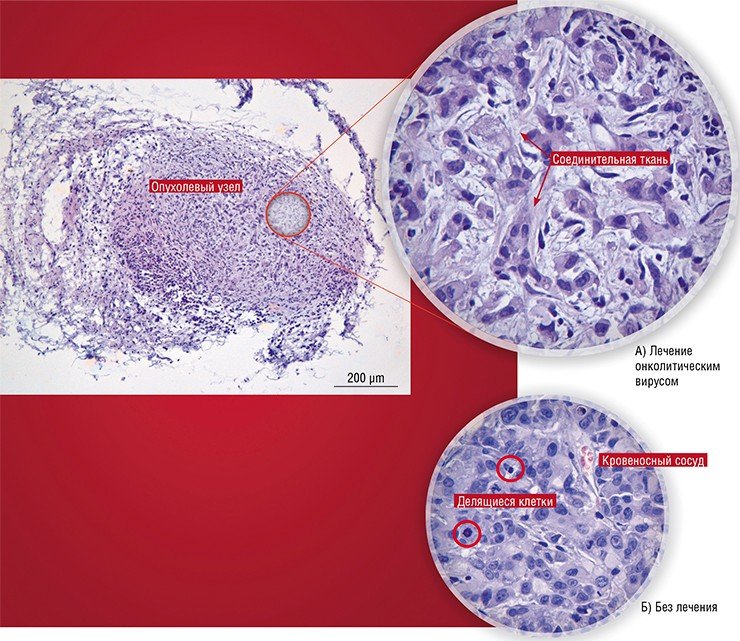
Во-первых, это сам необычный клеточный «характер» опухоли. Все нормальные ткани и органы обычно характеризуются четкой структурой и пространственной организацией благодаря наличию разнообразных мембран, клеточных тяжей, кровеносных сосудов и т.п. И все эти образования представляют собой естественные барьеры для распространения вируса. А опухоль, напротив, обычно структура дезорганизованная, хаотическое клеточное образование, которое кровоснабжается быстрорастущими неполноценными сосудами с дырчатыми стенками. Поэтому вирусу гораздо проще проникнуть в опухоль и распространиться по ней по сравнению со здоровыми тканями.
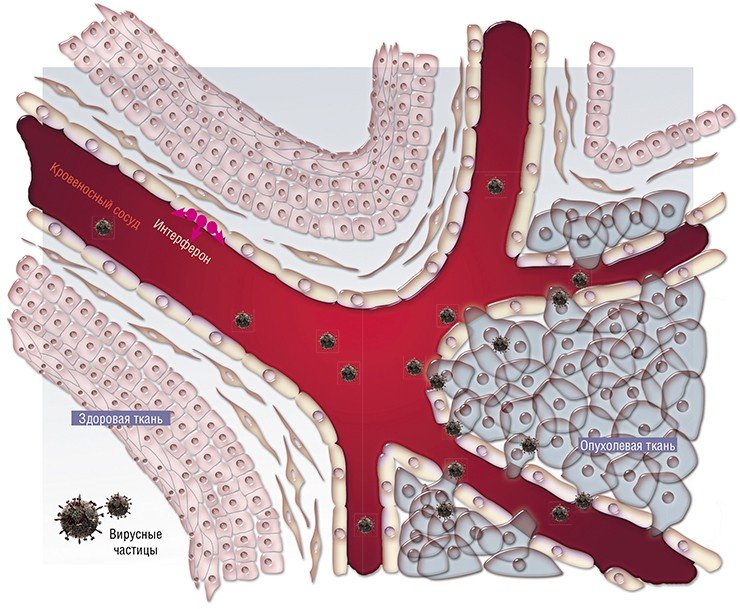
Таким образом, первая причина высокой чувствительности раковых клеток к вирусам – их физическая доступность.
Вторая причина связана со способами размножения самих инфекционных агентов. Дело в том, что вирусы в этом смысле не самодостаточны и используют для размножения ресурсы зараженной клетки. Обычно это происходит тогда, когда клетка сама находится в процессе деления и в ней присутствуют все ферменты, необходимые для репликации генетического материала и синтеза белков.
Некоторые вирусы имеют специальные механизмы, которые позволяют перевести клетку из покоящегося состояния в делящееся (к ним относятся и так называемые онкогенные вирусы, например, вирус папилломы, который вызывает рак шейки матки именно за счет стимуляции клеточного деления). Однако очень многие вирусы могут размножаться только в уже активно делящихся клетках, например, клетках слизистой (которая, как известно, в первую очередь поражается при сезонных вирусных инфекциях). И в этом смысле раковые клетки, главное занятие которых – деление, особенно беззащитны перед вирусной интервенцией.
В-третьих, одно из важнейших отличий нормальной клетки от раковой состоит в том, она «ощущает» себя частью целого. Поэтому среди ее функций есть и те, что представляют для самой клетки обузу, но нужны для поддержания функционирования всего организма. В числе этих функций и противовирусная защита. Но в своем развитии раковая клетка нередко освобождается от всего лишнего: вся ее активность нацелена исключительно на безудержное деление и экспансию. А поскольку противовирусная защита накладывает на клетку много ограничений, большинство опухолей, как правило, имеют дефектную «противовирусную оборону».
Здоровые – в безопасности
Таким образом, раковые клетки по милости самой природы служат готовой мишенью для вирусов. С использованием современных биотехнологий сегодня можно создавать вирусные препараты, которые будут специфически поражать и уничтожать только раковые клетки, не затрагивая здоровые.
Как же получить онколитический препарат, безопасный для нормальных тканей? Известно, что некоторые раковые клетки начинают экспрессировать на своей поверхности белки, не присущие нормальным клеткам, и вирус можно «научить» распознавать их. Однако это свойство раковых клеток, во-первых, не универсально; во-вторых, злокачественные клетки способны к быстрой «эволюции».
Исследователи все больше укрепляются во мнении, что в природе не бывает двух тождественных опухолей, даже если гистологически они очень схожи: рак возникает при «поломке» в клетках сотен разных генов, причем в разной последовательности и в разных вариантах. Более того, даже у одного больного опухолевые клетки могут отличаться некоторым генетическим и, соответственно, фенотипическим разнообразием.
Поэтому нет смысла снабжать онколитический вирус одним «оружием»: чем больше мишеней на поверхности клеток будет он узнавать, тем шире будет спектр его действия. И основой селективности вируса должны стать именно наиболее универсальные свойства раковой клетки, связанные с ее злокачественной трансформацией. Главные же отличительные свойства раковых клеток, как упоминалось выше, – безудержное деление, а также недифференцированный характер опухолей.
Поэтому мишенью вируса должны стать хаотичные скопища активно делящихся клеток. При этом в первую очередь будут поражаться наименее дифференцированные, наиболее злокачественные клетки. Здоровые же дифференцированные клетки будут защищены от проникновения такого дефектного вируса механизмами противовирусной защиты.
Персональный подход
Помимо избирательности по отношению к здоровым клеткам, «идеальный» онколитический вирус должен также обладать широким спектром действия в отношении разных типов раковых клеток. Достичь этого можно разными способами. Стратегия совместной работы московских и новосибирских специалистов заключается в создании панели онколитических энтеровирусов с разной антигенной структурой, покрывающей максимально широкий спектр типов рака.
Для решения этой задачи, в частности, проводится селекция вирусов на их способность размножаться в различных культурах раковых клеток. На основе анализа генетической структуры таких вирусов можно определить, какие из приобретенных вирусом мутаций делают его наиболее действенным в отношении определенного типа опухолевых клеток.
Имея панель таких онколитических вирусов, можно будет, взяв биопсию опухоли от конкретного пациента, подобрать для него наиболее эффективный набор вирусных штаммов. Причем эту процедуру можно повторять по мере лечения, поскольку сама опухоль может меняться, ускользая от действия онковируса. В таком случае сможет помочь уже другой вариант вируса, а так как он будет отличаться по антигенной структуре от предыдущего, то не уничтожится под действием механизмов противовирусного иммунитета, сформировавшегося в ходе предыдущего лечения.
Еще один подход в создании онколитических вирусов можно назвать «внутриклеточной химиотерапией». Обычная химиотерапия отличается высокой токсичностью, причем в первую очередь страдают активно делящиеся клетки кроветворных органов и слизистой. Однако в вирус, избирательно поражающий только опухолевые клетки, можно встроить специальный ген, благодаря которому в клетке опухоли будет накапливаться безвредное (до поры!) вещество. При соединении с другим безвредным веществом, которое можно без опаски давать пациенту системно и в больших дозах, в клетке опухоли, зараженной вирусом, будет образовываться высокотоксичное соединение. Таким образом можно достигнуть точечного терапевтического эффекта, направленного исключительно против клеток опухоли.
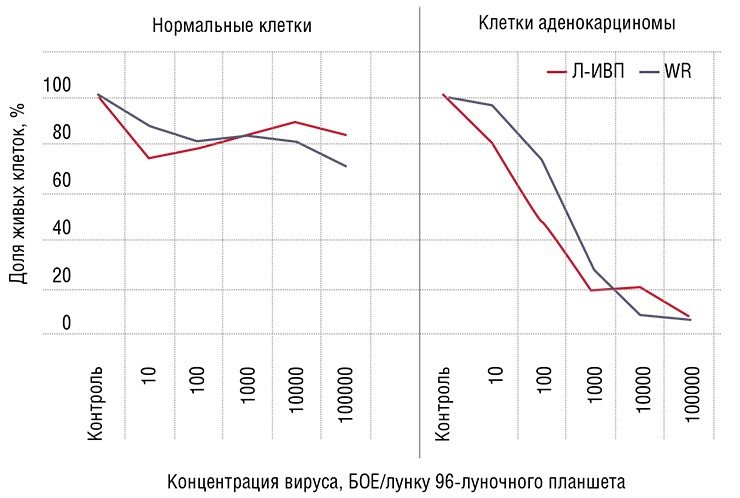
СИБИРСКИЙ КАНЦЕРОЛИЗИНСейчас канцеролизин проходит вторую стадию клинических испытаний. Однако несмотря на явную эффективность этого и подобных ему препаратов, созданных в конце XX в., их можно назвать лишь первым пробным камнем в области онколитических вирусов. Вооруженные современными молекулярно-генетическими знаниями, ученые сегодня гораздо лучше представляют себе стратегию и тактику создания таких вирусных препаратов
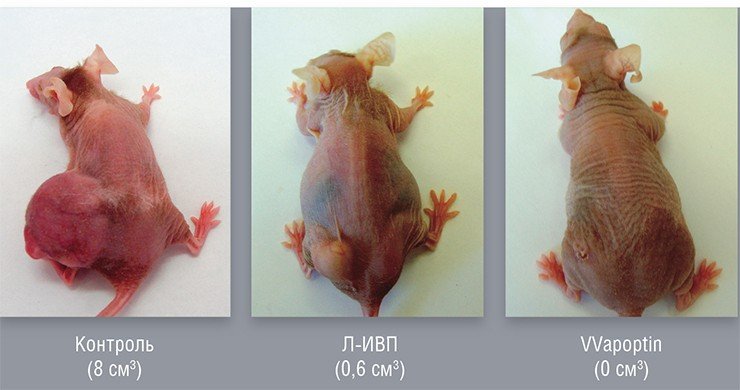
Онколитические вирусы можно дополнительно вооружить и генами, продуцирующими в раковой клетке белки, опасные лишь для этих клеток. Например, белок апоптин, выделенный из вируса птичьей анемии, по еще не совсем понятному механизму вызывает самоубийство исключительно только раковых клеток. На основе вируса осповакцины генно-инженерным способом уже создан такой штамм, способный эффективно уничтожать клетки опухоли человека, подсаженные лабораторным мышам.
Еще одна проблема терапии с помощью онколитических вирусов связана с разработкой наиболее эффективных способов их введения в организм. Ведь на пути вируса в организме встает много барьеров. К примеру, та же печень, являющаяся своего рода мощнейшим антивирусным фильтром.
Для решения этой проблемы можно использовать стратегию «троянского коня», когда в организм вводится не сам вирус, а клетки самого пациента (например, лейкоциты), заранее зараженные этим вирусом. При попадании в организм этот вирус, только начавший размножаться в лейкоците, является «невидимкой» для клеток-защитников. Когда же зараженная клетка достигает опухоли, из нее выходят тысячи активных вирусных частиц, «набрасывающихся» на раковые клетки.
За и против
В настоящее время, несмотря на все успехи в изучении онколитических свойств вирусов, их применение в онкотерапии является, скорее, исключением, чем правилом.
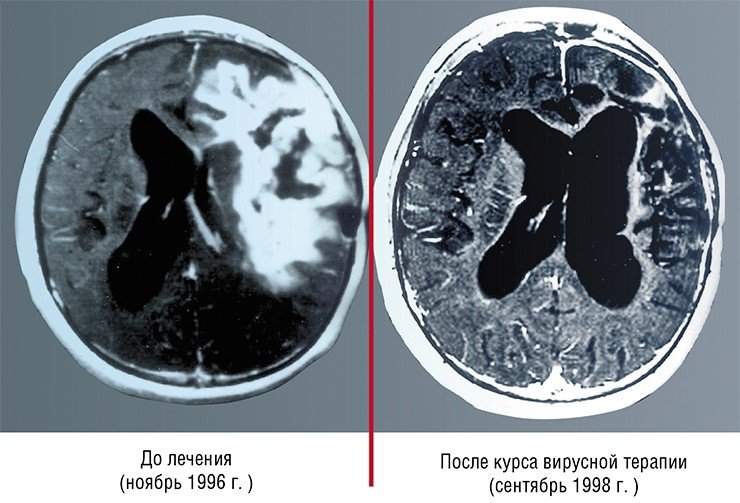
Так, разработанный в США препарат сегодня применяется с согласия пациента при лечении глиобластомы в качестве дополнительной терапии. В Китае лицензирован и успешно применяется для терапии карцином один из штаммов аденовируса, несущий две генетические делеции (Yu, 2007).
В Латвии после распада СССР были продолжены работы по изучению онколитических вирусов, начатые в рамках противополиомиелитных исследований. В результате на основе одного из энтеровирусов был создан и сегодня используется на практике препарат Ригвир, направленный против меланом, который можно вводить непосредственно в кровяное русло.
Всего же сегодня в мире проходят клинические испытания свыше тридцати разнообразных онколитических вирусных препаратов. И основная проблема здесь не столько научная, сколько экономическая. Дело в том, что терапия рака (в первую очередь химиотерапия) – это большие деньги. В условиях сложившегося и процветающего рынка химиотерапевтических препаратов применение новых, пусть даже и более безопасных биотерапевтических средств потребует весьма дорогостоящей перестройки всей системы лечения. А это не может не затронуть интересы крупных фармацевтических компаний.
Стратегия таких компаний в отношении нарождающихся разработок в области онколитических вирусов неоднозначна. Так, права на один из первых онколитических препаратов ONYX-015 вместе с самой компанией-разработчиком были приобретены одной известной фармацевтической фирмой, после чего исследования по этой теме были закрыты. С другой стороны, по¬скольку полностью остановить прогресс в этой области невозможно, уже сегодня во многих фармацевтических компаниях создаются подразделения, занимающиеся изучением вирусных онколитиков. Оптимизма добавляет и тот факт, что за последние пятнадцать лет число работ по этой тематике растет как снежный ком.
Одновременно с прогрессом в создании вирусных противораковых средств в обществе, как и в случае пресловутых генетически модифицированных организмов (ГМО), возникают разнообразные фобии и слухи. Они во многом базируются на недостаточной осведомленности широкой общественности в сути дела и раздуваются благодаря действиям некоторых заинтересованных компаний.
Действительно, вопрос о безвредности тех или иных вирусов пока изучен не до конца. Поэтому приходится мириться с тем, что на пути к широкому внедрению этих очень перспективных методов лечения рака будут вставать многие преграды. В любом случае, исследователи должны действовать очень обдуманно, осторожно взвешивая все возможные последствия.
Вероятно, даже когда этот подход в онкотерапии будет признан достойным широкого внедрения, придется соблюдать определенные меры эпидемиологической безопасности, наподобие тех, что применяются сегодня в инфекционных отделениях больниц: вести строгий вирусологический контроль во время лечения, ограничивать контакты с пациентом. Также следует создавать такие варианты онколитических вирусов, которые можно будет по желанию экстренно «выключить» во избежание появления их хронических носителей.
Но, как учит история науки, подобные проблемы всегда вставали на пути любого нового перспективного метода лечения и, как правило, успешно преодолевались.
Сейчас крепнет уверенность, что знания, накапливающиеся в области вирусологии, иммунологии, биологии клетки и других смежных дисциплин, позволят (и уже позволяют!) создавать такие варианты вирусов, которые будут не только эффективно и избирательно уничтожать раковые клетки, не затрагивая нормальные, но еще и стимулировать в организме естественные механизмы противоопухолевой защиты.
В будущем основой для терапии рака могут стать искусственные вирусы. Уже сейчас дальней целью разработок московских и новосибирских специалистов является создание модульной вирусной системы (в будущем – полностью синтетической) – своего рода молекулярного конструктора, из которого исследователь по желанию сможет собрать из отдельных генетических компонентов нужный вариант онколитического вируса.
Такие синтетические вирусы не должны структурно напоминать природные. Это важно потому, что схожие вирусы способны рекомбинировать друг с другом, обмениваясь участками своего генома, благодаря чему терапевтический вирус может приобрести неполезные гены и, соответственно, нежелательные, опасные свойства. Можно разработать такой синтетический вирус, который по функциям и общему плану строения будет похож на природный, но по нуклеотидной последовательности будет настолько от него отличаться, что утратит способность к рекомбинации со своими природными собратьями.
Но все это – дело достаточно отдаленного будущего. Пока же вирусные онколитики не следует рассматривать как панацею. Они могут служить действенным дополнительным средством в системе комплексного воздействия на опухоль в сочетании с традиционными методами лечения. И такое вирусное «оружие» окажется далеко не лишним в борьбе с одной из самых смертоносных и трудно поддающихся лечению болезней современности.
Литература
Вдовиченко Г. В и др. Доклинические исследования противоракового лечебного аденовирусного препарата «канцеролизин»//Вопросы вирусологии. 2006. № 6. C. 39–42.
Ворошилова М. К. Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.,1988. С. 24–29.
Качко А. В. и др. Рекомбинантная плазмидная ДНК pAd5 f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е 1 В 55 К, и штамм мутантного аденовируса Adel2, обладающий селективной противоопухолевой активностью. Патент РФ № 2194755 (467) 05.03.01.
Качко А. В. и др. Варианты аденовируса типа 5 с делениями в ранних генах: способность к селективной репликации в р53 дефектных опухолевых клетках человека // Молекулярная биология. 2003. № 37 (5). С. 868–875.
Martuza R. L.et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant//Science. 1991. V. 252. P. 854–856.
Первый за Уралом
Победители первого конкурса научных мегагрантов Правительства РФ, направленных на поддержку исследований под руководством ведущих ученых в российских вузах, были названы в октябре 2010 г. Всего на конкурс подавалось 507 заявок, которые были рассмотрены международными экспертами и утверждены Советом по грантам. Победители, среди которых оказался и Новосибирский национальный исследовательский государственный университет, получили финансирование в размере 150 млн рублей
Новосибирский национальный исследовательский государственный университет (НГУ) получил в 2010 г. три мегагранта правительства РФ, один из которых под руководством д.б.н., профессора П. М. Чумакова, предназначался для создания университетской лаборатории по исследованию онколитических вирусов.

В 2010—2012 гг. за счет средств мегагранта и софинансирования в НГУ реконструированы помещения для проведения практических занятий по микробиологии и частично – по аналитической химии. На этой базе был создан исследовательский комплекс из лаборатории микробиологии и вирусологии (руководитель П. М. Чумаков) и лаборатории бионанотехнологий (руководитель – проректор по научной работе НГУ, д.б.н., профессор С. В. Нетесов).
Комплекс отвечает всем требованиям, предъявляемым к помещениям международного уровня биобезопасности BSL-2*. Он разделен на «чистую» и «заразную» зоны, сообщающиеся через санпропускник и передаточный шлюз, предусмотрен аварийный душ, гардеробы технологической и переходной одежды. Имеется бокс для культивирования клеточных культур и для работы с непатогенными вирусами и вирусами 3—4 (самых низких) групп опасности, по российской классификации. Также имеются специальные помещения для подготовки стерильного лабораторного оборудования и воды.
В вирусологическом боксе, оснащенном всем необходимым современным оборудованием для высокопроизводительной работы с непатогенными вирусами и их геномами, могут одновременно проводить исследования три сотрудника. Весной 2013 г. заканчивается реконструкция помещений для генно-инженерных работ, секвенирования геномов, а также биоинформационных и биотехнологических исследований.

В штат лабораторий вошли на долговременной основе несколько специалистов – докторов и кандидатов наук, а также аспиранты и студенты, ориентированные на научные исследования и разработки в самых современных областях микробиологии и молекулярной биологии. Во-первых, это изучение молекулярного разнообразия геномов вирусных возбудителей желудочно-кишечных и респираторных заболеваний человека и животных на территории азиатской части России. Во-вторых – создание онколитических рекомбинантных вирусов, а также бактерий, производящих рекомбинантные биологически активные белки человека, которые на сегодня признаются одними из самых перспективных противораковых препаратов.
Помимо лабораторного блока была проведена реконструкция учебного помещения, которое теперь располагает «кабинетами биобезопасности» для проведения модельного микробиологического практикума для студентов-биологов и медиков старших курсов, где уже ведутся занятия.
Таким образом, принимая во внимание наличие в Научно-образовательном комплексе по наноматериалам и наносистемам НГУ нескольких суперсовременных электронных микроскопов, можно с утверждать, что в университете вступил в строй первый за Уралом современный лабораторный мини-комплекс по изучению микроорганизмов и разработке на их основе новых биомедицинских приложений.
Работы по этой тематике планируется проводить в сотрудничестве с передовыми биотехнологическими компаниями Новосибирской области и всего Сибирского федерального округа, а также, в случае взаимной заинтересованности, и с ведущими зарубежными предприятиями аналогичного профиля.
* Этот уровень биологической безопасности, по зарубежной классификации, используется для работы с возбудителями заболеваний человека, представляющими умеренную опасность для персонала и окружающей среды