Россия Делает Сама
Новые аналоги ДНК для лечения наследственных и инфекционных болезней
Весной 2014 г. в Москве в павильоне ВДНХ была развернута временная музейная экспозиция под названием «Россия делает сама», посвященная знаменитым отечественным ученым прошлого и настоящего, передовым технологиям, нацеленным в будущее. Один из экспонатов, рядом с которым всегда было немало посетителей, напоминал футуристическую голову инопланетянина с двумя огромными «глазами». Это – макет изделия РДС-1, первой советской атомной бомбы, взорванной на Семипалатинском полигоне в августе 1949 г.
Есть несколько вариантов расшифровки сокращения РДС: от официального «реактивный двигатель специальный» до наиболее романтического «Россия делает сама», который и дал название упомянутой выставке (Новоселов, Толстиков, 1995). Авторство последней расшифровки приписывают нескольким персонам: от заместителя главного конструктора «Арзамаса-16» К. Щелкина до руководителя атомного проекта Л. Берии. Открывший выставку министр культуры В. Мединский, остановившись у макета бомбы № 1, подчеркнул: «Этот экспонат должен напомнить всем нам, что Россия действительно многое может делать сама. Разоренная, еще не оправившаяся после войны, она сделала эту бомбу всего за два года и восемь месяцев с момента принятия решения и до первых испытаний».
«Да полноте! – скажет кто-нибудь из завсегдатаев интернета. – Какое там “Россия делает сама”? Всем известно, что чертежи атомной бомбы были добыты советской разведкой в США. Так что нашим ученым оставалось только воспроизвести чужое изобретение, созданное гением западных ученых».
Спору нет, разведка сработала на «отлично», что намного ускорило работу над РДС-1. Но плутоний для этого пришлось добывать самим. И не только плутоний: пришлось искать оригинальные конструкторские решения, создавать новое уникальное оборудование, фактически закладывать фундамент новых отраслей промышленности
и областей науки. И эту работу наша страна второй половины роковых сороковых годов прошлого века сумела выполнить сама. Главный результат ее остается с нами и по сей день. Говоря словами физика Гусева, героя фильма М. Ромма «Девять дней одного года», «без этого нас бы не было»
Сегодня нам стоит почаще вспоминать, что Россия и в самом деле сама может делать многое руками своих граждан: рабочих, инженеров, ученых. Особенно важной представляется роль ученых, которые по сути своей деятельности обязаны быть на острие поиска. И не только в ядерной физике, но и в химии, биологии, в общественных дисциплинах – на всех направлениях развития науки.
Роль биологии в последние годы по ряду причин представляется определяющей. Развитие постгеномных технологий, методов персонализованной медицины, открытие способа направленного редактирования «святая святых» живого организма – генома требуют к себе пристального внимания в силу того значения, которое эти технологии приобретают для сферы здравоохранения и поддержания благополучия человека.
В эпоху бурного развития науки, формирования нового технологического уклада легко упустить момент и в результате оказаться на обочине прогресса. Ведь даже только для того, чтобы оставаться на месте, «нужно бежать со всех ног», как советовали Алисе из известной сказки Л. Кэрролла. Отстающих же в современном мире ожидает незавидная участь – оплачивать высокотехнологичные продукты, произведенные лидерами мировой технологической гонки, причем за счет своих невосполнимых природных и человеческих ресурсов.
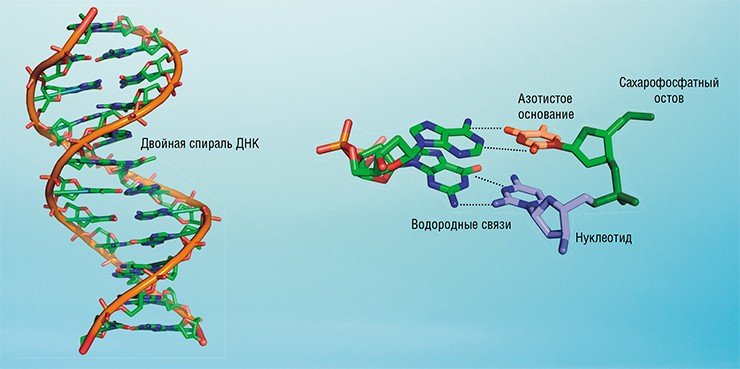
Одним из основных компонентов прогресса в области биологии является сумма технологий, основанных на использовании нуклеиновых кислот – ДНК и РНК. Отечественным ученым по праву принадлежит ряд исторических прозрений в этой области науки. Ровно полвека назад, когда основы современной молекулярной биологии еще только закладывались, Нина Ивановна Гринева выдвинула идею воздействовать на участки клеточных молекул нуклеиновых кислот с помощью комплементарных им коротких синтетических фрагментов тех же нуклеиновых кислот – олигонуклеотидов, несущих реакционноспособные группы (Belikova, Zarytova, Grineva, 1967).
Несовершенство доступных на тот момент химических методов получения олигонуклеотидов не позволило автору и ее последователям в полной мере реализовать эту революционную идею. Но как только достижения химии нуклеиновых кислот превратили олигонуклеотидный синтез из сочетания высокого искусства и каторжного труда в ремесло, доступное, по сути, квалифицированным лаборантам, прогресс в области ДНК- и РНК-технологий начал развиваться семимильными шагами.
Старт антисмысловых технологий
По прошествии чуть более десятка лет со дня публикации статьи Н. И. Гриневой американский ученый чешского происхождения П. Замечник впервые показал, что синтетический олигонуклеотид, нацеленный на комплементарное связывание с определенным участком вирусной РНК, способен подавлять развитие вируса в живых клетках (Zamecnik & Stephenson, 1978). Именно с этого момента принято отсчитывать возникновение антисмысловой технологии – способа направленного воздействия на процесс трансляции генетической информации, другими словами, на осмысленный перевод с нуклеотидного языка матрицы РНК на язык аминокислот, который происходит в клетке при биосинтезе белковых молекул.

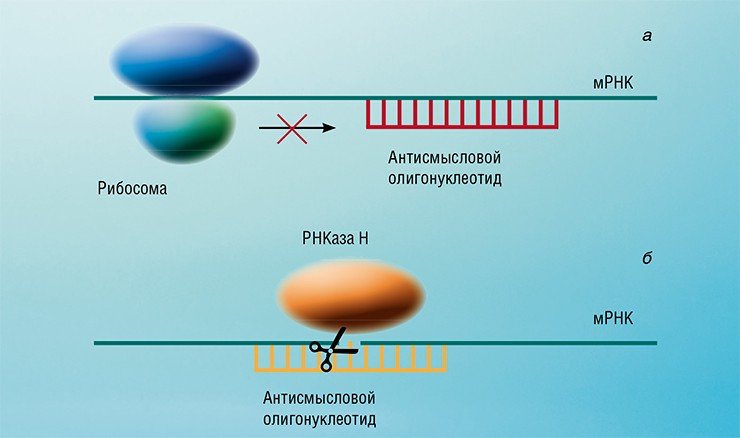
При этом следует различать два возможных механизма реализации антисмыслового действия олигонуклеотида. Один из них основан на создании физического препятствия рибосоме в процессе биосинтеза белка за счет образования прочного комплекса антисмыслового олигонуклеотида с комплементарным участком матричной РНК. Рибосома не может преодолеть двухцепочечный участок и продолжить наращивание аминокислотной цепи аминокислот до полноразмерного белка, но матричная РНК при этом остается неповрежденной. В случае другого механизма в месте образования комплементарного комплекса матричной РНК с антисмысловым олигонуклеотидом молекула РНК может начать необратимо разрушаться под действием клеточного фермента РНКазы Н. Этот механизм предъявляет жесткие требования к структуре антисмыслового олигонуклеотида, которая должна максимально соответствовать структуре природной одноцепочечной молекулы ДНК.
К началу лихих для России 1990-х антисмысловая технология была осознана на Западе как новый терапевтический принцип (Uhlmann & Peyman, 1990). Быстро выяснилось, что природные олигонуклеотиды малопригодны для использования в качестве лекарственных препаратов. При введении в организм они быстро разрушались ферментами-нуклеазами, присутствующими в сыворотке крови. Однако к этому времени были уже доступны химически модифицированные аналоги нуклеиновых кислот, в которых место природной фосфатной группы заняли ее искусственные заменители – так называемые изостеры. В этих соединениях один из атомов кислорода при атоме фосфора, не участвующий в образовании межнуклеотидного мостика, заменяется другим атомом или группой. Такая замена в большинстве случаев влечет за собой значительное возрастание устойчивости олигонуклеотида к действию ферментов, легко расщепляющих природные фосфатные группы.
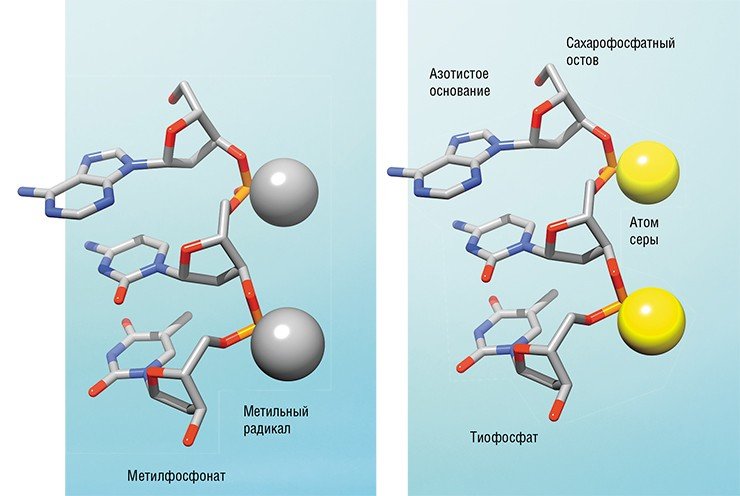
Первыми аналогами ДНК с модифицированной фосфатной группой стали метилфосфонаты, содержащие метильный радикал –СН3, и тиофосфаты с атомом серы. При этом замещение всех фосфатных групп метильными радикалами превращало метилфосфонаты в электронейтральные соединения, в то время как тиофосфаты сохраняли отрицательный заряд.
Как следствие, основное различие между этими аналогами ДНК заключалось в том, что первые могли работать только по принципу физического блокирования рибосомы, а вторые успешно активировали РНКазу Н с сопутствующим разрушением матричной РНК. Возможно, именно этот факт отчасти повлиял на дальнейшую судьбу этих соединений: метилфосфонаты к настоящему времени практически сошли со сцены, а тиофосфаты составляют три четверти всех допущенных в практику лекарственных препаратов на основе нуклеиновых кислот.
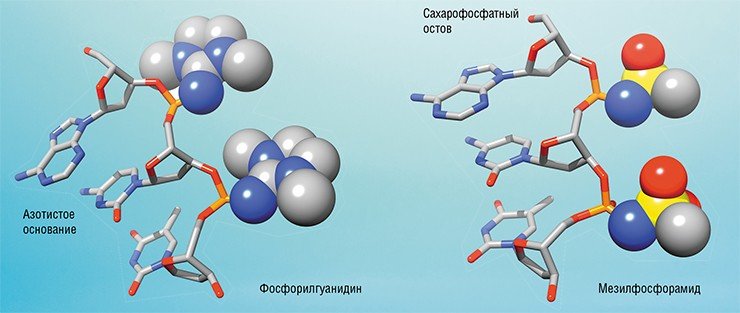
«Секрет» получения фосфорилгуанидинов заключается в замене одной из стадий химического синтеза обычных олигонуклеотидов другой химической реакцией, а именно реакцией Штаудингера, названной в честь ее первооткрывателя – швейцарского химика Г. Штаудингера (Staudinger & Meyer, 1919). Начиная с 1970-х гг. реакция Штаудингера эпизодически использовалась для получения производных нуклеотидов и нуклеиновых кислот. Однако в полном смысле слова огромный потенциал этой реакции для получения самых разнообразных аналогов ДНК и РНК с модифицированной фосфатной группой был распознан лишь недавно. Фосфорилгуанидиновые олигонуклеотиды явились первым типом электронейтральных аналогов нуклеиновых кислот, которые стали получать с использованием реакции Штаудингера, протекающей в автоматическом синтезаторе ДНКБурное развитие антисмысловой технологии на Западе с начала 1990-х, последующее открытие американскими учеными РНК-интерференции, а за ним и геномного редактирования поставили отечественных ученых в положение постоянно догоняющих. Несмотря на богатые традиции в области химии нуклеиновых кислот, ранее достигнутые результаты и наличие научных и образовательных центров с мощным потенциалом, нашим исследователям, за редким исключением, не удавалось внести существенный вклад в создание новых антисмысловых аналогов ДНК или РНК, способных успешно конкурировать с иностранными разработками.
«Первой ласточкой», изменившей ситуацию, стало открытие в 2012 г. фосфорилгуанидиновых олигонуклеотидов (ФГО) исследователями из новосибирского Института химической биологии и фундаментальной медицины СО РАН (Стеценко, Пышный, 2014). Фосфорилгуанидины явились, по сути, первым технологически конкурентоспособным продуктом отечественной химии нуклеиновых кислот за последние десятилетия.
Так как фосфорилгуанидиновая группа не несет электрического заряда, можно сказать, что ФГО в известном смысле заняли «экологическую нишу» метилфосфонатов. Однако, в отличие от последних, фосфорилгуанидины могут быть получены из относительно недорогих и коммерчески доступных исходных материалов с использованием высокоэффективных методов химического синтеза (Stetsenko et al., 2014). Они также отличаются высокой химической устойчивостью, а фосфорилгуанидиновая группа не препятствует комплементарному связыванию с РНК-мишенью.
При угрозе жизни
С момента своего открытия фосфорилгуанидины успели зарекомендовать себя как перспективные антисмысловые агенты, действующие по механизму физического блокирования синтеза белка, в частности как потенциальные лекарственные препараты для коррекции тяжелого генетического заболевания – мышечной дистрофии Дюшена. Это заболевание выражается в прогрессирующей дегенерации скелетных мышц, вызванной прекращением биосинтеза белка дистрофина.
По классификации Всемирной организации здравоохранения (ВОЗ), эта болезнь относится к числу редких, хотя она является наиболее распространенным генетическим нарушением, диагностируемым в детстве. Симптомы прогрессирующей дегенерации мышц начинают проявляться уже в возрасте 5—6 лет, а к 10 годам ребенок может передвигаться только в инвалидном кресле. Средняя продолжительность жизни больных мышечной дистрофией Дюшена составляет 25—30 лет.
Причина болезни – мутации в гене дистрофина, из которых две трети возникают спонтанно, и лишь одна треть является унаследованной. Это означает, что с определенной долей вероятности болезнь может прийти в любую семью.
Уже более десяти лет назад стало ясно, что разрушительное влияние генной мутации при мышечной дистрофии Дюшена можно отчасти компенсировать путем направленного воздействия на важную стадию процесса получения «зрелой» матричной РНК, называемую сплайсингом. Антисмысловые олигонуклеотиды, способные вызывать временную физическую блокаду определенного участка молекулы РНК без ее разрушения, рассматриваются в качестве наиболее перспективных средств коррекции сплайсинга.
Считается, что подобная терапия могла бы облегчить состояние примерно 80 % всех больных. В сентябре 2016 г. на фармацевтический рынок США уже поступил первый терапевтический препарат для лечения мышечной дистрофии Дюшена на основе аналога олигонуклеотида – Eteplirsen (Exondys 51). Результаты, полученные исследователями из ИХБФМ СО РАН в сотрудничестве с британскими коллегами из Оксфордского университета, показали, что активность ФГО в экспериментах на лабораторных мышах превосходит активность зарубежного аналога, соответствующего по химической структуре препарату Eteplirsen.
Фосфорилгуанидиновые олигонуклеотиды продемонстрировали также мощное противовирусное действие в лабораторных экспериментах на культуре клеток, инфицированных высокопатогенным вирусом «птичьего гриппа» подтипа H5N 1.
Поскольку стоимость подобной противовирусной терапии будет существенно выше, чем в случае лекарственных препаратов на основе малых молекул, таких как Тамифлю, применение антисмысловых олигонуклеотидов будет наиболее оправдано в случаях, когда имеется непосредственная угроза жизни больного. Американская компания Sarepta Therapeutics ведет разработку терапевтических олигонуклеотидов для лечения таких смертельно опасных вирусных заболеваний, как геморрагические лихорадки Эбола и Марбург, а финансирует ее Министерство обороны США. Препараты под кодовыми наименованиями AVI‑7537 и AVI‑7288 уже показали свою эффективность в лабораторных опытах на животных и сейчас проходят клинические испытания.
Но в фармацевтическом бизнесе, как и на всяком рынке, где вращаются большие деньги, не обходится без казусов. Так, в 2014 г. в США при лечении врача, заболевшего геморрагической лихорадкой Эбола во время эпидемии в Западной Африке, в составе комбинированной терапии был использован экспериментальный олигонуклеотидный препарат TKM-Ebola, не прошедший на тот момент клинических испытаний. Пациента удалось вылечить, но какую роль в этом сыграл терапевтический олигонуклеотид, осталось неизвестным. Тем не менее благодаря такой «рекламе» стоимость акций разработчика препарата канадской компании Tekmira Pharmaceuticals подскочила сразу на четверть. Однако уже в следующем году компания прекратила дальнейшие клинические испытания лекарства, признав его недостаточную эффективность. Сейчас эта фирма, сменившая название на Arbutus BioPharma, разрабатывает терапевтический олигонуклеотид против гепатита Б.
Устойчивость к антибиотикам – новый вызов человечеству
Борьба со смертельно опасными инфекциями, как вирусными, так и бактериальными, сегодня рассматривается в качестве одного из основных направлений применения терапевтических олигонуклеотидов. В ряду подобных болезней особо выделяются инфекции, вызываемые лекарственно-устойчивыми штаммами патогенных микроорганизмов, таких как малярийный плазмодий, туберкулезная палочка или золотистый стафилококк. Глобальное распространение бактериальных инфекций, характеризующихся устойчивостью сразу к нескольким антибиотикам, уже давно вызывает тревогу у экспертов ВОЗ, которые рассматривают их как одну из серьезнейших угроз для здоровья человека. По мнению экспертов, задача борьбы с глобальным распространением этих инфекций представляет собой вызов всему человечеству и потому не может быть успешно решена в рамках одного государства. Однако в России, в отличие от ведущих зарубежных стран, этой теме все еще уделяется недостаточно внимания.
Бактерии, вирусы, грибки и другие микроорганизмы теряют восприимчивость к традиционным антимикробным препаратам из-за генетических мутаций, которые затем закрепляются в их потомстве. Возникновение все новых механизмов лекарственной резистентности и широкое распространение по планете таких устойчивых штаммов ставит под угрозу саму способность врачей лечить обычные инфекционные заболевания, удлиняя сроки выздоровления и увеличивая вероятность инвалидизации и смертельного исхода, а также риск распространения инфекции среди здоровых людей.
Без эффективных противомикробных препаратов такие медицинские процедуры, как трансплантация органов, химиотерапия онкологических заболеваний, лечение диабета или любая серьезная хирургическая операция (например, кесарево сечение или удаление аппендикса), становятся рискованными. Расходы на лечение пациентов при этом резко возрастают, а само лечение занимает больше времени, что приводит к значительному удорожанию медицинских услуг.
В феврале 2017 г. ВОЗ впервые опубликовала список из 12 видов бактериальных патогенов, устойчивых к действию антибиотиков, разработка методов борьбы с которыми была признана высокоприоритетной. В этом списке к первой группе («критический уровень приоритетности») относятся бактерии со множественной лекарственной устойчивостью, представляющие особенно серьезную опасность для пациентов больниц и лечебно-реабилитационных центров, в особенности тех пациентов, для лечения которых требуются медицинские устройства, такие как аппараты искусственной вентиляции легких и венозные катетеры. У бактерий этой группы успела сформироваться устойчивость к действию широкого ряда антибиотиков, включая карбапенемы и цефалоспорины третьего поколения, которые на сегодняшний день относятся к наиболее эффективным препаратам для лечения инфекций со множественной лекарственной устойчивостьюОсобенно остро сейчас стоит проблема вспышек внутрибольничных инфекций, таких как пневмония, заражение крови (сепсис), инфекции у новорожденных и больных в отделениях реанимации. Их возбудителями очень часто являются устойчивые к антибиотикам штаммы бактерий. Так, в сентябре 2016 г. в больнице американского штата Невада врачи не смогли спасти жизнь пожилой пациентке с бактериальной инфекцией, которая оказалась нечувствительной ко всем 26 видам антибиотиков, назначаемых в США. Положение усугубляется тем, что за прошедшие 30 лет не было открыто ни одного нового класса антибиотиков. Некоторые эксперты уже предрекают, что человечество стоит на пороге возвращения в мрачные времена «доантибиотиковой» эры, когда простой порез на пальце мог стать причиной смерти, как это случилось с героем романа И. Тургенева «Отцы и дети».
Антисмысловые олигонуклеотиды, способные избирательно подавлять экспрессию отдельно взятых генов, рассматриваются как перспективные инструменты для преодоления резистентности болезнетворных микроорганизмов. Их действие может быть нацелено на подавление экспрессии тех генов, которые жизненно необходимы для роста и размножения бактерий либо непосредственно отвечают за лекарственную устойчивость. В последнем случае задача антисмысловой технологии заключается в восстановлении чувствительности микроорганизмов к антибиотикам, что представляется наиболее актуальным при разработке новых способов борьбы с устойчивыми штаммами возбудителей бактериальных инфекций.
Фосфорилгуанидиновые олигонуклеотиды, полученные в ИХБФМ СО РАН, сейчас исследуются в качестве потенциальных антибактериальных средств против нескольких мишеней, в частности возбудителя туберкулеза. Недавно специалистам лаборатории химии нуклеиновых кислот института с помощью все той же реакции Штаудингера удалось создать еще один вид аналогов ДНК. Новые аналоги олигонуклеотидов, названные мезилфосфорамидами, по своей структуре ближе к природной одноцепочечной молекуле ДНК, чем к ФГО. Главное их отличие состоит в сохранении суммарного отрицательного заряда, что позволяет им успешно активировать действие РНКазы Н в месте образования комплементарного комплекса с целевой ДНК. Это достоинство наряду с относительно простым способом получения открывает перспективы использования мезилфосфорамидных олигонуклеотидов как антисмысловых агентов. И этот прогноз уже получил первое подтверждение в экспериментах на клеточных культурах.
Нет сомнения, что российская наука вообще и медицинская химия в частности призваны сыграть одну из ведущих ролей в разработке передовых технологий противодействия распространению инфекционных заболеваний. Не будет преувеличением предсказать, что получение новосибирскими химиками новых аналогов олигонуклеотидов станет решительным шагом на пути создания эффективных средств борьбы не только с редкими генетическими заболеваниями, но и с более социально значимыми вирусными и бактериальными инфекциями. И не только с уже существующими, но и теми, с которыми человечество может столкнуться в будущем.
Задача овладения передовыми медицинскими технологиями может оказаться сегодня не менее стратегически важной для государства, чем в свое время овладение атомным оружием. Россия может и должна обладать собственными средствами реагирования на глобальные вызовы, угрожающие безопасности страны. Хочется верить, что она вновь сможет сделать это сама, как РДС‑1 семь десятилетий назад.
Литература
Власов В. В. Лекарство для генов // НАУКА из первых рук. 2007. Т. 14. № 2. С. 56—59.
Стеценко Д. А., Пышный Д. В. Ex Siberia semper novi – из Сибири всегда новое. Фосфорилгуанидины – новые химические аналоги нуклеиновых кислот. //Наука из первых рук. 2014. Т. 59. № 5. С. 7—9.
Belikova A. M., Zarytova V. F., Grineva N. I. Synthesis of ribonucleosides and diribonucleoside phosphates containing 2-chloroethylamine and nitrogen mustard residues. // Tetrahedron Lett. 1967. V. 8. N. 37. P. 3557—3562.
Stetsenko D., Kupryshkin M., Pyshnyi D. Modified oligonucleotides and methods for their synthesis, patent application WO2016/028187A1 from August 22, 2014.
Uhlmann E., Peyman A. Antisense oligonucleotides: a new therapeutic principle // Chem. Rev. 1990. V. 90. N. 4. P. 543—584.
Zamecnik P.C., Stephenson M.L. Inhibition of Rous sarcoma virus replication and cell transformation by a specific oligodeoxynucleotide // Proc. Natl. Acad. Sci. USA. 1978. V. 75. N. 1. P. 280—284.
Визуализация химических структур выполнена в лаборатории структурной биоинформатики и молекулярного моделирования НГУ. Авторы и редакция благодарят заведующую лабораторией, к. б. н. А. Ю. Бакулину за помощь в подготовке иллюстраций







