Кошки и гены: 40 лет спустя
На Земле живет полмиллиарда домашних кошек. Они ловят мышей, украшают жизнь своим хозяевам, воюют с собаками и голубями и служат … замечательным объектом для генетических исследований. В этой статье специалисты-генетики рассказывают о современных взглядах на устройство, функционирование и эволюцию кошачьего генома и обсуждают перспективы развития генетики кошки на ближайшие десять лет
П. М. Бородин: краткое содержание предыдущих серий
Ровно 40 лет назад я опубликовал в журнале «Химия и жизнь» первую статью про генетику кошек. В ней я убеждал читателя, что всю прелесть генетики и ее законов можно увидеть не на горохе, не на дрозофиле, а именно на кошке.
В то время генетика кошки сводилась в основном к описанию красочных фенотипов и их наследования. В принципе, этого было достаточно для выведения и поддержания пород и проведения геногеографических исследований. Позже выяснилось, что некоторые тогдашние гипотезы о наследовании даже простых и очевидных признаков окраски были, мягко говоря, неверными. Путь от гена до признака в большинстве случаев был либо неизвестен вовсе, либо был в общих чертах установлен на мыши и без особого стеснения приписан кошке. Мы тогда знали, что геном кошки содержит ДНК, но на этом наши представления о ее молекулярной генетике и заканчивались. Сорок лет назад было ясно, что кошка приходится родственником льву и тигру, но детали этого родства терялись в тумане времени.
В 1989 г. в той же «Химии и жизни» вышла моя статья под названием «Кошки и гены: десять лет спустя». Из нее читатели узнали, как выглядят под микроскопом кошачьи хромосомы, поняли, как были построены первые генетические карты этого зверя, и убедились в их поразительном сходстве с картами хромосом человека. В конце статьи я пообещал написать продолжение под названием «Кошки и гены: 20 лет спустя». Но обещания не выполнил.
Зато написал книжку, где собрал все достижения кошачьей генетики ХХ в. Она вышла в 1995 г. и с тех пор переиздавалась несчетное количество раз, в том числе и в серии «Шедевры (sic!) научно-популярной литературы». Эта книжка попала в лонг-лист премии «Просветитель» и получила специальный диплом Клуба научных журналистов с правильной формулировкой «За эффектное применение кошек для популяризации науки».
 В 2009 г. в журнале «НАУКА из первых рук» вышла моя статья «Кошки и гены: 30 лет спустя». В нулевые годы кошачья генетика переживала бум. Был секвенирован и частично аннотирован кошачий геном, получены первые клонированные и трансгенные кошки. Использование методов сравнительной геномики позволило реконструировать основные этапы эволюции млекопитающих вообще и кошачьих в частности. Выяснилось, что последний общий предок кошки, лошади и летучей мыши жил на свете относительно недавно (около 79 млн лет назад). Обо всем этом я и написал в своей статье. Рунет подхватил и широко разнес новость про общего предка, честно на меня ссылаясь: «У кошки и у лошади – общий предок, – Павел Бородин». Так я стал общим предком кошки и лошади.
В 2009 г. в журнале «НАУКА из первых рук» вышла моя статья «Кошки и гены: 30 лет спустя». В нулевые годы кошачья генетика переживала бум. Был секвенирован и частично аннотирован кошачий геном, получены первые клонированные и трансгенные кошки. Использование методов сравнительной геномики позволило реконструировать основные этапы эволюции млекопитающих вообще и кошачьих в частности. Выяснилось, что последний общий предок кошки, лошади и летучей мыши жил на свете относительно недавно (около 79 млн лет назад). Обо всем этом я и написал в своей статье. Рунет подхватил и широко разнес новость про общего предка, честно на меня ссылаясь: «У кошки и у лошади – общий предок, – Павел Бородин». Так я стал общим предком кошки и лошади.
С тех пор прошло еще 10 лет. Пришла пора писать «Кошки и гены: 40 лет спустя», что мы и сделали вместе с Любовью Малиновской. Вскоре после появления Любы в нашей лаборатории я попросил ее помочь с подготовкой очередного издания «Кошек и генов». Она это сделала с блеском. Собрала все новые публикации по генетике кошки, исправила все ошибки и опечатки, которые годами переходили из издания в издание. Вскоре она купила себе сначала кота, потом кошку, а позже прошла курсы молодого фелинолога и зарегистрировала собственный котопитомник. Я глубоко убежден, что именно работа с моей книжкой открыла ей скромное обаяние котов и котоведения, хотя она это категорически отрицает. Пусть это остается на ее совести.
Важно, что эту статью мы написали вместе. Это служит залогом, что традиция не прервется, и читатель и пятьдесят, и сто лет спустя каждое десятилетие будет получать очередную статью про кошек и их гены.
Как устроен кошачий геном
«Классические» гены всех эукариот (высших организмов с оформленным клеточным ядром, к которым относятся не только кошки и человек, но и все многоклеточные и множество одноклеточных организмов) устроены примерно одинаково. И функция у них одна – производить определенный белок, структура которого закодирована в гене: каждой аминокислоте будущего белка соответствует своя тройка нуклеотидов.
Но сам процесс считывания и реализации генетической информации непрост. В начале каждого гена стоят разнообразные регуляторы (включатели-выключатели) активности, которыми «щелкают» особые белки – транскрипционные факторы. Если ген «включился», то запускается процесс транскрипции – на ДНК гена собирается комплементарная молекула другой нуклеиновой кислоты, РНК. Затем эта молекула РНК «созревает» в процессе сплайсинга, во время которого она разрезается на фрагменты и вновь сшивается, превращаясь в матричную РНК. Ее назвали так потому, что именно эта молекула служит матрицей, по которой на «фабрике»-рибосоме собирается будущий белок (трансляция).
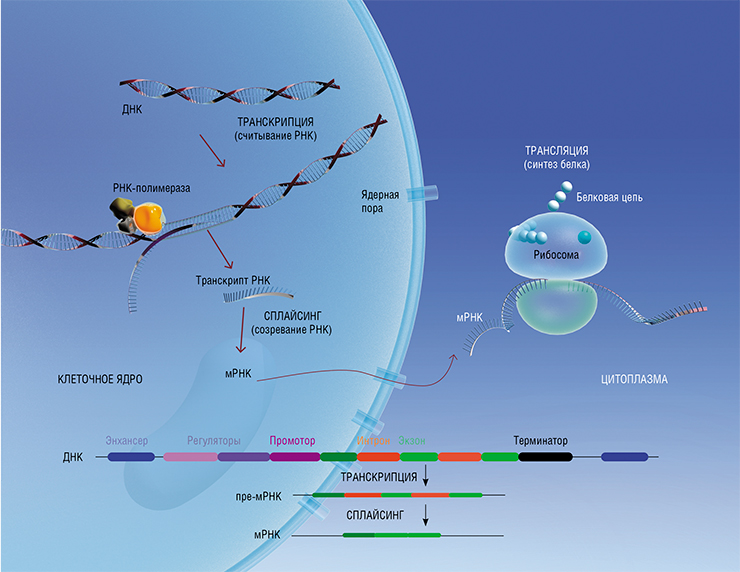
Все три процесса – транскрипция, сплайсинг и трансляция – регулируются сложными взаимодействиями ДНК, белков и РНК, которые зависят от типа клеток, стадии клеточного цикла и периода развития организма.
Например, при сплайсинге одни фрагменты РНК (экзоны) сшиваются, а другие (интроны) выбрасываются. Эти последние могут просто деградировать, но могут и использоваться для разных целей, в том числе для регуляции той же транскрипции.
Особую роль в тонкой (громче – тише) «настройке» активности генов играют загадочные регуляторные участки ДНК – энхансеры. Эти короткие (50–1500 нуклеотидов) последовательности могут располагаться как рядом, так и очень далеко от гена, работу которого они модулируют. Как именно энхансеры действуют, до сих пор неясно. Прелесть их в том, что они тканеспецифичные, т. е. каждый энхансер работает только в определенном месте организма и в определенный момент времени.
На сегодняшний день известно, что геном кошки содержит 19587 генов, кодирующих белки. А также 9438 некодирующих, которые отвечают за производство «некодирующих» РНК, включая транспортные и рибосомные, а также множества разнообразных регуляторных РНК. О работе последних у кошек, к сожалению, практически ничего неизвестно.
Кроме того, в геноме кошки находится 494 псевдогена – нефункциональных генных останков, «сломанных» мутациями. Псевдогены могут выглядеть как нормальные гены, но их выдает отсутствие интронов и промоторов – стартовых площадок транскрипции. К этой же потенциально «мусорной» группе и относятся следы деятельности геномных паразитов – ретровирусов (семейство РНК-содержащих вирусов, заражающих преимущественно позвоночных). Сами ретровирусы и их обломки (ретроэлементы) составляют примерно треть кошачьего генома. Это много, но все же меньше, чем у человека, у которого они занимают до половины всего генома.
Чем холоднее, тем ярче
 Мутации бывают разные. Наиболее часты точечные мутации – замена одного нуклеотида на другой или утрата либо вставка одного нуклеотида. Как правило, эти мутации возникают из-за ошибок в процессе удвоения (репликации) ДНК или при «исправлении» (репарации) этих и других ошибок. Примерно две трети таких мутаций приводят к изменению состава белка, кодируемого данным геном. К этому типу относятся почти все мутации, выявленные у кошек. Рассмотрим их на примере альбинизма, полного или частичного отсутствия пигментов меланинов.
Мутации бывают разные. Наиболее часты точечные мутации – замена одного нуклеотида на другой или утрата либо вставка одного нуклеотида. Как правило, эти мутации возникают из-за ошибок в процессе удвоения (репликации) ДНК или при «исправлении» (репарации) этих и других ошибок. Примерно две трети таких мутаций приводят к изменению состава белка, кодируемого данным геном. К этому типу относятся почти все мутации, выявленные у кошек. Рассмотрим их на примере альбинизма, полного или частичного отсутствия пигментов меланинов.
Окраска меха у кошек, как и у всех остальных млекопитающих, определяется наличием и распределением в волосе двух пигментов: черного (эумеланина) и желтого (феомеланина). Оба пигмента синтезируются из аминокислоты тирозина, а ключевым ферментом синтеза является белок тирозиназа. Этот фермент кодируется геном C (Color). Мутации в этом гене либо вовсе лишают кошку пигментов, либо в той или иной мере нарушают их синтез.
Есть две точечные мутации в гене С (cb и cs), вызванные заменой одного нуклеотида на другой, которые приводят к синтезу тирозиназы со смещенным температурным оптимумом. Мутантный фермент плохо работает при нормальной температуре тела, чуть лучше – при пониженной. А вот утрата одного нуклеотида (мутации c и с2) ведет к образованию так называемого стоп-кодона – сигнала о прекращении транскрипции. В результате образуется укороченная мутантная мРНК, на которой синтезируется совсем уже «нерабочий» фермент.
Свои гены кошки, как и люди, наследуют от двух родителей, поэтому каждый ген представлен в геноме как минимум в двух экземплярах. Если любая из названных выше мутаций будет унаследована только от одного из родителей (такие особи называются гетерозиготами), то у кошки будет нормальный окрас. Одного «правильного» гена будет достаточно, чтобы обеспечивать клетки нужным количеством меланина. Но что будет в случае гомозиготы – когда кошка получит мутацию от обоих родителей?
В случае мутации c или с2 кошка вырастет совершенно белой и с голубыми глазами, потому что нормальная тирозиназа у нее полностью отсутствует. Гомозиготы по мутации cb получат бирманскую окраску, а по мутации cs – сиамскую. У сиамских ярко окрашенными будут только уши, нос, лапы и кончик хвоста – участки тела, где температура снижена. У кошек с бирманской окраской будут окрашены не только эти части, но и само тело, хотя и менее ярко, чем в норме. Из этого мы заключаем, что температурный оптимум тирозиназы у бирманцев несколько выше, чем у сиамцев.

А теперь, внимание, вопрос: какой будет окрас у кошки, которая получила от одного родителя мутацию cs, а от другого с? Правильно, бирманский. А у гетерозиготы cs/cb? Тонкинский окрас – что-то среднее между сиамским и бирманским. Отсюда мы получаем простое и понятное объяснение явлению доминирования признаков. Доминантным оказывается тот признак, для проявления которого достаточно, чтобы активным был один ген из пары.
Почему сфинксы лысые, а рексы – курчавые
Помимо точечных, у кошек встречаются мутации, вызванные удалением (делеции), удвоением (дупликации) или вставкой (инсерции) уже не отдельных нуклеотидов, а целых фрагментов ДНК. Эти мутации часто возникают за счет сбоев в процессе обмена участками хромосом (кроссинговера), который происходит во время формирования половых клеток.
Несколько мутаций этого типа обнаружены у кошек в генах, которые отвечают за синтез и «созревание» кератинов – сложных и прочных фибриллярных белков, входящих в состав волоса. Нарушения в их структуре приводят к безволосости (у сфинксов) или курчавости волос (у разных вариантов рексов).


У девон-рексов курчавость вызывается сложной мутацией в гене KRT71 (Gandolfi et al., 2010). Она включает в себя утрату фрагментов ДНК в двух интронах и две вставки в один из экзонов. В результате вставки дополнительных амикислот структура кератина меняется, что снижает его прочность. Изменения в интронах, казалось бы, не должны влиять на структуру белкового продукта гена, так как в ходе созревания мРНК они вырезаются. Однако такие мутации могут менять активность гена, влияя на процесс сплайсинга и/или стабильность РНК, считанной с гена.
У того же гена KRT71 есть и точечная мутация – замена азотистого основания гуанин на аденин, что ведет к появлению стоп-кодона. В результате синтезируется укороченная молекула кератина, что через сложные взаимодействия с другими белками полностью лишает шерсти гомозиготных носителей мутации – канадских сфинксов. Удивительно, что многоходовая мутация девон-рексов «всего лишь» сворачивает их шерсть в колечки, а замена одной единственной «буквы» на другую полностью лишает сфинксов шерстяного покрова.
Структура кератина может измениться за счет мутаций не только в самом гене кератина, но и в генах, отвечающих за процесс «созревания» этого белка. Так, своей курчавостью селкирк-рексы обязаны мутации в гене SADRE (Selkirk Autosomal Dominant Rex), которая приводит к утрате пяти аминокислот у кератинового белка – продукта гена KRT71 (Gandolfi et al., 2013).
Здесь был ретровирус
У кошки, как и у многих других животных, есть мутации, обусловленные внедрением в ген ретровируса. И приводят они к появлению на теле белых пятен.
Вообще размер белых пятен на теле кошек варьирует в широких пределах: от белых носочков до того, когда вся кошка становится одним сплошным «белым пятном». Долгое время думали, что последний фенотип определяется доминантной белой мутацией W (White). Пятна же всех остальных размеров считали проявлением полудоминантных мутаций в другом гене – S (Spotting). Однако в 2014 г. выяснилось, что все варианты белой пятнистости обусловлены разными мутациями в одном и том же гене W (White spotting) (David et al., 2014).

Белковый продукт нормального гена W обеспечивает миграцию различных эмбриональных клеток, производных нервной трубки, к местам их назначения. Среди этих клеток есть и меланоциты, которые вырабатывают пигменты, окрашивающие шерсть и радужку глаза. Мутации в гене W нарушают миграцию и деление предшественников этих клеток, но в разной степени. Особая прелесть этих мутаций в том, что они возникали одна за другой, и одна из другой в результате внедрения ретровируса.
Все началось около 3 млн лет назад, когда между двумя интронами гена W вставился ретровирус размером более 7 тыс. нуклеотидов. Это привело к частичной поломке гена – возникла мутация ws. Клетки, содержащие дефектный белок, мигрируют к местам назначения медленнее нормальных. Поэтому те участки кожи, куда они не успевают прибыть вовремя, остаются белыми. У гетерозигот задержка незначительная и пятно совсем маленькое, у гомозигот – побольше.

Затем в ходе эволюции «поломался» сам ретроэлемент – от него остался лишь один небольшой фрагмент размером около 700 нуклеотидов. Так возникла доминантная белая мутация W. Но носителям такого урезанного ретроэлемента легче не стало. Наоборот. Новая мутация в отличие от предыдущей не просто тормозит миграцию и разрастание производных нервной трубки, а практически полностью их блокирует.
У многих млекопитающих известно множество мутаций белой пятнистости. Примечательно, что многие из них вызваны мутациями в генах, соответствующих гену W кошки. И почти во всех случаях, когда был проведен молекулярный анализ, оказывалось, что эти мутации также вызваны внедрением ретровирусов. При этом каждый вид нес свой ретровирус. Что их туда так влечет – кто знает?
Уши, лапы и хвост – вот мои документы!
До сих пор мы рассматривали влияние генов на формирование окраски и структуры шерсти и усов. Пути от генов к этим признакам достаточно короткие и прямые.
А как гены контролируют развитие сложных морфологических признаков – ушей, лап, хвоста, рисунка шерсти? Здесь пути гораздо более сложные, извилистые и интересные, и контролируются они множеством согласованно работающих генов. Согласование обеспечивают транскрипционные факторы, которые синтезируются в нужное время и связываются в нужном месте с регуляторными областями разных генов, запуская длинные каскады молекулярных взаимодействий. Мутации, которые изменяют развитие этих морфологических признаков, обычно находятся в генах, кодирующих именно эти транскрипционные факторы.
Начнем с хвоста. В свое время ослик Иа-Иа горько сетовал на то, что мало кто «понимает в хвостах. У них нет воображения. Для них хвост – это не хвост, а просто добавочная порция спины». На самом деле эти «они», по сути, были правы. Хвостовые и спинные позвонки возникают из хорды эмбриона, и их образование контролируется одним и тем же набором генов.

Ведущую роль во всех этих процессах играет ген Brachyury. Он контролирует синтез транскрипционного фактора, который связывается с регуляторными областями многих генов, вовлеченных в развитие спины, включая шею и хвост. Этот белок начинает синтезироваться на самых ранних стадиях развития эмбриона, определяя ориентацию осей голова-хвост и спина-живот. И мутации гена приводят к довольно серьезным последствиям.
У бесхвостых кошек острова Мэн и их американских родственников нашли четыре разных мутации в гене Brachyury: три точечные замены и одну дупликацию, совмещенную с делецией (Buckingham et al., 2013). Каждая из них ведет к синтезу укороченного белка. У гетерозигот хватает «правильного» белка, чтобы обеспечить нормальное развитие эмбриона, но не его хвоста. Зато гомозиготы гибнут на ранних стадиях беременности, так как работа всей сети генов, зависимых от белка Brachyury, идет вразнос.

Своим хвостом-помпоном японский бобтейл обязан мутации в гене HES 7, который играет важную роль в формировании сегментов тела у позвоночных (Xu et al., 2016). Этот ген способен к саморегуляции: белок, который он кодирует, подавляет активность самого гена HES 7. Когда через некоторое время белок разрушается, его синтез возобновляется. Благодаря такой цикличности и происходит сегментация тела эмбриона, в том числе формирование цепочки позвонков.
У японского бобтейла в этом гене имеется точечная мутация, которая дестабилизирует белок HES 7. Мутантный белок разрушается быстрее, длительность цикла сокращается, и сегменты оказываются очень короткими. Некоторые не успевают сформироваться вовсе или сливаются друг с другом. У обычного кота хвост состоит примерно из 22 позвонков, у бобтейлов – из 14–21. Длина хвоста может варьировать, и у гомозигот он самый короткий.
Как леопард получил свои пятна?
Мы подозреваем, хотя и не можем это доказать, что такой же механизм циклической активации-инактивации генов участвует и в формировании периодически повторяющихся узоров (полос, розеток и разводов) на теле кошек, которые объединяются термином «tabby»*. Гены, которые контролируют тот или иной вариант рисунка, хорошо известны. Неизвестно только, как они это делают.


Два наиболее распространенных рисунка – тигровый (mackerel) и мраморный (blotched). Тигровый окрас унаследован домашней кошкой от предков – большинство ее современных диких сородичей имеют тот же рисунок. Контролируется он геном Ta (Tabby), который кодирует трансмембранную аминопептидазу Q (Kaelin et al., 2012). Этот фермент вовлечен в контроль диффузии различных веществ в межклеточном пространстве. Известно три разных мутации, нарушающие структуру этого белка, которые у гомозигот ведут к одному результату – развитию мраморной окраски.
Мы знаем, что в темных участках шерсти преобладает черный пигмент, а в светлых – желтый. Соотношение этих пигментов в волосе зависит от совместного действия двух пар генов: А (Agouti) и E (Extension) с одной стороны, и Edn3 и Ednrb с другой. Нам также известно, что основа рисунка на теле эмбриона устанавливается за 1–2 недели до рождения. Но мы не знаем, как это происходит. Почему одни группы клеток предназначены для производства темных волос, а другие – светлых? Как и почему изменения последовательности аминокислот в трансмембранной аминопептидазе Q приводят к изменению взаимного расположения этих клеток?

Очень может быть, что в формировании рисунка участвует механизм циклической активации-инактивации генов. Почти 70 лет назад великий математик Алан Тьюринг пытался ответить на вопрос, заданный еще раньше великим поэтом Редьярдом Киплингом: «Как леопард получил свои пятна?». Тьюринг предложил простую реакционно-диффузную модель, в рамках которой полосы и пятна образуются автоматически, если цвет каждой клетки зависит от взаимодействия двух диффундирующих активных веществ – активатора и ингибитора. Можно (и хочется) думать, что в развитии кошачьего эмбриона есть момент, когда трансмембранная аминопептидаза Q регулирует диффузию и распределение по клеткам подобных соединений, регулирующих процесс производства пигмента.
Взаимодействие активаторов и ингибиторов с тканями-мишенями направляет и развитие кошачьих лап. Порядок будущих пальцев (от большого пальца до мизинца) на конечности зависит от гена SHH (Sonic Hedgehog), кодирующего транскрипционный фактор. Последний участвует в развитии не только конечностей, но и легких, зубов, некоторых структур головного и спинного мозга и т. д. Ген SHH настолько важен, что почти любая его мутация приводит к катастрофическим последствиям вплоть до гибели эмбриона.

Очевидно, что в каждой из структур ген SHH работает немного по-разному, продуцируя столько белка, сколько необходимо в данном конкретном месте. В норме он интенсивно работает в районе будущего мизинца. В середине зарождающейся кисти его активность постепенно снижается, а в районе большого пальца ген не работает совсем. Уровень активности SHH контролирует несколько десятков энхансеров. При мутации энхансера ген начинает активно работать в некоторых клетках будущего большого пальца, так что они начинают считать себя отдельной фалангой и формируют шестой палец. Эта аномалия развития – полидактилия, довольно часто наблюдается в некоторых породах кошек (Lettice et al., 2008).
Планы на будущее: дизайнерские коты
Обсудив основные достижения генетики кошек за последнее десятилетие, попробуем заглянуть в будущее и предсказать, о чем будет статья «Кошки и гены: 50 лет спустя».

На сегодняшний день Международная кошачья ассоциация признает 71 породу, Ассоциация любителей кошек – 44, а Международная фелинологическая ассоциация – 43. Это не значит, что можно сложить эти цифры и узнать, сколько существует пород кошек. Это означает лишь то, что котоводы не могут договориться друг с другом. Кроме того, вопрос о том, что считать породой, практически неразрешим, столько в нем намешано генетических, зоотехнических и коммерческих проблем и конфликтов интересов. Просто скажем, что пород довольно много. В большинстве своем они созданы недавно на основе отдельных мутаций или комбинации нескольких мутаций на генетическом фоне старых породных групп.
Сейчас мы вплотную подошли к созданию дизайнерских котов – получению животных с заранее запланированными свойствами. Весь инструментарий у нас уже есть. Мы знаем их геном, умеем их клонировать, создавать трансгенных животных. Наконец, у нас имеется хороший инструмент для редактирования генов: технология CRISPR/Cas9 и ее модификации позволяют вносить изменения в нужные участки генома. Осталось решить вопрос – какие изменения нам нужны?

Нет, давайте начнем с другого конца. Нам точно не нужны изменения, которые принесут страдания «отредактированным» животным. Поэтому никаких карликов, никаких кошачьих мопсов мы делать не будем. Гигантов тоже. Во-первых, потому, что они уже и так есть – посмотрите на мейн-кунов! А главное, потому, что размер тела, как и многие другие количественные признаки, контролируется многими генами, каждый из которых вносит в признак ничтожный вклад. Такие признаки мы вполне успешно меняем отбором. Редактировать же множество генов, их контролирующих, крайне накладно и практически бесполезно.
Поэтому мы должны понять, чего хотим, и точно выбрать мишени. А дальше использовать закон гомологических рядов Н. И. Вавилова – сходные виды имеют сходную изменчивость – и знание геномов кошки и ее родственников. У кошки нужного нам фенотипа нет, зато есть у собаки; ищем собачий ген с нужной мутацией, находим его кошачий гомолог, вносим в него необходимые изменения. Готово.


Итак, мы хотим новых, доселе неведомых у кошек окрасов и форм. Например, котов-шарпеев, или котов-далматинцев, или даже котов-бодибилдеров, вроде бельгийского голубого быка… Заявки принимаются. Нет-нет, это мы пошутили. Мы сами этим заниматься никогда не будем. Мы только обрисовали перспективы редактирования генома кошек. А сейчас вернемся к самым истокам неразрывной связи между кошкой и человеком.
Одомашнивание кошки: где, когда и как
Основные события макроэволюции семейства кошачьих были детально описаны около 20 лет назад. В последнее десятилетие интерес сместился на более близкую историю кошек: историю их одомашнивания и взаимодействия с человеком.

Генетические исследования показали, что все домашние кошки являются потомками одного единственного вида – дикая кошка Felis silvestris (Driscoll et al., 2009). Этот вид широко распространен на территории Старого Света: от Шотландии до Южной Африки и от Испании до Монголии и имеет несколько подвидов.
При этом на уровне ДНК все домашние кошки практически неотличимы от степного кота F. s. lybica – подвида, обитающего преимущественно на Ближнем Востоке. Ископаемые останки, принадлежащие степному коту, были найдены в основном в Южной Азии и Южной Европе. Предполагается, что в течение многих тысячелетий, от неолита до настоящего времени, эти кошки обитали в основном в Малой Азии (части территории современной Турции).
Самые ранние археологические свидетельства сосуществования человека и кошки были найдены на Кипре и датируются 7–8 тыс. до н. э. Так как ни на одном из средиземноморских островов, помимо Сицилии, никогда не было аборигенных популяций кошек, то на Кипр кошки могли попасть только вместе с переселенцами с Ближнего Востока. По-видимому, кошки были одомашнены в так называемом Плодородном полумесяце около 10 тыс. лет назад – именно в то время на этой легендарной ближневосточной территории, которую часто называют колыбелью цивилизации, люди основали свои первые поселения.
Так человек создал совершенно новую среду обитания для диких животных. Мусорные кучи вокруг селений обеспечивали грызунам бесплатный стол и дом. А за мышами пришли кошки – но не все. На первых порах действовал строгий отбор толерантных по отношению к человеку животных, которые могли сосуществовать рядом с ним. Почему F. s. lybica стал единственным подвидом дикой кошки, который был доместицирован? Потому что он оказался в нужном месте и в нужное время. По мере того, как сельское хозяйство распространялось за пределами Плодородного полумесяца, F. s. lybica распространялся вместе с ним, не позволяя местным популяциям диких кошек присоединяться к их кормовым угодьям – мусорным кучам.
Кошки завоевывают Землю
Анализ последовательностей ДНК митохондрий (клеточных органелл-«электростанций) из палеонтологических остатков и у современных кошек позволил реконструировать историю их расселения по свету. Для современных кошек характерно пять митотипов – основных вариантов митохондриальной ДНК (мДНК) – A, B, C, D и E, отличающихся друг от друга по нескольким мутациям (Ottoni et al., 2017).
Почти все (12 из 14) ископаемые остатки дикой кошки, относящиеся к периоду с 8000 до 800 лет до н. э., имеют митотип А. Позже кошки с данным митотипом заселили почти весь Старый Свет. В наше время он является самым распространенным среди домашних кошек.
Большинство обнаруженных мумифицированных останков египетских кошек, живших 7,5—2 тыс. лет назад, имеют митотип С. Кошки играли большую роль в жизни и религии древних египтян. Множество изображений и мумий этих кошек, дошедших до наших дней, и породило идею, что кошки были впервые одомашнены в Египте. Археологические и палеогенетические данные не исключают, что кошка была независимо одомашнена в двух местах. Но более правдоподобной выглядит гипотеза, что центром доместикации был все-таки Плодородный полумесяц, а Египет стал центром котоводства*.
* Странно и обидно, что собаководство, коневодство, овцеводство и другие водства есть, а котоводства™ до сих пор не было, хотя это важная отрасль человеческой деятельности. Теперь будетНесмотря на запрет на кошачий экспорт, введенный в Египте еще в 1700 г. до н. э., египетские кошки распространились по большей части Старого Света. Они были особенно популярны в Малой Азии: в первом тысячелетии нашей эры частота встречаемости митотипа С на этой территории была в два раза выше, чем митотипа А.
Судя по археологическим и генетическим данным, расселению кошек, вероятно, способствовало распространение домовой мыши и черной крысы по морским путям, начиная уже с железного века. На севере Альп домашние кошки появились вскоре после римских завоеваний. В Средние века было обязательно иметь кошек на корабле, что способствовало их распространению по путям военных действий и торговли. Этим можно объяснить обнаружение кошачьих останков, датированных VII—XI вв., с египетским митотипом С в портовом городе викингов Ральсвике (территория современной Германии).
Кошкам нашли и другие применения, помимо основных – борьбы с грызунами и умиротворения хозяев. В Средние века это животное стало непременным ассистентом ведьм, а кошачьи шкурки использовались при пошиве одежды**.
** И, судя по всему, используются до сих пор. ГОСТ 11597–77 (Шкурки кошки домашней меховые выделанные) никто не отменялЗахватывая новые территории, домашние кошки скрещивались с местными дикими, что способствовало появлению новых митотипов – D и Е. Современные генетические данные говорят об интенсивной гибридизации одичавших домашних кошек с популяциями диких европейских кошек, что ставит последних под угрозу исчезновения.
Согласно археологическим данным, в Сибирь домашние кошки проникли с русскими переселенцами. Поэтому все легенды о древних сибирских котах не имеют под собой научных оснований.

Реконструировать пути миграции кошек позволил анализ географического распределения мраморного окраса среди бродячих кошек. Его встречаемость выше в Великобритании и Иране и убывает по мере удаления от этих стран. Поскольку Британия долго правила морями, мраморных кошек до сих пор много в портовых городах вообще и в ее колониях в особенности.
Анализ древней, теперь уже ядерной, ДНК у ископаемых протодомашних кошек позволил впрямую проверить эти реконструкции. Он подтвердил, что мраморный окрас возник довольно поздно. Самая древняя мутантная последовательность гена Tabby обнаружена у ископаемых кошек из Южной Азии времен Османской империи (XIV—XV вв.). Позже частота ее встречаемости увеличилась, и она распространилась по Европе и Африке. В XVIII в. мраморный окрас стал достаточно распространенным, а уже в следующем столетии он начал использоваться для создания пород.
Геногеография в эпоху машинного обучения
В прошлом веке самой процветающей отраслью генетики кошек была «геногеография», по числу научных публикаций опережавшая все остальные отрасли, вместе взятые. Энтузиасты ездили по миру, считали кошек разных окрасов, составляли карты, вычисляли индексы сходства и строили красивые модели. В новом веке этот вид занятий сошел на нет. В большинстве крупных городов подсчитали по сотне кошек, основные пенки сняли, осталось добирать мелочи. Значит ли это, что геногеография умерла? Вовсе нет. Мы видим две столбовые дороги, по которым она может пойти.
С удешевлением современных методов генотипирования начинают развиваться и финансироваться проекты молекулярной геногеографии. Сравнение в разных точках мира генетического разнообразия бродячих кошек, с одной стороны, и местного и пришлого человеческого населения – с другой, позволит лучше понять эволюцию взаимоотношений двух уникальных видов. Как пророчески мог бы написать Дарвин, «свет будет пролит на переселения человека и кошки и их общую историю».

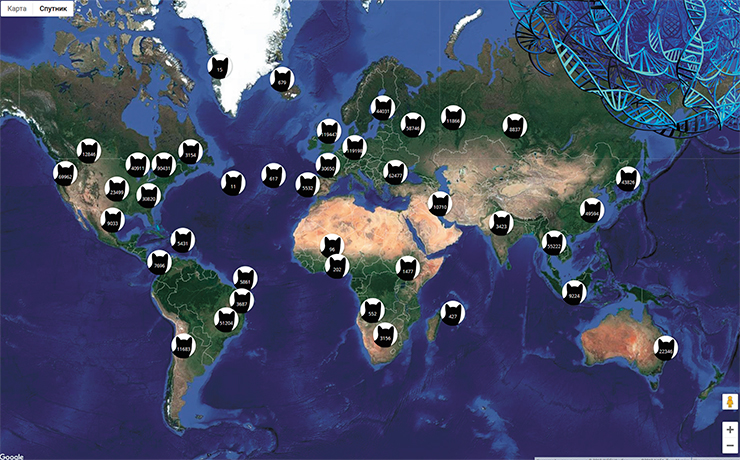
Второй путь подразумевает использование соцсетей и гражданской науки для решения геногеографических проблем. Что люди постят больше всего на свете? Верно, фото котиков. Все соцсети просто завалены котиками. Как утилизировать это богатство? Правильно, создать API, который станет сетью для вылавливания этих котиков из Сети. И такой интерфейс уже создан и занимается созданием всемирной карты фотографий кошек, доступной по адресу https://iknowwhereyourcatlives.com/. Там вы можете увидеть адреса и фото всех кошек, которые засветились в сетях с геотегами.
Следующий шаг, который предстоит сделать, создать нейросеть для определения фенотипа запощщеных котов. Это не такая простая задача, как кажется. Да, ГуглФото может различать лица людей в фас и в профиль, и даже в широких возрастных пределах. Он прекрасно отличает кошек от людей. Наверное, можно научить его узнавать и кошачьи морды: это Васька, а это Жан-Жак. Но вот с окрасами и текстурами шерсти пока плохо. Знакомые программисты не берутся научить сеть надежно отличать голубого кота от рыжего. Или мы знакомы не с теми программистами? Но мы абсолютно уверены, что со временем эта задача будет решена, и мы получим геногеографические карты нового поколения.
Дарвин, завершая свое «Происхождение видов», писал: «Мы смутно предвидим глубокий переворот в области естественной истории». Завершая эту статью, мы смутно предвидим гигантский прогресс во всех областях генетики, который обязательно затронет и генетику кошки.

Будут созданы новые чудесные породы кошек. Появятся новые методы генетического и геномного редактирования. Будет раскрыта, наконец, тайна мраморной окраски. Мы поймем, как и насколько гены контролируют развитие, как они взаимодействуют друг с другом, обеспечивая развитие наших котов, таких разных, прекрасных и удивительных.
Люди научатся реконструировать геномы, а по ним и облик, и даже особенности поведения вымерших животных. Мы узнаем, мурлыкал ли саблезубый тигр и как он относился к валерьянке.
Нам будет, о чем написать в статье «Кошки и гены: пятьдесят лет спустя».
Литература
Buckingham K. J., McMillin M. J., Brassil M. M. et al. Multiple Mutant T Alleles Cause Haploinsufficiency of Brachyury and Short Tails in Manx Cats // Mammalian Genome. 2013. V. 24. P. 400–408.
David V. A., Marilyn Menotti-raymond, Wallace A. C. et al. Endogenous Retrovirus Insertion in the KIT Oncogene Determines White and White Spotting in Domestic Cats // G3-Genes Genomes Genetics. 2014. V. 4. P. 1881–1891.
Driscoll C. A., Juliet Clutton-Brock, Kitchener A. C. et al. The Taming of the Cat // Scientific American. 2009. V. 300. P. 68–75.
Gandolfi B., Alhaddad H., Joslin S. E. K. et al. A Splice Variant in KRT71 Is Associated with Curly Coat Phenotype of Selkirk Rex Cats // Scientific Reports. 2013. V. 3. P. 2000.
Gandolfi B., Outerbridge C. A., Beresford L. G. et al. The Naked Truth: Sphynx and Devon Rex Cat Breed Mutations in KRT71 // Mammalian Genome. 2010. V. 21. P. 509–515.
Kaelin C. B., Xu X., Hong L. Z. et al. Specifying and Sustaining Pigmentation Patterns in Domestic and Wild Cats // Science. 2012. V. 337. P. 1536–1541.
Lettice L. A., Hill A. E., Devenney P. S. et al. Point Mutations in a Distant Sonic Hedgehog Cis-Regulator Generate a Variable Regulatory Output Responsible for Preaxial Polydactyly // Human Molecular Genetics. 2008. V. 17. N. 1. P. 978–985.
Mosher D. S., Quignon P., Bustamante C. D. et al. A Mutation in the Myostatin Gene Increases Muscle Mass and Enhances Racing Performance in Heterozygote Dogs // PLOS Genet. 2007. V. 3. P. 1–8.
Olsson M., Meadows J. R. S., Truvé K. et al. A Novel Unstable Duplication Upstream of HAS2 Predisposes to a Breed-Defining Skin Phenotype and a Periodic Fever Syndrome in Chinese Shar-Pei Dogs // PLoS Genetics. 2011. V. 7. N. 3.
Ottoni C., Neer W. V., Geigl E. et al. The Palaeogenetics of Cat Dispersal in the Ancient World // Nature Ecology & Evolution. 2017. V. 1. N. 139.
Xu X., Sun X., Hu X. et al. Whole Genome Sequencing Identifies a Missense Mutation in HES7 Associated with Short Tails in Asian Domestic Cats // Scientific Reports. 2016. V. 6. N. 31583.