«Самонаводящееся» лекарство, или Молекулярный наноконструктор для тераностики
Герой древнегреческих мифов Ахилл был неуязвим, потому что его мать, богиня Фетида, окунула его после рождения в воды Стикса, реки в царстве мертвых. Она держала будущего воина за пятку, которая осталась его единственным незащищенным местом – именно туда и попала сразившая героя стрела, направленная богом Аполлоном. Эта история является своего рода метафорой для описания одного из самых многообещающих направлений в современной медицине. Сегодня мы можем создавать все новые и новые лекарства, поражающие, к примеру, раковые клетки, но проблема состоит не в том, чтобы создать то или иное соединение: главное, чтобы оно не затронуло весь организм, здоровые органы и ткани, позволив больному пережить само лечение. И эта задача уводит нас в область молекулярной физиологии – к созданию средств, способных прицельно вести поиск ахиллесовой пяты заболевания и избирательно на нее воздействовать
В начале XX в. немецкий иммунолог П. Эрлих, получивший в 1908 г. вместе с российским физиологом И. И. Мечниковым Нобелевскую премию, в своих работах по теории иммунитета впервые сформулировал концепцию «магической пули» – лекарства, которое само бы находило и избирательно поражало очаги заболевания в организме человека. Можно сказать, что эта идея «заимствована» у природы, которая создала «самонаводящиеся» лекарства – белковые антитела (иммуноглобулины), вырабатываемые иммунными клетками в ответ на чужеродное вторжение.
Но замечательная идея «магической пули» начала обретать плоть лишь более полувека спустя, когда было налажено производство так называемых моноклональных антител, способных связываться лишь с одним конкретным антигеном (чужеродным или опасным веществом, вызывающим иммунный ответ). Такие антитела производили клеточные линии из «гибридов» здоровых и опухолевых иммунных клеток мышей, а для использования в медицине эти белки научились «гуманизировать» с помощью генно-инженерных технологий, заменяя в них фрагменты мышиных иммуноглобулинов на человеческие.
Обе эти идеи легли в основу одного из самых бурно развивающихся направлений медицины XXI в. – тераностики (от терапия и диагностика). Таким образом, хотя сам этот термин был впервые использован лишь в 2002 г., мысль сочетать в «одном флаконе» адресующий компонент, который узнает ахиллесову пяту заболевания, и терапевтический оказалась далеко не новой, но зато очень многообещающей!
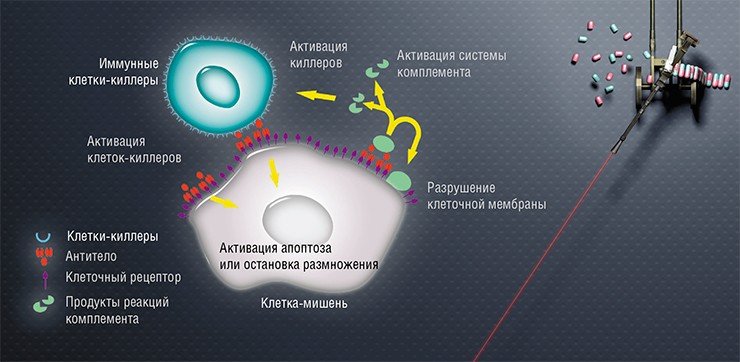
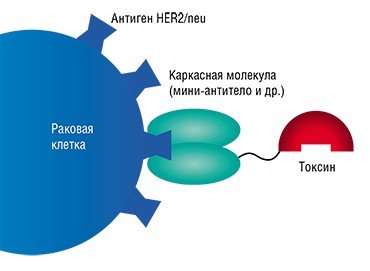
Первые лекарственные препараты на основе моноклональных антител появились на рынке еще в 1986 г., а сегодня в медицине используются около полусотни подобных препаратов, в основном для лечения онкологических заболеваний. Антитела, специфично связываясь с опухолевой клеткой, могут играть двоякую роль. Они либо несут лекарственное соединение или токсин, либо сами служат лекарством, так как способны вызвать «убийство» патологической клетки, привлекая к ней внимание иммунной системы организма.
Однако такие иммуноглобулины дороги в производстве, поскольку их получают в клетках млекопитающих, а не в «высокотехнологичных» клеточных культурах микроорганизмов. При этом на один курс лечения часто требуется не менее дюжины граммов препарата. В результате, к примеру, курс лечения герцептином рака молочной железы обойдется примерно в 100 тыс. рублей.
Вторая проблема состоит в том, что любой иммуноглобулин – это крупная молекула, которой непросто пройти через поры кровеносных сосудов, поэтому она будет долго (несколько недель) циркулировать по кровотоку. Это затрудняет адресную доставку лекарств. Большая молекулярная масса мешает таким препаратам проникать внутрь опухолей, поэтому они задерживаются на периферии очага. Кроме того, полноразмерные моноклональные антитела имеют константные участки, отвечающие за взаимодействие с клетками иммунной системы организма, что может спровоцировать дополнительные побочные реакции, когда антитела используются для доставки терапевтических токсических агентов.
Неудивительно, что у ученых появилась идея развить дальше инженерные решения природы. Они начали модифицировать полноразмерные антитела, в том числе дробить на части, создавать мини-антитела и т. п. Параллельно началось интенсивное изучение и создание совершенно новых конструкций на основе природных или искусственно синтезируемых белковых соединений, которые стали называть скаффолдами (от анг. «строительные леса»), или каркасными белками.
Следующей задачей стало создание многофункциональных соединений, которые одновременно содержали бы как нацеливающую часть, так и диагностический и (или) терапевтический агенты: флуоресцирующие белки, радиоизотопы, белковые токсины, антибиотики, ферменты и т. п. В идеальном случае подобный комплекс должен иметь еще возможность «включать/выключать» действие агента и тем самым еще более избирательно контролировать его действие.
Золотая середина
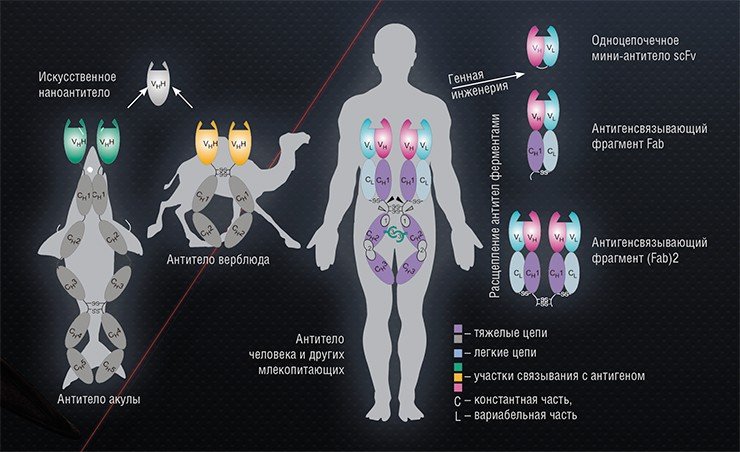
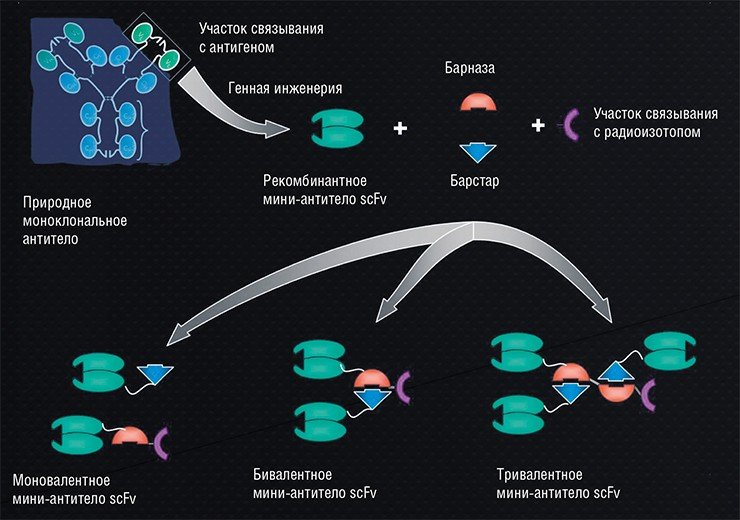
Вариантов модификации полноразмерного человеческого антитела, состоящего из двух легких и двух тяжелых пептидных цепей, существует множество. Например, мы можем отрезать от молекулы природного иммуноглобулина участок, отвечающий за связывание с конкретным антигеном. Этот фрагмент, в свою очередь, также можно разорвать на части путем ферментативного дробления или с помощью генно-инженерных методов. Скаффолды с еще меньшей молекулярной массой производят только путем белково-инженерного конструирования.
 Таким способом можно получить, к примеру, так называемое одноцепочечное антитело, состоящее только из антигенсвязывающих вариабельных участков легкой и тяжелой цепей иммуноглобулина, соединенных гибким пептидным мостиком. Еще более удобные для адресной доставки конструкции могут быть получены по образцу антител верблюда, большая часть иммуноглобулинов которых состоит только из тяжелых цепей, выполняющих все необходимые функции.
Таким способом можно получить, к примеру, так называемое одноцепочечное антитело, состоящее только из антигенсвязывающих вариабельных участков легкой и тяжелой цепей иммуноглобулина, соединенных гибким пептидным мостиком. Еще более удобные для адресной доставки конструкции могут быть получены по образцу антител верблюда, большая часть иммуноглобулинов которых состоит только из тяжелых цепей, выполняющих все необходимые функции.
Но какие из этих молекулярных конструкций будут работать наиболее эффективно? Здесь нужно учитывать скорость, с которой организм будет освобождаться от всех молекул. Опухолевая ткань характеризуется очень плотными контактами между клетками. И в этом контексте уменьшать размер молекул выгодно, так как они легче проникают в плотные опухоли. Но тут мы сталкиваемся с дилеммой.
В наших почках плазма крови фильтруется через поры диаметром около 6 нм, в результате чего вещества с молекулярной массой меньше 60—65 кДа быстро выводятся через почки. И, следовательно, чем меньше будет размер молекулярных конструкций, тем больше будет нагрузка на почки. С другой стороны, раковая опухоль вся пронизана кровеносными сосудами, которые можно назвать «дырявыми»: они имеют бóльшие (по сравнению с нормальными) поры, что обеспечивает эффективную пассивную доставку небольших молекул. И чем меньше молекула, тем больше вероятность, что она попадет в опухолевую ткань.
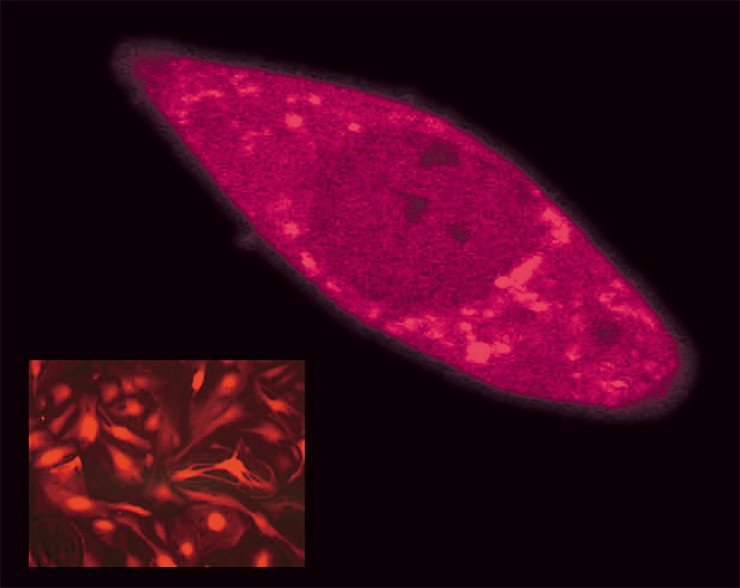
В результате биотехнолог, выбирая размер своей молекулярной конструкции, все время должен думать о балансе между эффективностью препарата и его нефротоксичностью. Нужно искать золотую середину.
ПРОФЕССОР НА ОБРОКЕ Я защитил кандидатскую диссертацию по химическим наукам, докторскую – по биологическим, а член-корром стал по нанобиотехнологии, т. е. в научном плане я мультифункционален.А началось все с энзимологии, которая занимается изучением активности ферментов. В 1971 г., еще будучи студентом химфака МГУ, я пришел в Институт молекулярной биологии им. В. А. Энгельгардта в лабораторию академика А. Е. Браунштейна, который еще в 1952 г. выдвигался на Нобелевскую премию (думаю, он бы получил ее, если бы не тогдашний «железный занавес»). В то время энзимология была вершиной молекулярной биологии, ведь тогда только начали выдаваться первые Нобелевские премии за открытия ДНК и основ наследственности. ПЦР, генная инженерия – всего этого и в помине не было.
 После защиты кандидатской в 1977 г. я понял, что с уходом великого Браунштейна эта область науки уже не будет такой «горячей». В нашем институте начали заниматься ДНК, и в 25 лет я полностью сменил направление исследований.
После защиты кандидатской в 1977 г. я понял, что с уходом великого Браунштейна эта область науки уже не будет такой «горячей». В нашем институте начали заниматься ДНК, и в 25 лет я полностью сменил направление исследований.
Тогда появились работы японского молекулярного биолога С. Тонегавы, который в 1987 г. получил Нобелевскую премию за открытие механизма перегруппировки генов, кодирующих иммуноглобулины. Я увлекся генетикой иммунного ответа, и моя докторская, защищенная в 1990 г., уже называлась «Гены иммуноглобулинов. Структура и перегруппировки». Отмечу, что нам удалось в некоторых деталях уточнить механизм перегруппировки Тонегавы. Конечно, это «песчинка», но все же свой вклад в понимание генного механизма, отвечающего за разнообразие антител, мы внесли.
1990-е – это не только тяжелое голодное время для нашей страны. В это время продолжала бурно развиваться генная инженерия. От этой «горячей области» ответвилось технологическое направление – «инжиниринг антител», которое также стало активно развиваться. Здесь возникло два направления, в какой-то степени конкурировавших между собой: создание полноразмерных антител, которые сейчас уже прочно вышли на рынок, и создание мини-антител.
У меня появилась крохотная лаборатория, где сначала мы занялись полноразмерными молекулами иммуноглобулинов. С помощью методов генной инженерии нам удалось поменять изотип этих молекул, определяемый структурой тяжелых цепей. Но полноразмерные иммуноглобулины дороги, и в то время наладить такое производство было нереально. Поэтому мы начали заниматься малыми молекулами – это был сугубо практический выбор (в последние годы в мире это направление стало активно развиваться, и я уверен, что за ним – будущее).
Мой сын рос, он играл в LEGO, и меня осенила мысль: хорошо бы научиться создавать нужную конструкцию из блоков, заранее синтезированных. Ведь это проще и быстрее – работать с готовыми «кирпичиками»: один кирпичик – направляющий, второй – терапевтический. В качестве платформы я выбрал две небольшие молекулы, образующие прочный комплекс: «барназу» и «барстар».
Идея хорошая, но вот возможностей для ее реализации не было никаких. В конце 1990-х положение в науке стало совсем тяжелым. Правдами и неправдами я попал на конференцию в Сан-Диего по инженерии антител. Там выбрал из всех, кто занимался подобными вещами, профессора А. Плюктуна, который, на мой взгляд, был «лучшим из лучших». Подошел к нему и предложил себя для совместной работы в любом качестве (к тому времени на родине я уже был профессором).
Сам Плюктун занимался технологией «лейциновых зипперов» – аминокислотных «застежек». Небезынтересная, хотя и совсем другая история, как он придумал эти «застежки». Насколько я помню из его рассказов, в основе была аспирантская ошибка при конструировании ДНК, которая привела к тому, что получились другие аминокислоты, сложившиеся в «застежку». Девять из десяти ученых прошли бы мимо, но великий Плюктун понял, что это можно использовать, и развил технологию «зипперов», которой и предложил мне первоначально заниматься. Но я хотел развивать собственную идею сборки на основе пары «барназа–барстар».
Когда академик В. А. Энгельгардт основал свой институт, отечественной «молекулярки» у нас не было. Энгельгардт говорил: «Берите любую работу из американского PNAS и повторите ее, тогда можете получить собственную лабораторию». Его подход – великая вещь: он позволил заложить основу института и добиться успеха (вторая его не менее успешная идея состояла в том, что за одним столом, но не в одном лице, должны работать химик, физик и биолог). Да, для начала необходимо использовать чужой опыт, но потом – потом нужно начинать что-то свое! Конечно, можно взять любую существующую успешную технологию и развить ее, создать на этой основе новый (аналогичный) вариант лекарства для разных форм рака, и это, скорее всего, будет обречено на успех. Но это не будет чем-то уникальным, это не будет «впервые».
…В результате Плюктун все-таки пригласил меня в свою лабораторию и предложил студенческую стипендию, чтобы я смог поработать в Швейцарии. За это я ему буду всегда благодарен. И это касается не только возможности поработать в одной из лучших и прекрасно оснащенных лабораторий мира, но и многих интереснейших и плодотворных обсуждений, которые помогли мне сформировать адекватный взгляд на проблему биоинженерии и на свое место в этой области. Кстати, уместно заметить, что и новая прорывная технология дарпинов была создана и успешно развивается именно в лаборатории профессора Плюктуна. Он действительно и без всякого преувеличения «классик» белковой инженерии.
Но вернемся в конец 1990-х гг. Первое время я жил в общежитии евангелической молодежи «Оазис». Там было неплохо, но так холодно, что втайне пришлось купить обогреватель. Душем в коридоре нельзя было пользоваться с 10 вечера до 6 утра, чтобы не будить других постояльцев. Из лаборатории я возвращался как раз в это запретное время и зимними ночами, чтобы не было слышно, тихо мылся под тонкой струйкой горячей воды, чтобы хоть как-то согреться. Сейчас-то это все кажется смешным и милым…
В первые три месяца работы у меня ничего не получалось. Стипендию продлили еще на три месяца – и дело пошло! Я стал делить свою жизнь между Москвой и Цюрихом. Начал получать уже не 1600 швейцарских франков, а 10 тысяч. Параллельно с женой и сыном строил дом в Москве, освоил строительные специальности и даже сварку, что считаю не меньшим достижением, чем профессорское звание. Было нелегко. В какой-то момент я осознал, что, как раньше крестьяне ездили на оброк в город, так и я езжу на заработки в Швейцарию. Конечно, условия изменились. Я стал почетным приглашенным профессором, у меня был безвизовый въезд, а вместо общежития «профессора Сергея» ждала специально арендованная комфортабельная квартира…
Вся эта работа закончилась статьей в Nature Biotechnology (2003), а мои поездки прекратились по семейным обстоятельствам. Идея универсальной платформы «барназа-барстар» сработала и имеет русско-швейцарское гражданство, подтвержденное общим патентом. Следующая статья вышла в Nature Nanotechnology спустя 11 лет. К тому времени появились талантливые сотрудники, и эта работа имела полностью отечественную «прописку». Но это уже другая история. Между этими датами было опубликовано около двух десятков статей как из нашей лаборатории, так и других авторов, которые стали развивать эту тему
На сегодняшний день при создании препаратов для тераностики помимо антител различного формата используется целый ряд других природных и искусственных биополимеров: аффибоди, аффитины, финомеры, аптамеры и др.
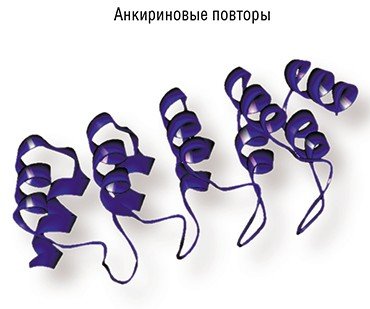
Примером перспективных каркасных белков служат дарпины (DARPins) – небольшие молекулы, в структуре которых есть «заякоривающиеся» аминокислотные повторы, обеспечивающие структурную стабильность, и видоизменяемые аминокислотные остатки, позволяющие модулировать связывание со специфическими мишенями. При этом сила связывания с мишенью у таких молекул порой даже выше, чем у природных антител. Но для биотехнологии главное – это экономические показатели. Если с одного литра культуры кишечной палочки мы получаем ~5 мг «укороченных» иммуноглобулинов, то в случае дарпинов – в 30—40 раз больше! Кроме того, дарпины очень устойчивы – их можно чуть ли не кипятить. И даже если присоединить к ним что-то достаточно объемное (токсин, наночастицы), то размер конструкции все равно останется оптимальным для кровотока.
У всех известных на сегодня альтернативных каркасных белков разные структуры и молекулярный вес. Но в целом можно сказать, что они слишком велики по сравнению с малыми пептидами и слишком малы по сравнению с обычными антителами. Поэтому мы не можем напрямую транслировать на них уже имеющиеся знания о распределении или фармакокинетике других белковых молекул. Нужно проверять все: нельзя механистически заменить иммуноглобулин на дарпин и ожидать, что это будет работать.
Токсин как лекарство
Большое число исследований в тераностике сегодня посвящено созданию бифункциональных соединений на основе противоопухолевых антител и мощных токсинов различной природы для воздействия на клетки-мишени. Почти половина препаратов, проходящих сейчас клинические испытания, являются такими иммунотоксинами.
Еще в 1990-х гг. начались попытки использовать для этой цели ферменты рибонуклеазы (РНКазы), которые катализируют расщепление рибонуклеиновых кислот (РНК), исполняющих в клетке ряд важнейших функций, начиная с участия в синтезе белка. Эти ферменты привлекают исследователей своей доступностью, отсутствием мутагенного эффекта и низкой побочной токсичностью для организма. В нашей стране коллектив сотрудников под руководством академика А. А. Макарова выполнил целый ряд исследований, доказавших перспективность использования рибонуклеаз для противоопухолевой терапии.
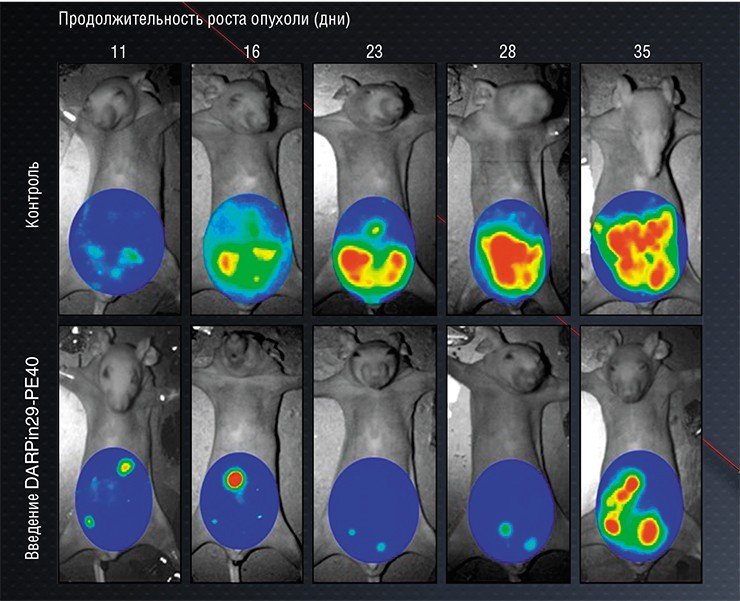
 Для создания нашего иммунотоксина мы использовали барназу – бактериальную рибонуклеазу, которая не ингибируется в клетках человека. Конструкция, содержащая две молекулы барназы и мини-антитело, специфичное к опухолевому маркеру HER 2, вызывала гибель раковых клеток с таким маркером in vitro и эффективно подавляла рост опухоли in vivo. При этом цитотоксический эффект препарата с антителом оказался примерно на три порядка (!) выше, чем индивидуальной барназы.
Для создания нашего иммунотоксина мы использовали барназу – бактериальную рибонуклеазу, которая не ингибируется в клетках человека. Конструкция, содержащая две молекулы барназы и мини-антитело, специфичное к опухолевому маркеру HER 2, вызывала гибель раковых клеток с таким маркером in vitro и эффективно подавляла рост опухоли in vivo. При этом цитотоксический эффект препарата с антителом оказался примерно на три порядка (!) выше, чем индивидуальной барназы.
Чемпионом по токсичности на сегодняшний день считается псевдомонадный токсин А, выделяемый синегнойной палочкой: чтобы убить клетку, достаточно 2—3 молекул этого белка. Однако такой токсин убивает без разбора, поэтому при создании препарата один из участков этого белка заменяется на адресующий модуль.
В созданных нами двух иммунотоксинах в качестве направляющего модуля выступают одноцепочечное мини-антитело и дарпин. И в том и в другом случае были получены очень хорошие терапевтические результаты: токсин убивал только раковые клетки и действовал в очень низких концентрациях. Эффективность токсина была показана не только на клеточных культурах, но и в опытах на лабораторных животных.
Да будет свет!
В начале нового века были созданы флуоресцентные белки, способные при облучении светом производить активные формы кислорода, губительно действующие на клетки, в том числе опухолевые. Первым примером стал Killer Red – мутантный белок гидроидной медузы, полученный в Институте биоорганической химии РАН (Москва). Присоединив к этому белку специфическое противораковое мини-антитело, мы получили первый полностью генетически кодируемый иммунофототоксин, который можно производить генно-инженерным способом.
Еще один удивительный флуоресцентный белок – мини-SOG, модифицированный белок растения из семейства капустных. С этим фототоксином мы также создали две конструкции, где направляющими модулями служили либо одноцепочечное мини-антитело, либо дарпин. Однако при проверке токсического эффекта этих препаратов обнаружились странные факты: более крупная конструкция с мини-антителом оказалась почти в 30 раз эффективнее, чем с небольшим дарпином. Это шло вразрез с устоявшимися канонами фотодинамической терапии, согласно которой лучше всего работают фототоксины небольшого размера, которые легко проникают внутрь клетки и в клеточное ядро.
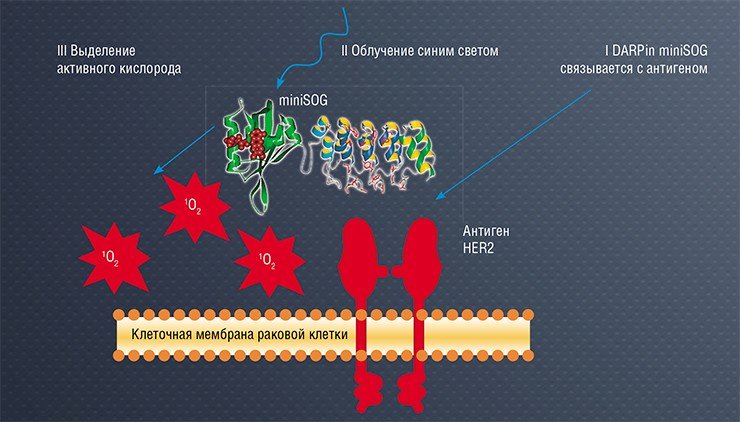
Дальнейшие исследования показали, что конструкция с мини-антителом действительно эффективнее, поскольку она дольше задерживается на поверхности мишени и буквально «прожигает» дыры в клеточной мембране, вызывая ее разрушение. А молекула с дарпином сразу попадает в цитоплазму, где имеется много защитных механизмов, восстанавливающих повреждения. Вот такая разная функциональная активность при сходстве структуры!
Мини-SOG в десять раз активнее Killer Red, но использовать его в медицинских целях непросто. Для возбуждения этого белка требуется синий свет, который плохо проникает сквозь кожу и другие ткани. Проблема была решена радикально: источник света был доставлен непосредственно в то место, где должен работать фототоксин. Для этого была создана тандемная генно-инженерная конструкция, обеспечивающая одновременный биосинтез мини-SOG и фермента люциферазы NanoLuc, которая при добавлении специфического субстрата запускает процесс биолюминесценции, и нужное излучение генерируется рядом или непосредственно внутри клетки-мишени.
При облучении синим светом выделяют активные формы кислорода и всем знакомый рибофлавин (витамин B 2), и его производные. Если этим витамином насытить опухолевые клетки (а у них есть соответствующий рецептор) и затем облучить, то можно добиться их деградации. Но сделать это возможно опять же либо на открытом операционном поле, либо в «пробирке».
Для этой проблемы найдено нестандартное решение. Красный свет, в отличие от синего, проникает очень глубоко. И есть очень интересные неорганические фотолюминесцентные наночастицы с хорошей биосовместимостью – нанофосфóры, которые при облучении красным светом начинают переизлучать в синей части спектра. Остается лишь доставить эти наночастицы к очагу поражения, что и было сделано вместе с профессором А. В. Звягиным и группой российских ученых под руководством академика В. Я. Панченко.
Молекулярное ЛЕГО
Как известно, будущее – за персонализированной медициной. И в этом смысле очень важно, чтобы мы научились «собирать» нужные для конкретного пациента молекулярные тераностические конструкции непосредственно перед использованием из готовых блоков. Другими словами, нужна универсализация.
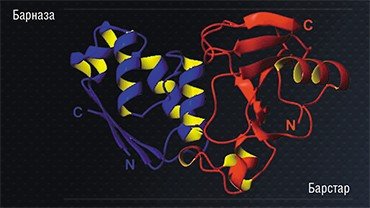 Таким универсальным каркасным модулем может служить наша любимая пара белков «барназа-барстар». Уже упомянутая барназа является бактериальным ферментом, а барстар – ее природным ингибитором. Эти небольшие, хорошо растворимые и устойчивые белки образуют при простом смешивании удивительно прочный комплекс путем самосборки. При этом концы обоих белков остаются свободными, и к ним можно присоединить все, что нужно: от адресующего мини-антитела до токсинов. Важными преимуществами такого модуля являются точное (строго 1:1) соотношение компонентов, которое в норме не присутствует в клетке высших организмов, и исключительно высокая специфичность взаимодействия, что исключает проблему образования «неправильных» пар.
Таким универсальным каркасным модулем может служить наша любимая пара белков «барназа-барстар». Уже упомянутая барназа является бактериальным ферментом, а барстар – ее природным ингибитором. Эти небольшие, хорошо растворимые и устойчивые белки образуют при простом смешивании удивительно прочный комплекс путем самосборки. При этом концы обоих белков остаются свободными, и к ним можно присоединить все, что нужно: от адресующего мини-антитела до токсинов. Важными преимуществами такого модуля являются точное (строго 1:1) соотношение компонентов, которое в норме не присутствует в клетке высших организмов, и исключительно высокая специфичность взаимодействия, что исключает проблему образования «неправильных» пар.
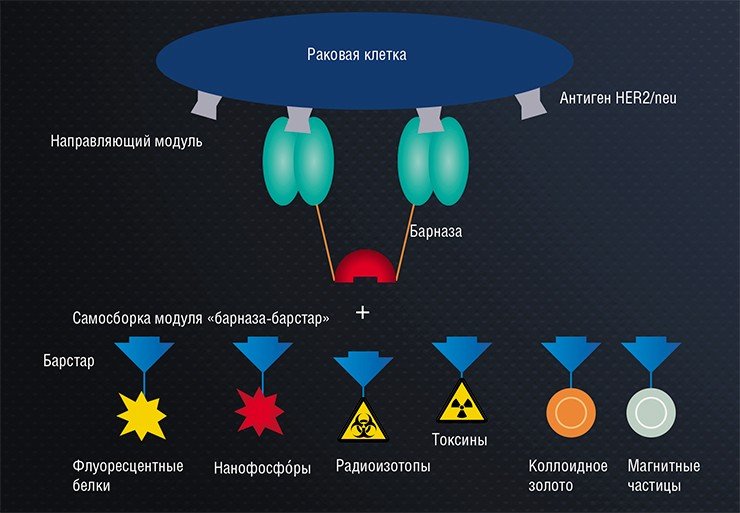
Вариантов использования этого комплекса множество. Например, присоединив адресующую часть антитела к двум молекулам барназы, а к барстару – экзотоксин, мы получили хорошо работающую терапевтическую конструкцию против опухолевых клеток с маркером HER 2.
Система «барназа-барстар» предоставляет возможность двухстадийной доставки агента к патологическому очагу. Например, для визуализации опухоли сначала вводят препарат на основе барстара, соединенного с мини-антителом, распознающим раковый поверхностный антиген HER 2/neu. Затем вводится барназа, к которой присоединен флуоресцентный белок EGFP. Самосборка модуля «барназа-барстар» происходит только на поверхности раковых клеток, что позволяет «увидеть» патогенный очаг. Такую раздельную доставку можно использовать и в случае применения радиоизотопов и других высокотоксичных соединений, чтобы снизить риск поражения здоровых тканей.
Как барназу, так и барстар можно ковалентно привязать не только к белкам, но и к коллоидным структурам. Силы взаимодействия барназы и барстара достаточно, чтобы объединять и удерживать в едином комплексе различные микро- и наночастицы органического и неорганического происхождения («квантовые точки», магнитные наночастицы, коллоидное золото, наноалмазы, нанофосфóры, полимерные наночастицы). Поверхность самих наночастиц с чрезвычайно большой удельной площадью может служить «площадкой» для связывания с различными молекулами, что позволяет оснащать их дополнительными функциональными модулями, создавая суперструктуры. Это не только расширяет возможности молекулярного конструирования, но и позволяет направленно влиять на клетки-мишени с помощью внешнего (теплового, оптического, электромагнитного, акустического) воздействия.
Большая часть разработок, о которых шла речь выше, – это потенциальные лекарства будущего. Однако некоторые из них уже прошли доклинические испытания, в том числе уже упомянутый иммунотоксин против рака молочной железы, конкретнее, против широко распространенного и одного из самых злокачественных видов рака, характеризующегося онкомаркером HER 2.
Иммунотоксин с помощью мини-анитела распознает клетки, несущие HER 2, а фермент барназа подавляет их. Уникальность этого препарата в том, что у него есть возможность отмены цитотоксического действия. Для этого достаточно лишь добавить барстар – природный ингибитор барназы, и препарат полностью теряет свою цитотоксическую активность.
Для испытаний этого лекарства мы в свое время получили грант от Минпромторга РФ. А потом наступил 2008 г., экономический кризис… Сейчас кто-то должен подхватить этот проект и продвигать его дальше. Нужны клинические испытания, а это уже совсем другие деньги.

У нас неоднократно бывали эмиссары из-за границы, предлагали купить наши разработки. Это были, как правило, мелкие коммивояжеры, которые стремятся за относительно небольшие деньги купить патент, а потом перепродать его крупной фирме. Но последние часто покупают патенты, чтобы положить их «под сукно». И таких патентов, уверен, много. Большие фирмы тратят сотни миллионов на создание лекарства, в том числе и на маркетинг. Например, вхождение того же герцептина в клиническую практику обошлось в десятки миллионов долларов. Это большие деньги, и если компания вложила их, то она настроена окупить их, пусть даже у ученых появятся более эффективные разработки.
Но дело не только в этом. Революционных вещей в области онкологии не бывает: вылечить всех от всего и навсегда невозможно. Мы можем делать препарат на 10 % лучше, на 70 %… Но вылечить? Никто не обманывает, но есть правда большая и маленькая.
С. М. Деев: «Это ужасно, когда люди, больные раком, подходят и спрашивают, можем ли мы им помочь. Я не знаю, что им ответить… Я ведь ученый, а не врач. Я не имею права лечить»Основная проблема рака в том, что его часто не удается вылечить «насовсем». Нередко мы видим, что опухоль исчезает, но через несколько месяцев вновь появляется. Механизмов тут может быть несколько. Академик Г. И. Абелев как-то сравнил рак с гоночным внедорожником: разгоняется быстро и едет, куда хочет. Опухолевые клетки быстро делятся и адаптируются. Например, они могут сбрасывать или «прятать» свои онкомаркеры (как самолеты сбрасывают алюминиевую фольгу, чтобы радары их не видели). А ведь наше HER 2-антитело связывается в первую очередь именно с такими маркерами.
Возможно, все дело в стволовых раковых клетках, которые дают поколение новых патологических клеток. Мы этой областью пока не занимаемся, но, возможно, именно там в будущем произойдет революция. Если мы сможем убивать не только саму опухоль, но и потенциальные раковые клетки – вот это будет прорыв. Все остальное, в том числе то, чем мы занимаемся, это эволюция.
Вот замедлить процесс мы можем, и тут главный вопрос: на какой стадии, каковы факторы риска? Говорят, что самая лучшая терапия – ранняя диагностика. На Западе терапия рака молочной железы на ранней стадии – это залог 98 % успеха лечения. Я уверен, что чем раньше начать использовать наш препарат, тем выше будут шансы изжить рак, получить если не полное выздоровление, то хотя бы длительную ремиссию.
Литература
Гребеник Е. А., Костюк А. Б., Деев С. М. Наноразмерные антистоковые фосфоры и гибридные конструкции на их основе для медицинского применения // Успехи химии. 2016. Т. 85 № 12. С. 1277—1296.
Деев С. М., Лебеденко Е. Н. Современные технологии создания неприродных антител для клинического применения // Acta Naurae. 2009. Т. 1. №1. С. 39—50.
Поляновский О. Л., Лебеденко Е. Н., Деев С. М. ERBBонкогены – мишени моноклональных антител // Биохимия. 2012, Т. 77. № 3. С. 289—311.
Deyev S. M. , Waibel R. , Lebedenko E. N. et al. Design of multivalent complexes using the barnase-barstar module // Nature Biotechnology. 2003. V. 21. N. 12. P. 1486—1492
Nikitin M. P., Shipunova V. O., Deyev S. M. et al. Biocomputing based on particle disassembly // Nat. Nanotechnol. 2014. V. 9. N. 9. P. 716—722.
Stumpp M. T., Binz H. K., Plückthun A. A novel strategy to design binding molecules harnessing the modular nature of repeat proteins // FEBS Letters. 2003. V. 539. N. 1-3. P. 2—6.
Zdobnova T., Sokolova E., Stremovskiy O., et al. A Novel Far-Red Fluorescent Xenograft Model of Ovarian Carcinoma For Preclinical Evaluation of HER2-targeted Immunotoxins // Oncotarget. 2015. V. 31. N. 6. P. 30919—30928.