Как замедление работы жизненно важных ферментов поможет в создании лекарств от рака
Системы репарации, если в их работе нет дефектов, устраняют практически любое повреждение ДНК. Разные белковые ансамбли специализируются на проведении «ремонта» ДНК определенного типа. Однако при лечении онкологических заболеваний ферментам репарации нужно, наоборот, затруднить работу, чтобы они не мешали уничтожению раковых клеток. Для этого ученые разрабатывают лекарства – ингибиторы ферментов репарации и репликации, и некоторые из них уже применяются в клинической практике. Например, это препараты на основе производных камптотецина, стабилизирующие связь с ДНК фермента топоизомеразы I. В норме этот фермент периодически обратимо связывается с ДНК, которая в этом связанном состоянии содержит разрыв цепи. Соединения камптотецина взаимодействуют одновременно с белком и с ДНК и не дают им «расстаться», и со временем количество «дырок» в ДНК возрастает настолько, что клетка гибнет. Но выяснилось, что стабилизацию ДНК с ферментом способен снимать еще один фермент – тирозил-ДНК-фосфодиэстераза 1, и ученые были вынуждены заняться поиском и его ингибиторов. Недавно этот поиск вошел в стадию экспериментов на животных, и результатами уже заинтересовались специалисты, занимающиеся клиническими испытаниями…
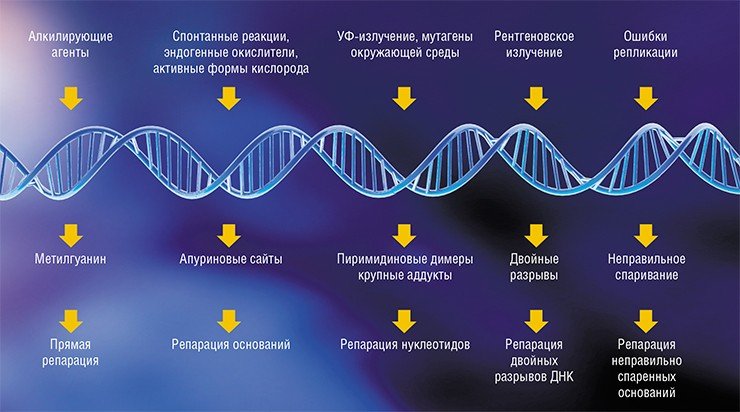
ДНК в организме живых существ постоянно подвергается разнообразным воздействиям физической и химической природы, в результате чего в ней возникают повреждения. Объемные повреждения ДНК вызывают ультрафиолет и мутагены окружающей среды, рентгеновское излучение – двойные разрывы ДНК. Наиболее серьезным типом повреждения структуры ДНК считаются модификации азотистых оснований и разрывы цепей ДНК, вызванные эндогенными окислителями, поскольку это происходит не под действием внешних факторов, а в результате обменных процессов, идущих в самом организме. И, наконец, случаются ошибки репликации, т. е. удвоения ДНК, когда в синтезирующуюся цепь нуклеиновой кислоты встраивается неправильное основание.
Но есть и механизмы «ремонта», или репарации, которые эти повреждения чинят. Существует несколько систем репарации, представляющих собой белковые ансамбли, специализирующиеся на проведении определенного типа «ремонта» ДНК.
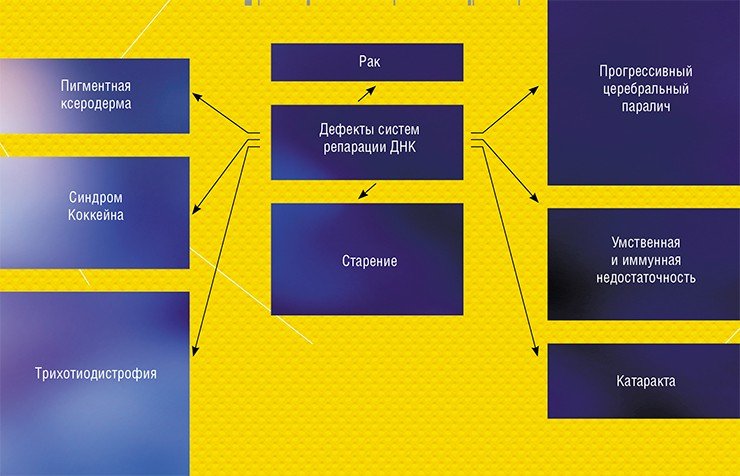
Как правило, система репарации чрезвычайно эффективна и удаляет практически любое повреждение ДНК – но только если в ее работе нет дефектов. Если они есть, это приводит к различным заболеваниям, среди которых бич современного человечества – онкологические заболевания. Безусловно, с неэффективной работой систем репарации связан и процесс старения.
Но есть другая сторона этого вопроса: при лечении онкологических заболеваний нужно, напротив, затруднить работу системам репарации. Химиотерапия и ионизирующая радиация способны убивать раковые клетки, разрушая целостность структуры их ДНК. К сожалению, системы репарации активно работают и в клетках опухоли, мешая ее уничтожению.
Еще одна область, где нужно ингибировать репарацию ДНК, – это редактирование генома с помощью системы CRISPR/Cas, позволяющее исправлять генетические нарушения или вносить изменения в структуру ДНК. Основой системы является комплекс из белка Cas9, способного разрезать нить ДНК, и гидовой РНК, которая может распознавать и связываться с определенным участком ДНК-мишени. Но системы репарации при этом стремятся репарировать создаваемый разрыв в молекуле ДНК, чем могут существенно снизить эффективность этой процедуры.
Какие ферменты ингибировать?
Как для лечения онкозаболеваний, так и эффективного использования геномного редактирования необходимы ингибиторы систем репарации. Над их созданием в мире работает много лабораторий, но нельзя сказать, что очень успешно. Однако позитивные примеры есть, и ряд препаратов уже применяется в клинической практике. Например, при лечении рака прямой кишки и мелкоклеточного рака легких используются ингибиторы фермента топоизомеразы I, препарата на основе производных камптотецина. При ряде других онкологических заболеваний применяют этопозид – ингибитор топоизомеразы II. Недавно было разрешено использовать ингибиторы фермента поли(АДФ-рибоза)-полимеразы 1 (PARP1): олапариб (линпарза), рукапариб (рубрака) и нирапариб (зеджула).
PARP1 был открыт еще в 1960-е гг. Этот фермент является универсальным регулятором сразу нескольких механизмов репарации ДНК. Он распознает разрывы ДНК, присоединяется к ним и синтезирует полимер поли(АДФ-рибозу), которая ковалентно связывается с белками, включая сам PARP1. Это приводит к ингибированию взаимодействий белков с ДНК, т. е. к деконденсации хроматина, что облегчает доступ к поврежденному участку ДНК другим ферментам репарации.
В свете этого идея ингибировать активность PARP1 (по сути, сразу несколько репарационных механизмов) на первый взгляд кажется очень привлекательной. Но этот фермент многофункционален и вовлечен во множество ключевых клеточных процессов, таких как транскрипция (переписывание информации с ДНК на РНК). Подавляя репарационную активность фермента, мы одновременно подавляем другие его функции. Поэтому препараты-ингибиторы PARP1 очень токсичны и применяются с большой осторожностью. Олапариб, к примеру, используют для лечения рака груди и яичников только у пациенток с мутациями в генах BRCA1/2 и только в критических случаях.
В нашей лаборатории хотя и ведутся работы в области поиска ингибиторов PARP1, но одновременно мы ищем более специфические мишени, чтобы создать менее токсичные и более щадящие организм лекарства.
Одна из таких мишеней – фермент тирозил-ДНК-фосфодиэстераза 1 (TDP1). У него тоже несколько функций, но этот белок менее разносторонний по сравнению с PARP1. Его основная работа состоит в том, чтобы удалять с ДНК остаток фермента топоизомеразы I (вообще, TDP1 способна удалять любые заместители с 3’-конца цепи ДНК).
Топоизомеразы I в рамках динамичного поддержания определенной конформации двойной спирали ДНК вносят в цепь ДНК разрыв, ковалентно соединяясь с одним из его концов, а потом происходит восстановление цепи. Если связанное состояние топоизомеразы I с ДНК, при котором в ДНК имеется разрыв, стабилизировать на фоне введения противоопухолевых препаратов, раковая клетка не сможет эффективно восстанавливаться и погибнет. Стабилизировать связанное с ДНК состояние топоизомеразы I можно с помощью соединений на основе камптотецина, которые взаимодействуют одновременно с белком и с ДНК.
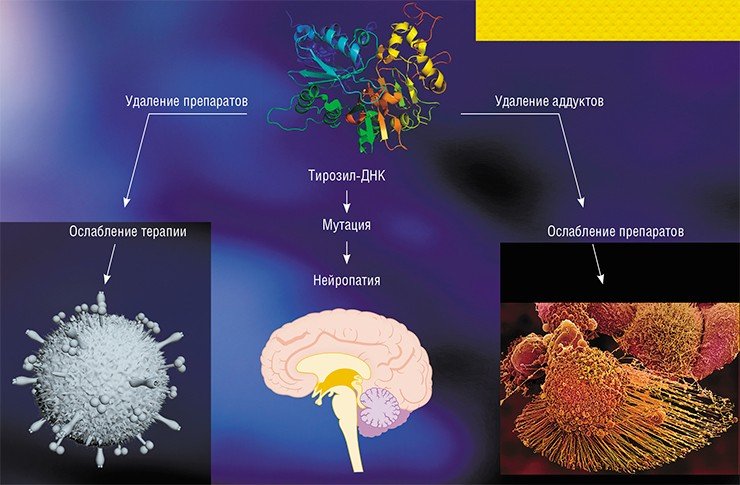
К таким препаратам относятся топотекан, иринотекан и белотекан. Они применяются в клинике, но восприимчивость к ним у пациентов очень разная. Когда стали разбираться с причинами этого, то выяснилось, что фермент TDP1 способен снимать «стабилизацию» топоизомеразы I на ДНК, вызванную препаратами камптотецина. «Нокаутные» по гену TDP1 клетки мыши и человеческие опухолевые клетки с мутацией в гене TDP1 оказались гиперчувствительными к камптотецину, а повышенная экспрессия TDP1, напротив, приводила к уменьшению числа повреждений ДНК, вызванных ингибиторами топоизомеразы I.
Сравнительно недавно для TDP1 была открыта природная мутация, когда в активном центре фермента аминокислота гистидин заменяется на аргинин. Эта мутация приводит к развитию нейродегенеративного заболевания SCAN 1 (спиноцеребеллярная атаксия-нейропатия). Такой фермент способен осуществить первую стадию катализа, ковалентно присоединяясь к ДНК, но не может завершить свою работу и остается «пришитым» к ДНК. Считается, что накопление подобных «сшивок» и приводит к развитию заболевания. Если это в самом деле так, то ингибиторы фермента могут помочь таким больнымКроме остатка топоизомеразы, TDP1 может удалять с 3’-конца ДНК терминаторы синтеза ДНК, применяющиеся для лечения вирусных инфекций, такие как ацикловир, азидотимидин, цитарабин и др. Эти препараты представляют собой аналоги нуклеотидов, которые не очень точные вирусные полимеразы принимают за свои субстраты и встраивают в растущую цепь ДНК. Поскольку у этих соединений отсутствует 3’-гидроксильная группа, необходимая для дальнейшего роста цепи, синтез вирусной ДНК на этом заканчивается. Как показала в 2013 г. японско-американская группа ученых, TDP1 способна удалять и эти соединения, мешая лечению таких заболеваний, как герпесвирусная инфекция, ВИЧ-инфекция и лейкемия, вызванная вирусами.
Таким образом, поиск ингибиторов TDP1 стал очень актуальной задачей, для решения которой был создан совместный проект с отделом медицинской химии, возглавляемым доктором химических наук, профессором Н. Ф. Салахутдиновым, Института органической химии им. Н. Н. Ворожцова СО РАН (Новосибирск). Этот отдел имеет огромный опыт в получении потенциальных медицинских препаратов путем направленной модификации структуры биологически активных природных соединений.
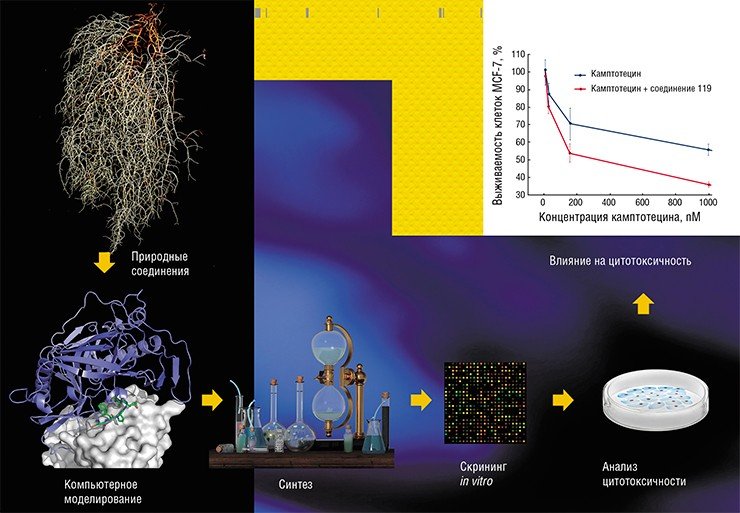
Как ученые ищут вещества – потенциальные ингибиторы ферментов репарации? Сначала выбирается вещество из библиотеки природных соединений, обладающих противоопухолевыми свойствами. Потом проводятся компьютерное моделирование синтеза веществ и испытания их ингибиторных свойств на рекомбинантных белках. Если эффективность ингибирования оказывается низкой, синтезируются другие молекулы, и снова проводятся испытания. В случае успеха выбранные соединения проверяются на цитотоксичность. Так как для увеличения эффективности ингибиторов фермента мы предполагали использовать их совместно с аналогами камптотецина, то проверяли еще и суммарную цитотоксичность ингибиторов TDP1 и производных камптотецина.
Лишайники, асцидии, цветы и нефть…
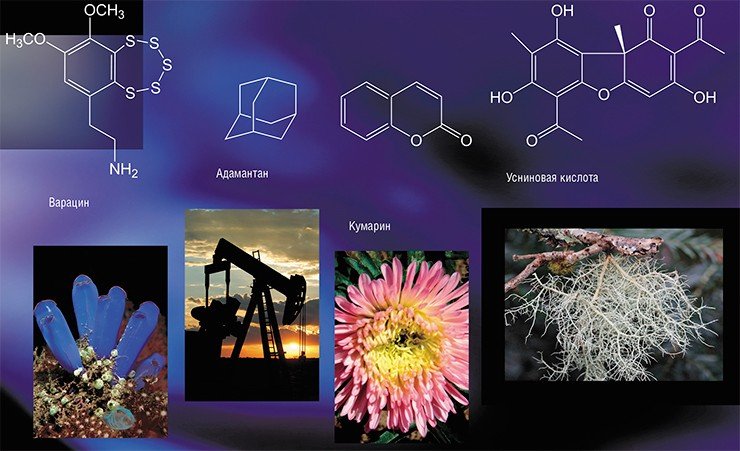
Вещество, с которого мы начали, – варацин, серосодержащее органическое соединение, которое выделяют из морских асцидий, низших хордовых животных. Химики создали его аналоги, и наиболее удачным оказался вариант, содержащий алифатический радикал. Математическое моделирование подтвердило: в активном центре TDP1 есть гидрофобный карман, обеспечивающий высокое сродство к этому ингибитору. Цитотоксичность таких препаратов находится на среднем уровне, что хорошо, но, к сожалению, они не усиливают действия препаратов на основе камптотецина.
Мы обратились к другим классам соединений, в частности к монотерпеноидным производным диазаадамантана – привлекательной для фармакологов структуры, которая обеспечивает препаратам хорошую биодоступность. Но эти соединения оказались малоэффективными.
Новосибирские исследователи разработали оригинальный метод определения активности фермента TDP1 в режиме реального времени, применив флуоресцентный подход. Был использован олигонуклеотид, на 3’-конце которого находился тушитель флуоресценции BHQ1, а на 5’-конце – флуоресцентная проба. Когда фермент удаляет 3’-концевой заместитель, наблюдается флуоресценция, а в присутствии ингибиторов она уменьшается. Силу ингибирования измеряли, используя показатель IC 50 – это величина концентрации, при которой активность фермента падает вдвоеПервые обещающие результаты мы получили, работая с производными кумарина, а именно с 7-гидроксикумарином, имеющим очень хорошие ингибиторные характеристики и почти не токсичным. Для этого класса соединений мы впервые получили увеличение цитотоксического эффекта камптотецина. И наконец нам удалось добиться увеличения цитотоксичности камптотецина примерно на порядок при работе с еще одним классом соединений – енаминами усниновой кислоты, которые к тому же показали низкую токсичность.
На сегодняшний день мы создали несколько классов ингибиторов TDP1, превосходящих по характеристикам уже описанные в мировой научной литературе. С лучшими из них были начаты испытания in vivo.
Эксперименты на животных показали, что использование одного из ингибиторов TDP1 уменьшает у мышей вес первичной опухоли на 30—50 %, если ингибитор применяется вместе с аналогом камптотецина – топотеканом. Эти исследования были проведены в группе доктора биологических наук Н. А. Поповой в Институте цитологии и генетики СО РАН (Новосибирск). Эффект был заметен уже на 2—3 сутки после начала лечения и впоследствии только нарастал. Что очень важно, при этом в 3—5 раз уменьшилось число метастазов в легких животных. Этот результат уже привлек внимание исследователей, занимающихся клиническими испытаниями, и врачей-онкологов, поскольку ингибиторами топоизомеразы I лечатся такие грозные и распространенные заболевания, как рак легких и рак кишечника. Увеличение эффективности этой терапии или устранение резистентности опухоли к ней могли бы спасти тысячи жизней.
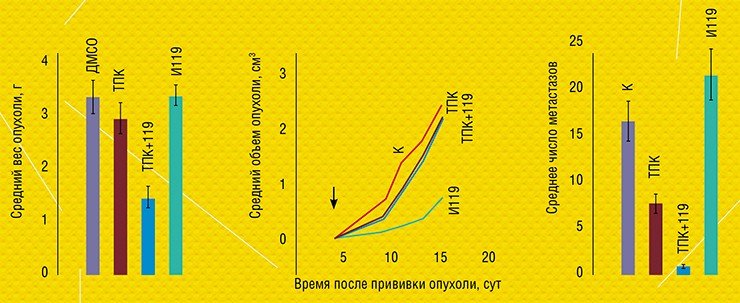
Исследование новосибирских ученых является оригинальной разработкой мирового уровня, проект был оценен Министерством науки и образования РФ как очень перспективный для проведения доклинических исследований. К сожалению, работа трех институтов по созданию противоракового препарата не была поддержана в недавнем конкурсе комплексных проектов СО РАН. Хочется верить, что в самом ближайшем будущем эти результаты будут оценены в Сибирском отделении РАН, и проект получит поддержку в силу его большой перспективности для увеличения продолжительности жизни онкобольных.
Для тех, кто занимается фундаментальными исследованиями, найти на их основе решение серьезной практической задачи является очень важным достижением в науке, и не может не радовать. Предмет наших исследований – системы репарации ДНК – безусловно, является не только основой жизни, но и чрезвычайно важен для будущего современной медицины.
Литература
Huang S. Y., Murai J., Dalla Rosa I. et al. TDP1 repairs nuclear and mitochondrial DNA damage induced by chain-terminating anticancer and antiviral nucleoside analogs // Nucleic Acids Res. 2013. V. 41. P. 7793–7803.
Comeaux E. Q. van Waardenburg R. C. A. M. Tyrosyl-DNA phosphodiesterase I resolves both naturally and chemically induced DNA adducts and its potential as a therapeutic target // Drug Metabolism Reviews. 2014. V. 46. N. 4. P. 494–507.
Zakharenko A. L., Khomenko T. M., Zhukova S. V. et al. Synthesis and biological evaluation of novel tyrosyl-DNA phosphodiesterase 1 inhibitors with a benzopentathiepine moiety // Bioorg Med Chem. 2015. V. 23. P. 2044–2052.
Khomenko T., Zakharenko A., Odarchenko T. et al. New inhibitors of tyrosyl-DNA phosphodiesterase I (Tdp 1) combining 7-hydroxycoumarin and monoterpenoid moieties // Bioorg Med Chem. 2016. V. 24. P. 5573–5581.
Zakharenko A., Luzina O., Koval O. et al. Tyrosyl-DNA Phosphodiesterase 1 Inhibitors: Usnic Acid Enamines Enhance the Cytotoxic Effect of Camptothecin // J Nat Prod. 2016. V. 79. P. 2961–2967.
В проекте принимали участие: сотрудники ИХБФМ СО РАН Захаренко А. Л., Захарова О. Д., Анарбаев Р. О., Дырхеева Н. С., Лебедева Н. А. под руководством Лаврик О. И.; сотрудники НИОХ СО РАН Лузина О. А., Волчо К. П., Суслов Е. В., Соколов Д. Н., Хоменко Т. М. под руководством Салахутдинова Н. Ф.; сотрудники ИЦиГ СО РАН Каледин В. И., Николин В. И. под руководством Поповой Н. А.
Работа поддержана базовым проектом ПФНИ ГАН на 2017–2020 гг. (VI.57.1.2, 0309-2016-0001)