Постгеномная эра. Получение трансгенных животных
В наши дни трансгенные организмы перестают быть редкостью и значение их для биологии и медицины трудно переоценить. Искусственное включение практически любого интересующего исследователей гена позволяет физиологам изучать на трансгенных животных различные отклонения в гомеостазе организма, иммунной системе, в эмбриогенезе и во многих других случаях
Получение трансгенных животных
Исследования в биомедицине сосредоточены в основном на том, чтобы создать широкий спектр моделей заболеваний человека, включая такие, как атеросклероз, диабет, гипертонию, болезнь Альцгеймера, ретинобластому, онкологические и многие другие заболевания. Модели трансгенных животных, как правило мышей, позволяют изучать механизмы развития и лечения болезней человека.
Трансгенные мыши являются также незаменимой модельной системой и для тестирования генетических конструкций перед получением сельскохозяйственных трансгенных животных-биореакторов, способных с молоком продуцировать белки человека.
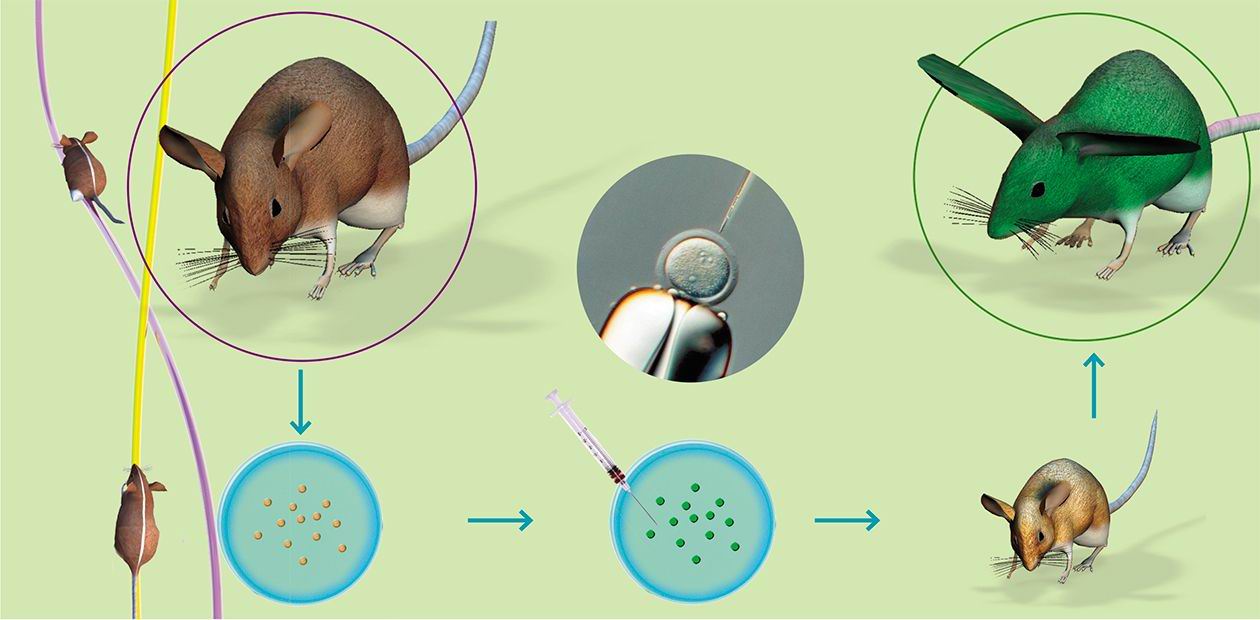
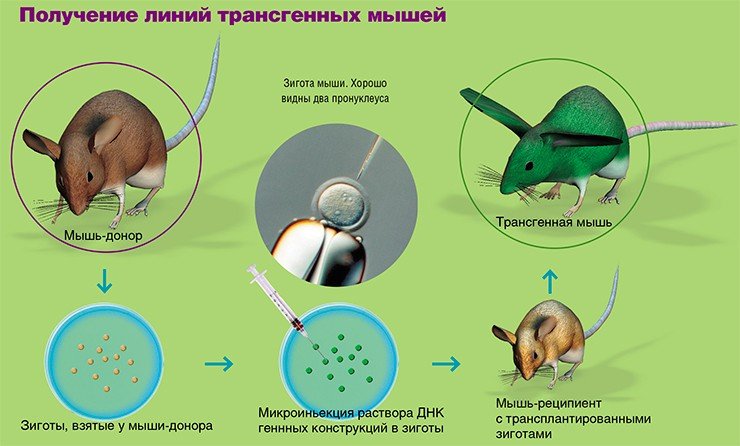
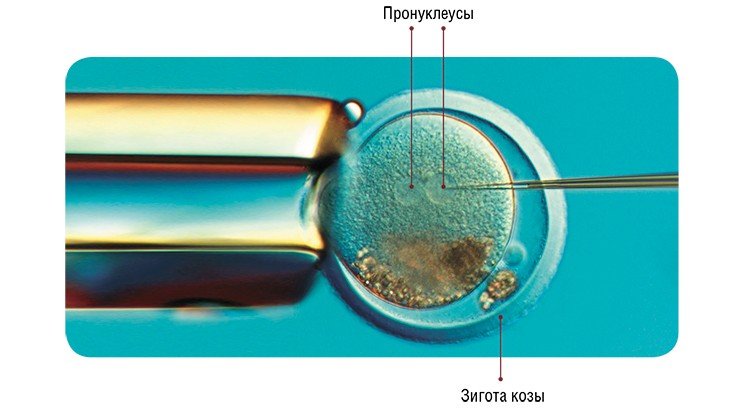
Наиболее широко используемый метод введения трансгена – микроинъекция в пронуклеусы (мужское и женское ядро) зиготы в тот момент, когда спермий проник в яйцеклетку, и пронуклеусы готовятся к слиянию. Суть метода заключается во введении в мужской пронуклеус с помощью микроманипулятора со стеклянным капилляром (диаметр кончика 1 мкм) раствора экзогенной (чужеродной) ДНК (500—1000 копий гена). Эта процедура проводится под микроскопом со специальной оптикой, позволяющей видеть пронуклеусы в трехмерном измерении.
Эффективность интеграции трансгенов в геном, т. е. число трансгенных животных от общего числа родившихся при использовании данного метода в зависимости от вида животных колеблется незначительно. Так, у мышей этот показатель составляет 5—15 %, у свиней – 10—15 %, у кроликов – 10 %, у овец, коз и коров – 5—10 %.
Можно выделить следующие этапы получения трансгенных животных:
1) получение зигот от гормонально стимулированных самок;
2) микроиньекция раствора ДНК генных конструкций в мужской пронуклеус зиготы;
3) трансплантация проинъецированных зигот самкам-реципиентам, подготовленным для вынашивания беременности;
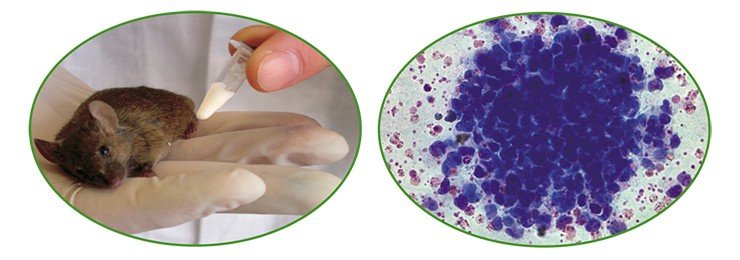
4) анализ родившихся потомков на присутствие трансгена методом полимеразной цепной реакции (ПЦР-анализ);
5) анализ трансгенных животных по наследованию трансгена, экспрессии рекомбинантного белка, его биологической активности; необходимо узнать, активен ли встроенный трансген, передается ли он потомкам, обладает ли белок всеми биологическими свойствами его природного аналога и соответствует ли уровень продукции биотехнологическим целям;
6) создание линии (стада) трансгенных животных для научных или биотехнологических целей.
Животные-биореакторы
Получение терапевтически ценных белков человека в молоке трансгенных животных – одно из перспективных направлений современной биотехнологии. Стратегия создания сельскохозяйственных молочных животных в качестве биореакторов основана на введении в управляемую регуляторными элементами одного из «генов молока» коровы, козы или овцы комбинированной генетической конструкции, содержащей последовательность ДНК человека, кодирующую необходимый белок. Согласно этой стратегии, такие трансгенные животные способны синтезировать на высоком уровне белок человека исключительно в молочной железе и секретировать его в молоко, которое в свою очередь становится источником для выделения белка человека.
В настоящее время имеются примеры успешного применения этой технологии, и созданы трансгенные козы, овцы, кролики, свиньи – продуценты человеческих белков: -антитрипсина, сывороточного реактивного белка С, антитромбина, факторов VIII и IX свертываемости крови, лактоферрина, кальцитонина и др. (Wall et al., 1997; Rudolph, 1999; Гольдман и др., 2002).
Фармакологический рынок рекомбинантных белков, полученных из молока трансгенных домашних животных оценивается в 1 млрд долл. в настоящее время и прогнозируется его развитие до 18,6 млрд долл. к 2013 г. (Niemann и др., 2007).
Тестирование новых генно-инженерных конструкций, как правило, производится на трансгенных мышах из-за того, что большинство крупных животных – потенциальных продуцентов лекарственных белков человека имеют длительный репродуктивный период и к тому же дорого обходятся. Анализ генетических конструкций на трансгенных мышах позволяет быстро отобрать из них наиболее перспективные как по уровню продукции заданного белка, так и по его биологическим свойствам.
Проекты по получению трансгенных биореакторов, как правило, состоят из трех частей: создание генетической конструкции, включающей ген человека под управлением регуляторных областей одного из «молочных генов» (например, казеиновых), тестирование ее на трансгенных мышах и, наконец, введение отобранных конструкций в геном молочных животных.

Получение эффективного продуцента – большая удача и гарантия в относительно сжатые сроки создания стада его потомков, обеспечивающих рынок ценным фармакологическим продуктом. При таком стаде создается лаборатория по выделению и очистке рекомбинантного белка, который передается в соответствующие фарминституты для тестирования, проведения его предклинических и клинических испытаний и разрешения применения получаемого лекарства в медицинской практике.
Опыт ведущих фармакологических фирм США, Канады и Англии показывает, что такие проекты длятся около 10 лет при высоком уровне финансирования. С сожалением можно отметить, что в России таких технологий практически нет, как и инфраструктуры для их развития, а это означает, что биологически ценные белки человека мы будем покупать за рубежом. А таких белков уже около 60 (Rudolph, 1999).
К тому же досадно, что российские ученые получили и протестировали на трансгенных мышах несколько эффективных генных конструкций для целей биотехнологии (Завадская и др., 2001; Дворянчиков и др., 2005; Гольдман и др., 1998; Zakharova et al., 2006), однако современных биотехнологических ферм в России нет, и эти разработки пока не используются в полной мере.
Скорее как исключение следует отметить два биотехнологических проекта, развивающихся в России.

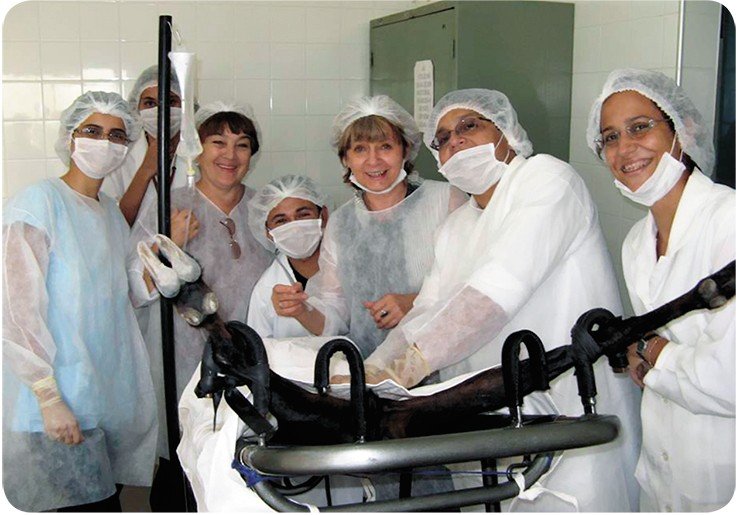
В рамках российско-бразильского проекта, о котором рассказывается выше, участвуют Институт цитологии и генетики СО РАН, Институт молекулярной генетики РАН, Государственный университет Рио де Жанейро (UFRJ) и Университет штата Сеара (UECE), в июле 2006 г. получена трансгенная коза с геном Г-КСФ человека, конструкция предварительно была протестирована на трансгенных мышах (Dvoryanchikov et al., 2005). Статья, посвященная получению трансгенной козы опубликована в Журнале Академии наук Бразилии (Freitas et al., 2007). Осенью 2007 г. эксперимент успешно повторен, и в марте 2008 г. родились три трансгенных козленка, из которых сейчас успешно подрастают только двое – Камилла и Августин.
Второй биотехнологический проект на козах, известный нам пока только из популярной прессы, развивается в совместном российско-белорусском проекте с генетической конструкцией лактоферрина человека. Лактоферрин содержится в женском грудном молоке и является природным антибиотиком, защищающим детский организм от всевозможных болезней. Государственными заказчиками программы выступают Федеральное агентство по науке и инновациям России и Национальная академия наук Белоруссии. Основные исследования проводят специалисты Института биологии гена РАН и Научно-практического центра НАН Белоруссии по животноводству. В конце 2007 г. ученые сумели получить двух трансгенных козлят, которые несут ген лактоферрина человека.
Литература
Гольдман И. Л. и др. Лактоферин: свойства и перспективы биотехнологического производства // Биотехнология. 1998. № 4. С. 3—16.
Гольдман И. Л. и др. Трансгенные козы в мировой фармаиндустрии ХХI века // Генетика. 2002. Т. 38, № 1. С. 5—21.
Завадская Е. С. и др. Получение рекомбинантного эндостатина в молоке трансгенных мышей // Генетика. 2001. Т. 37. С. 1207—1212.
Dvoryanchikov G. A. et al. Secretion of Biologicaly Active Human Granulocyte Colony-Stimulating Factor (G-CSF) in Milk of transgenic Mice // Russian J. of Genetics. 2005. V. 41, N. 10. P. 1088—1094.
Freitas V. J. et al. Production of transgenic goat (Capra hircus) with human Granulocyte Colony Stimulating Factor (hG-CSF) gene in Brazil // Ann. Braz. Acаd. Sci. 2007. V. 79 N. 4. P. 585—592.
Hubel K. et al. Clinical applications of granulocyte colony-stimulating factor: an update and summary // Ann. Hematol. 2003. V. 82. P. 207—213.
Niemann H. et al. Transgenic farm animals: an update // Reprod. Fertil. Dev. 2007. № 19. 762 р.
Wall R. J. et al. Transgenic dairy cattle: genetic engineering on a large scale // J. Dairy Sci. 1997. V. 80. P. 2213—2224.
Wall R. J. Transgenic livestock: progress and prospects for the future // Theriogenology. 1996. V. 45. P. 57.
Zakharova E. S. et al. Transcription and mRNA splicing of the human lactoferrin gene controlled by the regulatory region of the bovine alphaS1 casein gene in the mammary gland of transgenic mice and in mouse embryonic stem cells // Dokl. Biochem. Biophys. 2006. N. 411. P. 336—338.
Фотоматериалы получены совместно с участником проекта Л. Е. Андреевой (к. б. н., с. н. с. Института молекулярной генетики РАН (Москва)).