Можно ли отменить старение?
В своем стремлении увеличить продолжительность жизни исследователи изобретают новые, все более изощренные подходы. Один из них связан с гипотезой о той роли, которую играют в организме накапливающиеся в нем со временем так называемые стареющие клетки. Создавая вокруг себя специфическое микроокружение, они способствуют развитию ассоциированных с возрастом заболеваний, включая рак. Резонно предположить, что избавление от этих примет старения может стать ключом к разгадке природы старения и здоровому долголетию. Поэтому неслучайно, что одна из первых обнадеживающих работ в этом направлении, результаты которой были опубликованы в 2011 г., попала в десятку выдающихся результатов по версии журнала «Science»
Клеточное старение – явление, достаточно давно известное в биологии. После определенного количества делений клетка утрачивает способность к удвоению своей ДНК и, соответственно, к размножению, хотя может еще долго сохранять жизнеспособность и метаболическую активность. Такие клетки называют изношенными или стареющими. Современная наука полагает, что феномен клеточного старения – один из фундаментальных механизмов, способных предотвращать развитие опухолевого процесса в молодом организме, поскольку прекратив делиться, она теряет шанс стать родоначальником опухолевых клеток. Однако в стареющем организме повышается вероятность «сбоев», способных привести к развитию раковых заболеваний. Стареющая клетка секретирует вовне различные вещества, способные нарушать структуру и функцию окружающих ее здоровых клеток. А так как с возрастом количество стареющих клеток в организме увеличивается, то, следовательно, возрастает и масштаб поражения здоровых тканей. По мнению ученых, это может в конечном итоге приводить к развитию ассоциируемых с возрастом заболеваний, в том числе злокачественных опухолей. «Хорошие граждане, но плохие соседи» – так выразилась о стареющих клетках биолог Д. Кампизи из Баковского института изучения старения (Беркли, США) (Campisi, 2011).
Вот такая ирония природы: один и тот же механизм – клеточное старение – в молодом возрасте защищает от развития опухолей, а в старости, напротив, способствует их развитию. Но можно ли решить проблему старения и развития возрастных патологий, удалив из стареющего организма изношенные клетки? Пока этот вопрос является в основном предметом дискуссий, а одна из первых работ, в которой группа исследователей из клиники Майо (Рочестер, Миннесота, США), возглавляемых доктором Я. ван Дьюрсеном, изучила последствия удаления стареющих клеток из организма лабораторных мышей, была отмечена экспертами уважаемого журнала Science (Baker et al., 2011).
Исследователи из группы ван Дьюрсена пытались выяснить, будет ли удаление стареющих клеток из организма влиять на продолжительность жизни и появление у животных признаков старения – снижения плодовитости, потери жировых отложений, развития катаракты и мышечной гипотрофии.
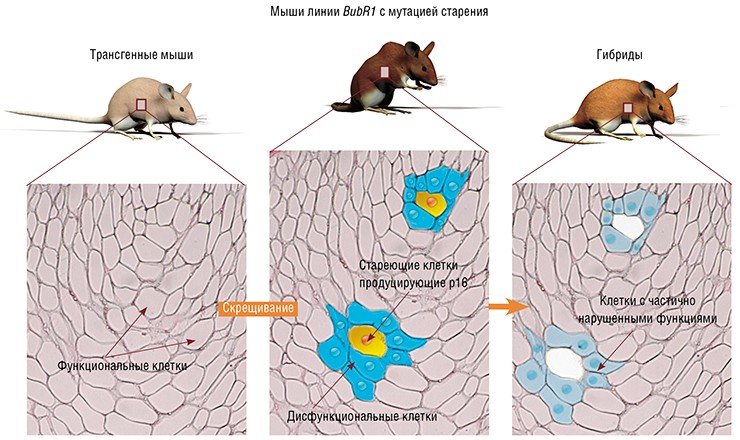
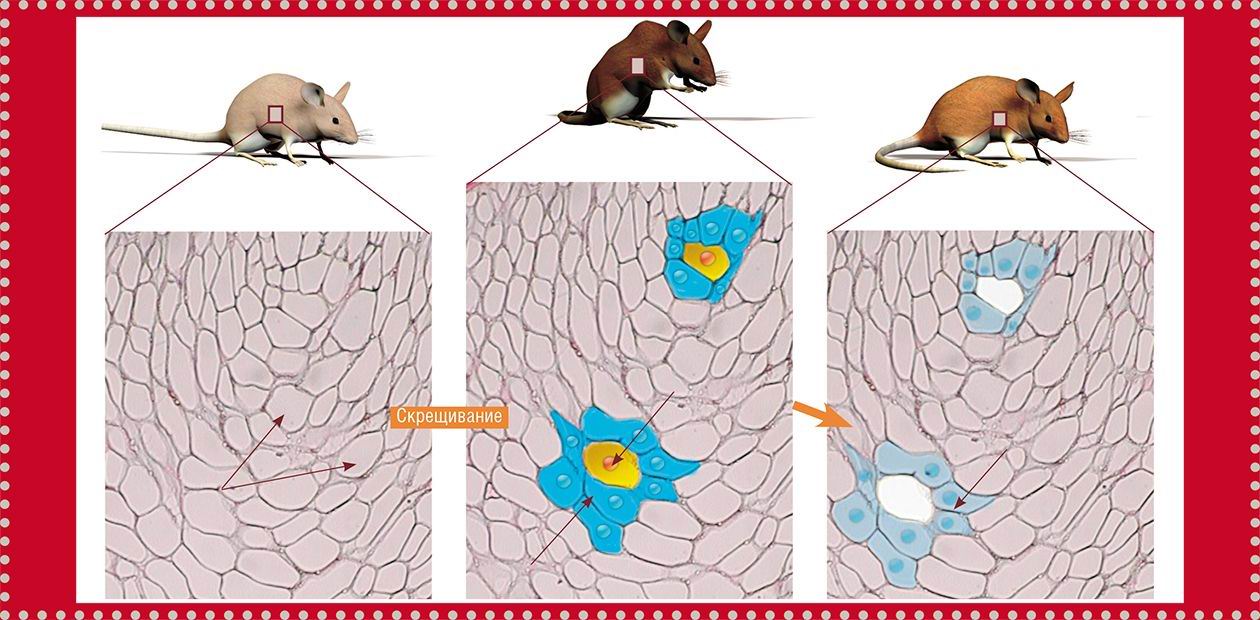
Одна из главных задач, стоявших перед исследователями, заключалась в идентификации и избирательном уничтожении стареющих клеток. Для ее решения сначала на основе гибридов трех линий мышей, каждая из которых обладала высокой вероятностью развития спонтанных опухолей, были «сконструированы» трансгенные мыши. В их геном был встроен искусственно синтезированный фрагмент ДНК. Эта генетическая конструкция содержала ген, кодирующий особый фермент – каспазу-8, способный запускать механизм клеточного самоубийства (апоптоз).
В данном случае ученые воспользовались тем известным обстоятельством, что в стареющих клетках (и только в них) синтезируется особый белок p16Ink4a, что свидетельствует о прекращении клеточного деления. А встроенная в ДНК мышей трансгенная конструкция была организована таким образом, что начинала «работать» одновременно с активацией гена, кодирующего белок p16Ink4a. В результате ферменты апоптоза (правда, в неактивированной форме) синтезировались только в тех клетках, где происходило накопление биохимического маркера старения p16Ink4a. Чтобы подвигнуть такие стареющие клетки к самоубийству, фермент каспазу-8 активировали введением мышам специального препарата АР20187.
Таких трансгенных мышей скрестили с быстро стареющими мышами линии BubR1, продолжительность жизни которых составляет всего около десяти месяцев (против примерно трех лет для обычных мышей) и у которых рано проявляются признаки старческих заболеваний. Полученные в конечном результате гибриды обладали всеми нужными экспериментаторам свойствами: они имели высокую вероятность развития рака и ранние, ярко выраженные признаки старческих заболеваний, и у них можно было селективно и в нужный момент убить стареющие клетки.
Часть гибридных мышей начала получать АР20187 в возрасте трех недель – до того, как стареющие клетки начали разрушать структуру и функцию нормальной ткани; остальные – в возрасте пяти месяцев, когда первые признаки возрастных заболеваний уже появились.
Результаты эксперимента показали, что удаление стареющих клеток в более молодом возрасте благоприятно отразилось на особях – признаки старения у них были существенно менее выражены, чем у их быстро стареющих родителей. В более позднем возрасте эффект также проявился, хотя и гораздо слабее: процесс старения был приостановлен, но «отмены» уже произошедших старческих изменений не происходило.
Интересно, что продолжительность жизни всех мышей экспериментальной группы при этом не увеличилась: она составляла около десяти месяцев, как и у контрольных мышей линии BubR1, после чего животные из обеих групп умирали от остановки сердца.
Результат в целом впечатляющий, учитывая открывающуюся перспективу создания нового подхода к лечению ассоциированных с возрастом и наследственных заболеваний. Однако остается ряд нерешенных авторами проблем.
Во-первых, не получен главный результат: несмотря на замедление проявления некоторых признаков старения, с помощью элиминации стареющих клеток увеличить продолжительность жизни особей не удалось. Удалось только улучшить здоровье и продлить активную жизнь, что, безусловно, также немаловажно.
Во-вторых, нерешенным остался один важный вопрос, имеющий принципиальное значение, – как обстоит дело с развитием опухолей при элиминации стареющих клеток? На авторский запрос доктор ван Дьюрсен ответил, что в эксперименте не наблюдалось развития опухолевого процесса у мышей, несмотря на то, что родительские линии генетически модифицированных мышей отличались высокой частотой спонтанных опухолей. Вероятно, до этого времени особи просто не доживали. Сейчас исследователи повторяют свою работу на обычных мышах, но результаты будут известны не скоро, учитывая продолжительность их жизни.
Нужно отметить, что гипотезу о связи между накоплением продуктов метаболизма стареющих клеток, продолжительностью жизни и развитием опухолевого процесса в той или иной степени подтверждают результаты других исследованиий в области клеточного старения. Так, обнаружено, что угнетать процесс старения клеток могут вещества, ингибирующие белок mTOR-киназу. Хотя этот фермент пока недостаточно изучен, известно, что он участвует в регуляции множества клеточных функций, таких как рост, деление и белковый синтез. Полагают, что угнетение активности mTOR является ключевым звеном в регуляции продолжительности жизни и развитии новообразований (Blagosklonny, 2008).
Веществами, ингибирующими mTOR-киназу (и тормозящими старение клеток), являются, в частности, антидиабетический препарат метформин и иммунодепрессант рапамицин.
Метформин – наиболее часто назначаемый антидиабетический препарат в мировой практике: ежегодно в мире на него выписывается более 120 млн рецептов. По статистике, у больных диабетом, принимавших метформин, риск умереть от рака на 25—40 % меньше, чем у больных, получавших другие противодиабетические препараты – инсулин или препараты сульфонилмочевины, увеличивающие продукцию инсулина в поджелудочной железе (Taubes, 2012).
На сегодня метформин уже спас от смерти от рака больше людей, чем любое другое лекарство. Пока неизвестно, можно ли использовать этот препарат для предотвращения развития злокачественных новообразований у здоровых людей – это задача, которую ученым еще предстоит решить. Но результаты экспериментов, проведенных на лабораторных мышах, показывают, что метформин значительно увеличивает продолжительность жизни особей и тормозит развитие у них опухолей (Anisimov, 2010; Martin-Castillo et al., 2010).
Что касается рапамицина, то он показал схожий эффект в ряде экспериментов на различных линиях лабораторных мышей (Demidenko et al., 2009; Harrison et al., 2009; Cao et al., 2011; Anisimov et al. 2010; 2011). Механизм действия этого препарата был изучен в лабораторных экспериментах в клеточных культурах как грызунов, так и человека. Оказалось, что в присутствии рапамицина отменяется необратимость искусственно вызванной остановки клеточного деления и старения клеток. Было также показано, что рапамицин устраняет генетические дефекты в стареющих клетках больных редким генетически обусловленным синдромом ускоренного старения — детской прогерией Хатчисона-Гилфорда. В результате у таких клеток длительное время сохраняется способность к делению.
Таким образом, вопрос, уменьшает ли удаление из организма «изношенных» клеток риск возникновения раковых заболеваний – второй после сердечно-сосудистых заболеваний причины смертности в современном мире, – остается открытым. Не исключено, что в этом смысле более перспективным будет использование фармацевтических ингибиторов mTOR-киназы, однако это требует дальнейших исследований в приложении к здоровым людям. В любом случае исследования в области клеточного старения нужно интенсивно продолжать, чтобы успешно решать проблемы лечения ассоциированных с возрастом заболеваний в нашем все более «стареющем» мире.
Литература
Anisimov V. N. Metformin for aging and cancer prevention // Aging (Albany NY). 2010. Vol. 2. No. 11. P. 760—774.
Anisimov V. N., Zabezhinski M. A., Popovich I. G. et al. Rapamycin increases lifespan and inhibits spontaneous tumorigenesis in inbred female mice // Cell Cycle. 2011. Vol. 10. No. 24. Р. 4230—4236.
Baker D. J., Wijshake T., Tchkonia T. et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders // Nature. 2011. Vol. 479. P. 232—236.
Demidenko Z. N., Zubova S. G., Bukreeva E. I. et al. Rapamycin decelerates cellular senescence // Cell Cycle. 2009. Vol. 8. P. 1888—1895.
Harrison D. E., Strong R., Sharp Z. D. et al. Rapamycin fed late in life extends lifespan in genetically heterogenous mice // Nature. 2009. Vol. 460. P. 392—396.
Taubes G., Cancer research. Cancer prevention with a diabetes pill? // Science. 2012. Vol. 335. P. 29.