Структура и длина теломер: загадкам нет конца
Хотя теломерной биологии по современным меркам уже немало лет и по этой теме имеется большой экспериментальный материал, вопросов со временем становится больше, чем ответов. Являются ли теломеры «молекулярными часами», отсчитывающими время жизни? Почему у слона они короткие, а у мыши длинные? Почему они могут быть разными у идентичных близнецов? Связан ли размер теломер с размером организма? А от чего зависит активность фермента теломеразы, способного восстанавливать теломеры?
Все же кое-какие закономерности ученым удалось выявить, несмотря на то что эта область науки постоянно преподносит новые сюрпризы
Теломерная биология – это область науки, которая изучает теломеры – концевые районы хромосом, неспособные к соединению с другими хромосомами и в силу этого играющие роль «защитных колпачков». Широкий же интерес к этим структурным элементам хромосм был вызван появлением теории старения, согласно которой этот процесс – следствие укорачивания теломер с возрастом из-за их неполного копирования в процессе удвоения ДНК.
Я вся такая... внезапная, такая противоречивая!
 История теломерной биологии началась в 1930-е гг., когда Г. Мюллер и Б. Мак-Клинток описали теломеры как особые структуры хромосом, не позволяющие им слипаться друг с другом. Понятно, что во времена, когда еще не знали, как закодирована наследственная информация в клетке, установить природу теломер было невозможно. Период активного изучения теломер начался в 1980-х гг. и увенчался Нобелевской премией 2009 г. (Зверева и др., 2010).
История теломерной биологии началась в 1930-е гг., когда Г. Мюллер и Б. Мак-Клинток описали теломеры как особые структуры хромосом, не позволяющие им слипаться друг с другом. Понятно, что во времена, когда еще не знали, как закодирована наследственная информация в клетке, установить природу теломер было невозможно. Период активного изучения теломер начался в 1980-х гг. и увенчался Нобелевской премией 2009 г. (Зверева и др., 2010).
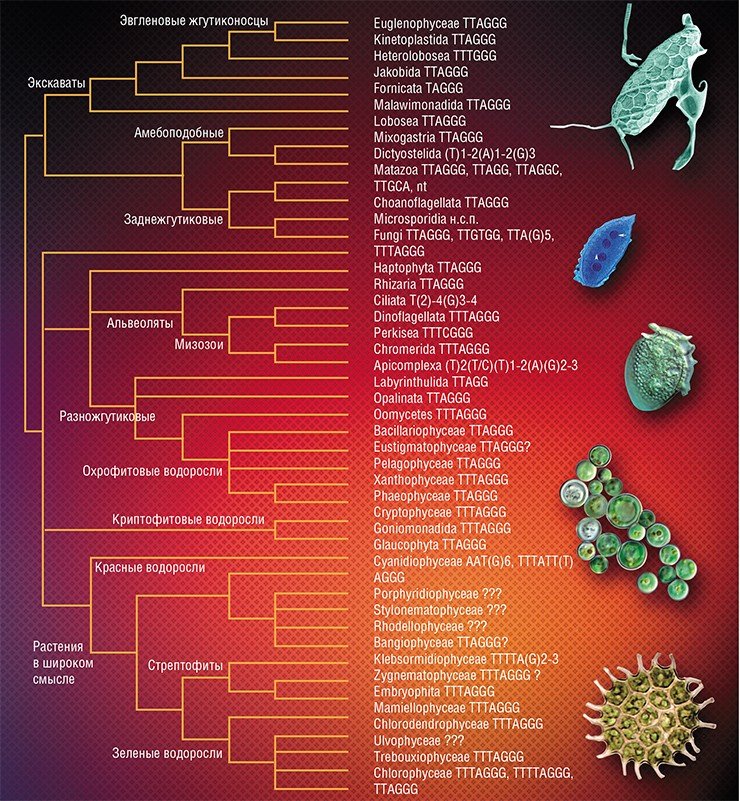
Первым организмом, у которого определили последовательность нуклеотидов теломерной ДНК, была инфузория тетрахимена (Блекберн, 1978). Оказалось, что теломерная ДНК этого простейшего состоит из шести нуклеотидов TTGGGG, повторяющихся четыре-пять раз – такие структуры называют короткими повторами (мини- и микросателлитами). Затем структуру теломерных районов определили у других организмов из разных таксономических групп. Оказалось, что у большинства позвоночных это короткий повтор TTAGGG, у членистоногих (Arthropoda) – TTAGG, у круглых червей (Nematoda) – TTAGGC, у растений – TTTAGGG.
Со временем короткие повторы стали называть согласно таксономической группе, у которой они впервые были прочитаны. В результате TTAGGG стал «позвоночным» или «человеческим» типом теломер, TTAGG – «артроподным», TTAGGC – «нематодным», а TTTAGGG – «арабидопсисным» – по названию растения Arabidopsis thaliana. Позже выяснилось, что эти названия не соответствуют реальному положению вещей. «Позвоночный» тип теломер широко распространен среди беспозвоночных животных – кишечнополостных, плоских червей, моллюсков, встречается у некоторых простейших, членистоногих, растений и грибов, характерен для самого примитивного многоклеточного животного – трихоплакса. Во избежание путаницы было бы разумнее назвать этот теломерный повтор, например, базовым или первичным, но он остался «человеческим». Правда остальные типы повторов, за некоторым исключением, действительно характерны для тех организмов, в честь которых названы.
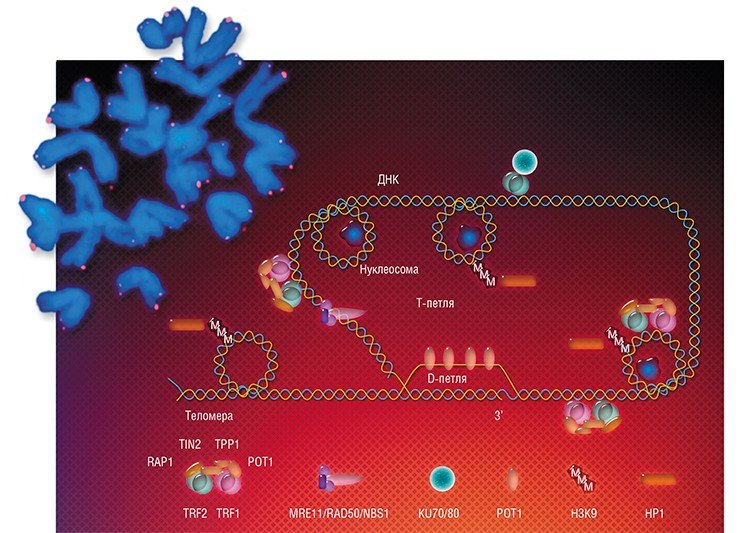
На путанице в названиях дело не закончилось. Достаточно обескураживающим открытием стало то, что не у всех организмов теломеры состоят из микросателлитов. Прежде считалось, что только короткие повторы ДНК консервативной структуры могут защищать концы хромосом, но у двукрылых насекомых и некоторых растений были выявлены теломерные структуры, значительно отличающиеся от типичных коротких повторов.
Так, у комаров рода Chironomus и Anopheles в роли теломер выступает сателлитная ДНК, представляющая собой повторы из нескольких сотен пар нуклеотидов, которые образуют теломерные области в несколько сотен тысяч пар нуклеотидов. У дрозофилы теломеры состоят из перемещающихся по геному мобильных элементов – ретротранспозонов HeT-A, TART и TAHRE. Один из них, TART, был также обнаружен на концах хромосом мухи Rhinchosciara americana. Возможно, нетипичные теломеры характерны для всех представителей многочисленного (более 150 тыс. видов) отряда двукрылых насекомых. Среди растений нетипичные теломеры найдены у некоторых видов подсемейств Alliaceae (луковые), Asphodelaceae (асфоделовые) и семейства Solonaceae (пасленовые): на концах их хромосом локализуются последовательности рибосомальной или сателлитной ДНК.
Более того, существуют промежуточные типы теломер: например, у тутового шелкопряда Bombyx mori теломерная ДНК состоит как из повторов TTAGG, так и из ретротранспозонов TRAS и SART – это говорит об эволюционной связи разных теломерных структур. У некоторых организмов определить структуру теломерных регионов пока не удалось: это тихоходки и поденки среди животных и, например, ульвовые и красные водоросли среди низших растений. Так что, возможно, существуют и другие варианты структуры теломерных районов.
Не только по структуре, но и по длине теломерные участки очень вариабельны. Размер теломер может отличаться на разных плечах одной хромосомы, у гомологичных и негомологичных хромосом, в разных клетках, тканях, органах, у близнецов, у разных индивидов, принадлежащих одному виду, у разных видов. С чем такая изменяемость связана и каково ее функциональное значение, до сих пор не понятно. При этом в исследованиях вариабельность обычно не учитывают, используя в анализе средние значения размера теломер, который определяют, расщепив ДНК изучаемой ткани ферментами рестриктазами, не трогающими теломерную ДНК. Оставшуюся ДНК метят, визуализируют и с помощью специального прибора определяют длину фрагмента самой многочисленной фракции – это и будет средний размер теломер.
Длина теломер всегда вызывала и продолжает вызывать много вопросов. Почему у слона она составляет всего 14 тыс. пар нуклеотидов, а у некоторых линий лабораторных мышей – в 10 раз больше? Есть ли какая-нибудь связь с размером тела? С продолжительностью жизни? С приспособленностью к меняющимся условиям окружающей среды? С болезнями? С наследственностью? Со скоростью старения? Это лишь небольшой перечень вопросов, возникающих в отношении размера теломер, правда на некоторые из них ученые уже нашли ответы.
Размер теломер, размер тела и продолжительность жизни – есть ли связь?
Как уже упоминалось выше, существует теория старения, согласно которой этот процесс происходит вследствие укорачивания теломер с возрастом из-за их неполного копирования в процессе удвоения ДНК. Теломеры называли (а некоторые до сих пор называют) митотическими часами клеток, хронометрами, счетчиками клеточных делений, потому что у человека в клетках тела они укорачиваются с возрастом. Рождается человек с длиной теломер 15—20 тыс. пар нуклеотидов, а умирает с длиной 5—7 тыс. Сейчас известно, что зависимость размера теломер от возрастных изменений не универсальна, длина теломерной ДНК у разных организмов (а иногда и у одного и того же организма) может со временем не только уменьшаться, но и расти, а у многих организмов такой зависимости вообще нет.

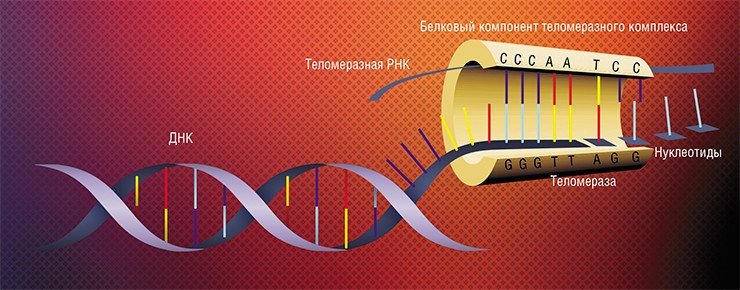
Но все же объяснить различия в длине теломер у разных организмов разной продолжительностью их жизни – красиво и логично. Может быть, долгожители имеют необычайно длинные теломеры? К сожалению, по пальцам одной руки можно пересчитать организмы-долгожители с длинными теломерами. Это некоторые виды долгоживущих (сто и больше лет) черепах с теломерами длиной 50—60 тыс. пар нуклеотидов, аллигаторы, живущие больше полувека с теломерами размером около 30 тыс. пар нуклеотидов. Но у большинства других долгоживущих организмов теломеры довольно скромного размера. Например, у деревьев-долгожителей (более тысячи лет) сосны Pinus longaeva и гинкго Ginkgo biloba длина теломер составляет, соответственно, около 13 и 5 тыс. пар нуклеотидов. То есть длина теломер и продолжительность жизни не имеют явной связи. Другой вопрос, что эти организмы имеют активный механизм поддержания теломерных районов – фермент теломеразу, способную удлинять спонтанно укорачивающиеся при делении клетки теломерные участки ДНК, но это совсем другая история.

Больше повезло ученым, которые искали связь между размером теломер и размером организма. Сначала некоторая зависимость была обнаружена у грызунов: оказалось, что большинство крупных видов имеет короткие теломерные районы (10—18 тыс. пар нуклеотидов), а теломеры небольших грызунов могут достигать 72 тыс. пар (Seluanov et al., 2007). Возникла гипотеза, что эти данные отражают имеющийся у крупных организмов механизм защиты от рака в виде репликативного старения, когда клетки теряют способность делиться. Ведь чем больше в организме клеток, тем больше риск, что какая-то из них переродится в раковую. Тогда все логично: теломерная ДНК должна иметь достаточно небольшую длину, чтобы при постепенном укорочении вовремя запустилось репликативное старение, при этом теломераза, которая может поддерживать длину теломер (как в нормальных клетках, так и в раковых) должна быть неактивна.
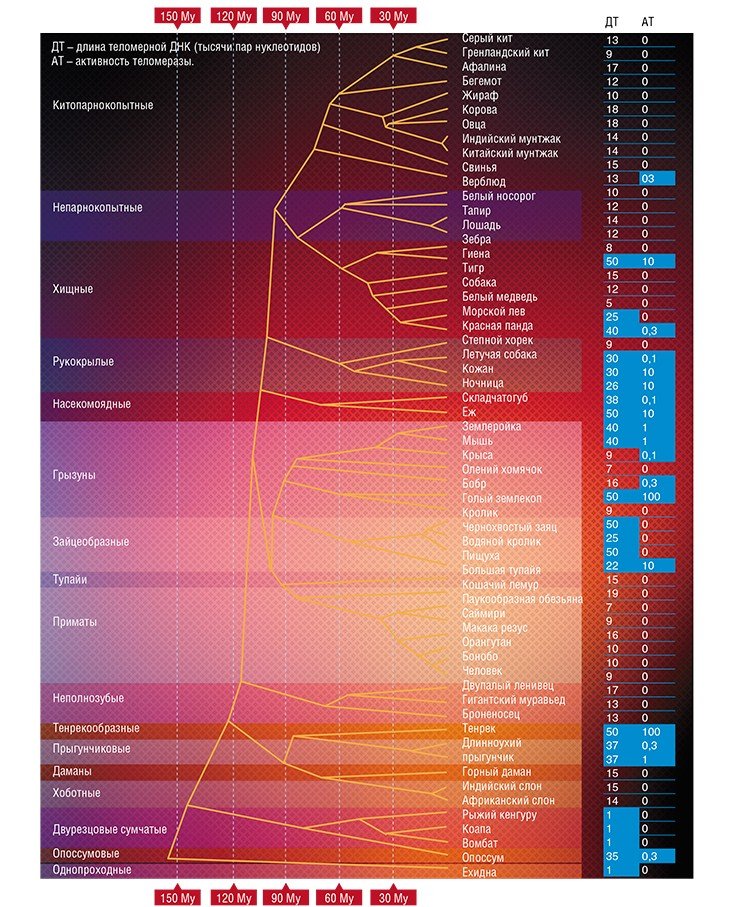
Исследования на других видах млекопитающих частично подтвердили данные, полученные на грызунах: длина теломерной ДНК действительно имеет отрицательную корреляцию с продолжительностью жизни и массой тела, и массивные животные с короткими теломерами не имеют активной теломеразы. Возможно, репрессия теломеразы и наличие более коротких теломер у крупных животных могут быть адаптацией к теплокровности, так как с увеличением температуры тела увеличивается частота мутаций и, следовательно, вероятность возникновения рака (Gomes et al., 2011). У небольших млекопитающих репликативного старения, видимо, нет, а физиологические процессы регулируются иным образом.
Конечно, предложенные объяснения имеют гипотетический характер, они не могут быть универсальными. Подтверждением этому служит, например, исследование длины теломер у байкальских планарий и моллюсков, при котором была обнаружена противоположная картина: более крупные животные имели более длинные теломеры, хотя не без исключений из правила.
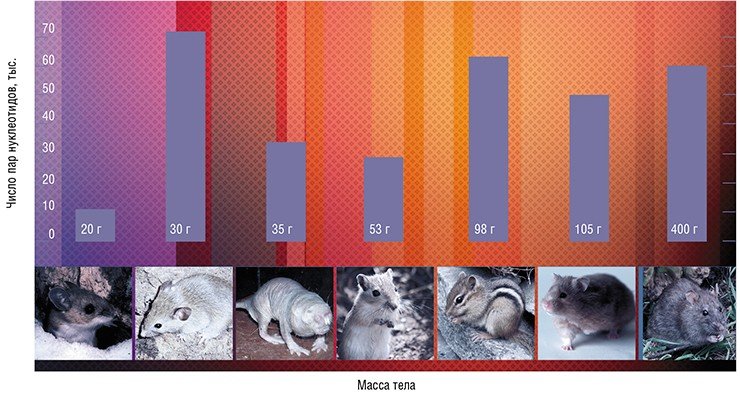
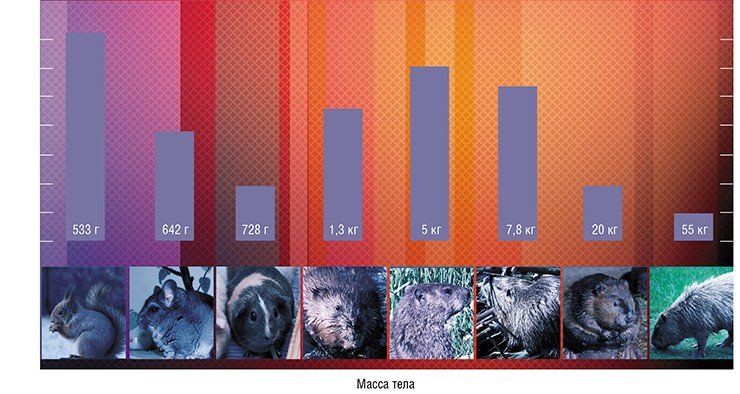
Анализ динамики теломерной ДНК с учетом особенностей этих животных поможет оценить влияние на нее внешних и внутренних факторов. По предварительным данным, во-первых, более крупные виды имеют более длинную теломерную ДНК. Во-вторых, длина теломерной ДНК с возрастом у разных видов животных меняется по-разному: у одних она увеличивается, а у других – уменьшается.
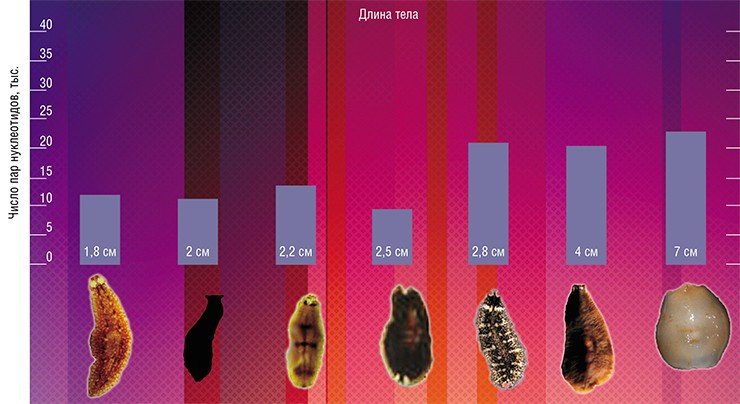
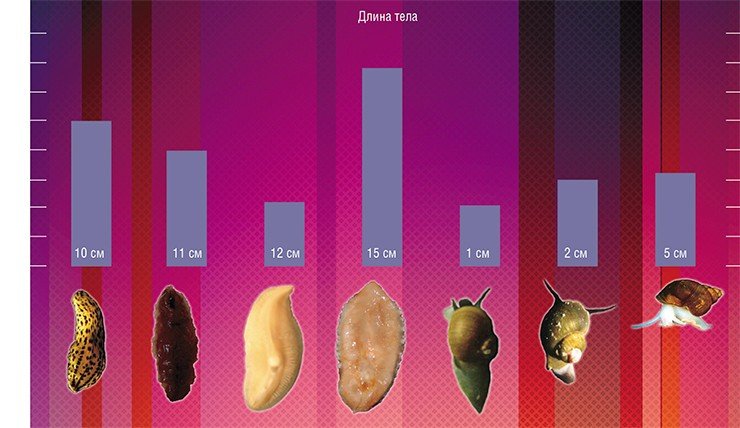
Такая видовая специфичность размера и динамики теломерной ДНК может иметь как адаптивный характер, так и наследственный, определяемый филогенетическим родством. А исследование активности теломеразы, которое тоже планируется осуществить, может пролить свет на внутреннюю причину различий в возрастной динамике теломерной ДНК у разных видов
Нет сомнений, что теломеры вовлечены во многие процессы в клетке, поэтому так трудно найти закономерность в распределении их размеров, и тем более предложить теорию, которая бы обладала предсказательными свойствами. Пока остается лишь перечислять те взаимосвязи, которые все же удалось обнаружить в разных исследованиях.
Одно из таких открытий относится к экстрадлинным (до 1 млн пар нуклеотидов) теломерным районам, которые были обнаружены у некоторых видов птиц. В кариотипах у них присутствуют микрохромосомы, и, возможно, такие аномально длинные теломеры нужны для их стабилизации.
Выше мы затронули лишь некоторые возможные варианты объяснений изменчивости размеров теломер и роли их длины в жизни организма, не коснувшись внутривидовых отличий, связанных с полом, репродуктивным успехом, условиями обитания, образом жизни и т. п. Но даже то, что уже сказано, дает представление о всей сложности и многогранности этой актуальной области биологии.
Литература
Зверева М., Рубцова М. Нобелевская премия по физиологии и медицине 2009 года. Счетчик клеточного времени // Наука и жизнь. 2010. № 1. С. 2—5.
Bombarova M., Vitkova M., Spakulova M. et al. Telomere analysis of platyhelminths and acanthocephalans by FISH and Southern hybridization // Genomes. 2009. V. 52. P. 897—903.
Fulneckova J., Sevcikova, Fajkus J. et al. A broad phylogenetic survey unveils the diversity and evolution of telomeres in eukaryotes // Genome Biol. Evol. 2013. V. 5, N. 3. P. 468—483.
Gomes N., Ryder O., Houck M. et al. Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination // Aging Cell. 2011. V. 10. P. 761—768.
Seluanov A., Chen Z., Hine C. et al. Telomerase activity coevolves with body mass, not lifespan // Aging Cell. 2007. V. 6(1). P. 45—52.
Zellinger B., Riha K. Composition of plant telomeres // Biochim. et Biophys. Acta. 2007. N 1769 (5–6). P. 399—409.
Zhdanova N., Minina J., Karamisheva T. et al. The very long telomeres in Sorex granarius (Soricidae, Eulipothyphla) contain ribosomal DNA // Chromosome Res. 2007. V. 15. P. 881—890