Как наследуется «надгеномная» (эпигенетическая) информация
В череде поколений наследуется не только сама ДНК, но и эпигенетическая информация – молекулярные «метки» на ДНК, определяющие уровень активности генов. Именно таким образом в том числе может передаваться предрасположенность к болезням, например к раку или сахарному диабету. Недавно китайские ученые выяснили, как именно происходит перенос эпигенетических меток с родительской молекулы ДНК на дочернюю при ее удвоении в процессе клеточного деления
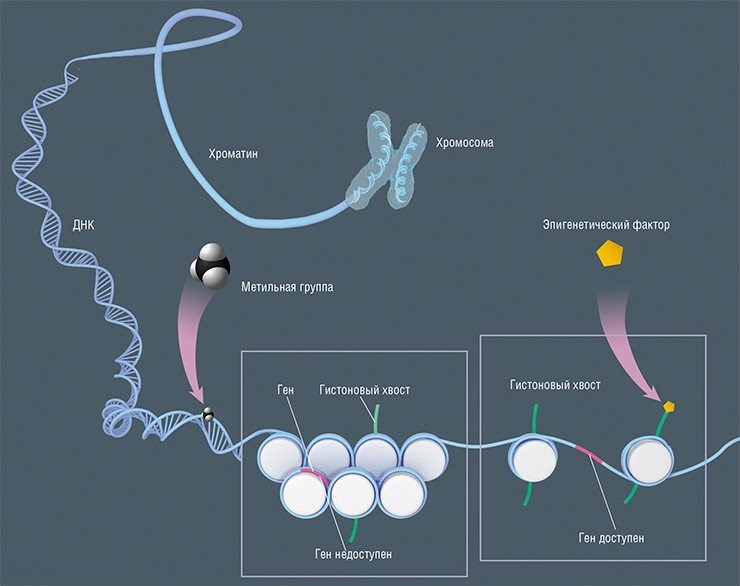
Как известно, вся наша наследственная информация хранится в молекулах ДНК, а сам генетический код можно сравнить с программой, управляющей клеточным развитием и функциями. Но организм состоит из многих типов клеток – мышечных, нервных, эпителиальных, клеток соединительной ткани и т.д., поэтому в разных клетках постоянно активна далеко не вся имеющаяся в них ДНК. Эти различия и определяют особенности в структуре и функционировании разных клеток.
Система регуляции работы генов без изменения нуклеотидной последовательности самой ДНК называется эпигенетической («надгенетической») регуляцией. Она представляет собой два типа молекулярных «выключателей», которые могут «включать» или «выключать» гены, не изменяя их молекулярную структуру. Один из них – метилирование, присоединение к определенному участку ДНК метильной группы, в результате чего азотистое основание цитозин превращается в 5-метилцитозин, а ген теряет свою работоспособность.
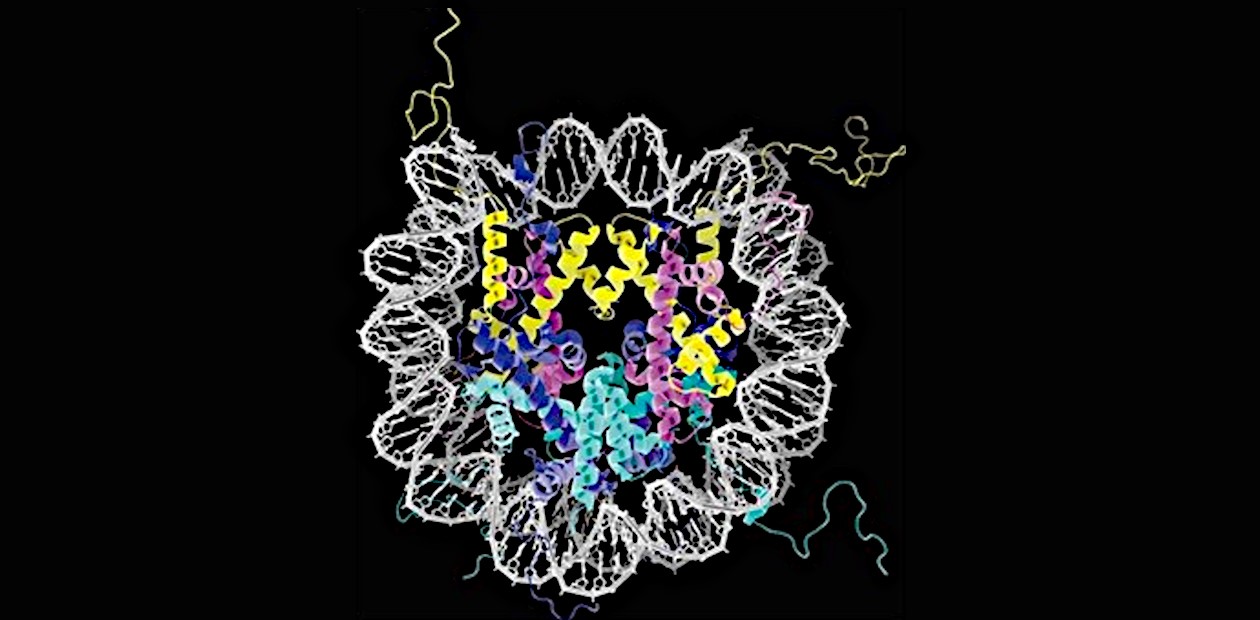
Другой способ эпигенетической регуляции основан на модификациях белков-гистонов, на которые в ядре клетки намотана, как на катушки, нить ДНК. Одна такая нуклеосома содержит примерно 147–150 пар нуклеотидов ДНК, обернутых вокруг двух белковых димеров H2A-H2B и одного тетрамера H3-H4. Чем плотнее упаковка в катушке, тем менее доступна ДНК для ферментов – гены в области такой упаковки будут неактивны. Получить ферментам доступ к этому участку ДНК позволяет модификация гистонов, которая способствует более свободному расположению нуклеосом.
Во время репликации (копирования) ДНК при делении клетки происходит «раскручивание» двойной цепочки ДНК с помощью ферментов хеликаз. Затем посредством ферментов ДНК-полимераз, которые могут по одной цепочке ДНК «собирать» комплементарную цепочку, образуются две «новые» молекулы ДНК. При этом родительские нуклеосомы, несущие модифицированные гистоны (эпигенетические метки), «разбираются» и затем заново «собираются». Это обеспечивает точную передачу эпигенетической информации новым клеткам во время клеточного деления. Однако точный молекулярный механизм, с помощью которого эпигенетическая информация передается в процессе репликации ДНК, был не очень ясен.
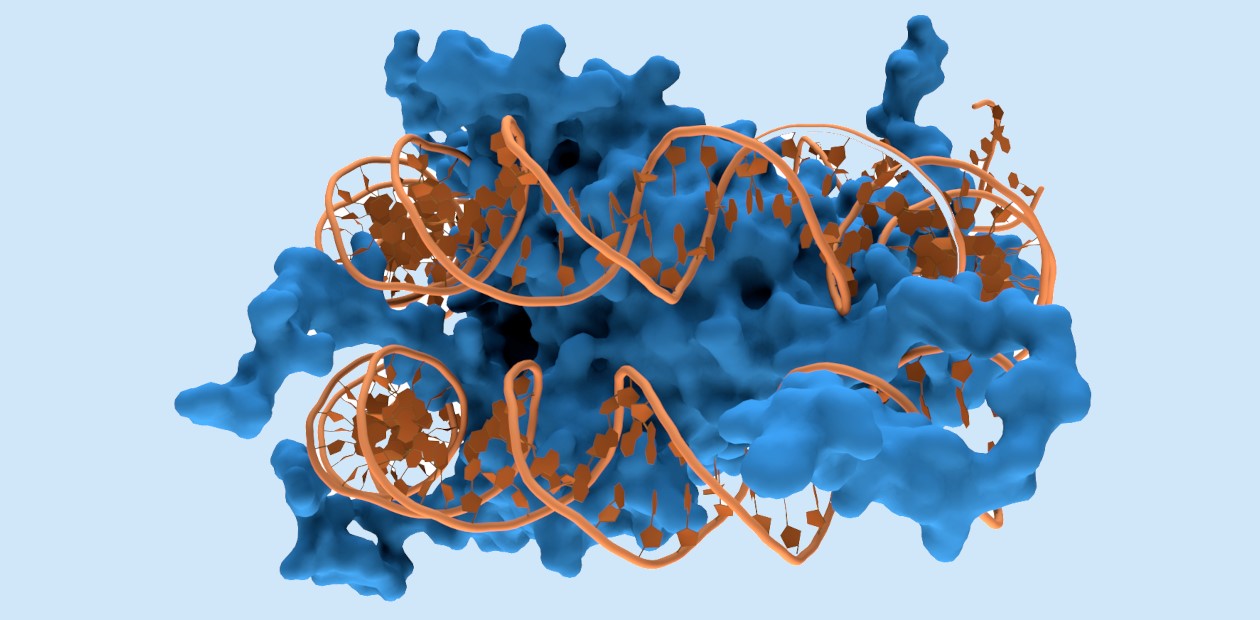
Ранее исследователи из Китая добились значительного прогресса в понимании этого сложного процесса, а сейчас с использованием криоэлектронной микроскопии выяснили ключевой момент переноса родительских гистонов на примере клеток пекарских дрожжей (Saccharomyces cerevisiae).
В процессе репликации участвуют многочисленные дополнительные белковые факторы. Один из них – белковый комплекс гистоновый шаперон FACT, который взаимодействует с родительскими гистонами. Шапероны – это белки, главная функция которых состоит в правильной пространственной укладке как белковых молекул, так и их комплексов.
Во время разборки родительской нуклеосомы на репликационной вилке (Y-образной структуре на родительской спирали ДНК в месте расхождения двух цепей) ее гистоны расщепляются на гексамер и димер H2A-H2B. Гексаметр образует комплекс с шапероном FACT, а димер «вытесняется» белком Mcm2, который облегчает последующий перенос родительских гистонов с комплекса на вновь синтезированные цепи ДНК. В какой-то момент образуется «гибридная нуклеосома» более «свободной» конструкции, в которой могут идти дополнительные молекулярные взаимодействия и достройка дочерних гистоновых комплексов.
Понимание сложного процесса сохранения и передачи последующим поколениям «гистоновой» эпигенетической информации имеет не только фундаментальное, но и практическое значение. Подобные знания помогут глубже исследовать молекулярные основы развития болезней, что открывает новые возможности для терапевтических вмешательств, связанных с изменением эпигенетических модификаций, к примеру для лечения рака.
Публикации по теме:
Как писать и переписывать партитуру ДНК