Новые возможности терапии болезни Шарко
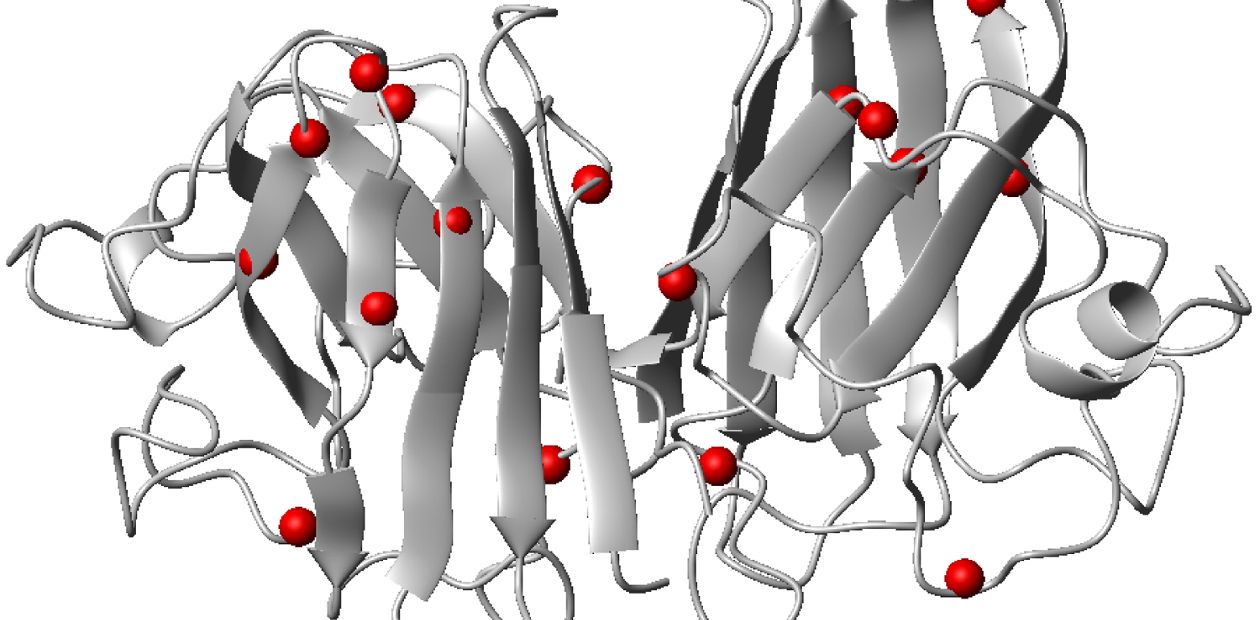
Боковой амиотрофический склероз встречается примерно у 1-5 человек на 100 тысяч. Одна из известных причин болезни – мутации в гене, кодирующем фермент SOD1 – медь-цинк зависимую супероксиддисмутазу. Этот антиоксидантный белок отвечает за разрушение ряда активных форм кислорода, повреждающих клеточные макромолекулы. В норме SOD1 функционирует в виде димера, но определенные мутации в гене SOD1 приводят к тому, что димер становится нестабилен, и белок организуется в тримеры – комплексы, состоящие из трех молекул. Такие комплексы токсичны и разрушают двигательные нейроны. При этом случается, что мутаций в гене SOD1 не обнаружено, но белок SOD1 все равно участвует в формировании токсических агрегатов в клетках больных людей.
Ученые из университета Северной Каролины предположили, что если удастся стабилизировать SOD1 так, чтобы димеры не распадались на мономеры, это позволит предотвращать заболевание. Поскольку тримеры SOD1 формируются и распадаются довольно быстро, исследователи обратились к технологиям компьютерного моделирования, чтобы предположить, какие типы модификаций могут способствовать агрегации, а какие – предотвращать ее.
Эксперимент провели на культуре клеток, подобных двигательным нейронам, которая уже использовалась как модельный объект для изучения молекулярных механизмов патогенеза бокового амиотрофического склероза. Клетки имели в гене SOD1 мутацию A4V, вызывающую формирование неправильного белка. Это одна из самых распространенных ассоциированных с данным заболеванием мутаций у населения Северной Америки. Ученые внесли в структуру гена SOD1 еще одну мутацию, которая должна бы, согласно расчетам, стабилизировать белок, и обнаружили, что клетки действительно перестали погибать.
Результаты исследования открывают новые возможности для разработки терапии бокового амиотрофического склероза и помогают понять, почему одни люди заболевают им, а другие нет. Внесенная в ген SOD1 клеток мутация имитирует фосфорилирование, присоединение остатка фосфорной кислоты к одной из аминокислот белка. Можно предположить, что это фосфорилирование является естественным механизмом стабилизации SOD1 у здоровых людей, а дефекты, ведущие к его уменьшению, играют роль в дестабилизации SOD1 даже у людей без вредных мутаций в этом гене.
Фото: https://commons.wikimedia.org
Подготовила Мария Перепечаева