О двухметровой ДНК, достоинствах фрактальной упаковки и генетической «робастности» как мериле долголетия
У всех высших организмов, включая человека, совокупная длина ДНК в каждой клетке составляет около двух метров! И этот чрезмерно длинный полимер должен каким-то образом разместиться в клеточном ядре, диаметр которого в обычной соматической клетке составляет всего 10 мкм, а в том же сперматозоиде – в 5—10 раз меньше. Каким же образом клетке удается «убить сразу двух зайцев» – компактно упаковать ДНК с сохранением возможности считывания генетической информации, и как работают такие «упакованные» гены? Ответ на этот вопрос – в журнале «Наука из первых рук» в интервью Юрия Мошкина, выпускника ФЕН НГУ, PhD (Женевский университет, Швейцария), заведующего лабораторией системной генетики Института цитологии и генетики СО РАН (Новосибирск)
Как упакуем?
Проблема упаковки ДНК в хромосомах клеточного ядра эукариотических организмов была поставлена еще в середине 1970-х гг.: этими исследованиями занялись несколько групп ученых, включая Нобелевского лауреата по химии Роджера Корнберга. Рассматривая молекулу ДНК в электронный микроскоп, исследователи обнаружили, что она очень напоминает бусины, нанизанные на нитку. Выяснилось, что «бусины» (нуклеосомы) состоят из специальных белков (гистонов), на которые, как на валик, намотана в два оборота нить ДНК (порядка 150 пар нуклеотидов). Затем идет «нитка» – свободный участок (линкер, длиной 10—30 пар нуклеотидов), затем – следующая «бусина» и т.п. Всего же в каждой нашей клетке находится около 25 млн таких валиков, на которых размещено 70—90% всей клеточной ДНК. Так как диаметр каждой «бусины» с намотанной на ней ДНК составляет порядка 10 нм, то часто ДНК, упакованную в нуклеосомы, называют 10 нм хроматиновой фибриллой.
Но этот уровень упаковки ДНК недостаточен – она все еще остается слишком длинной. Поэтому «бусины» укладываются в упорядоченные «стопки», которые перекручиваются одна вокруг другой, – так образуется соленоид диаметром 30 нм, что в итоге дает 30 нм хроматиновую фибриллу. Такая структура формируется спонтанно как за счет образования межмолекулярных водородных связей между гистонами, так и за счет связывания гистона H1 с линкерными участками ДНК. Однако вопрос, действительно ли ДНК упаковывается в клетке в столь организованную структуру, как соленоид, до сих пор остается открытым.
Но упаковка ДНК как в десяти нанометровые, так и в тридцати-нанометровые хроматиновые фибриллы все еще не обеспечивает ее достаточной компактизации: с помощью первого способа можно «укоротить» ДНК в 5—10 раз, второго – в 50 раз, т.е. Конечно, здесь мы немного лукавим, ведь наша ДНК не едина, а разделена на хромосомы, которых в соматической клетке 46 штук. Но даже учитывая обстоятельство, что при таком уровне упаковке длина одной хромосомы уменьшится примерно до 800 мкм, все равно трудно представить, чтобы она уместилась в клеточном ядре размером почти в 100 раз меньше. Поэтому хроматиновые фибриллы сворачивается во фракталы.
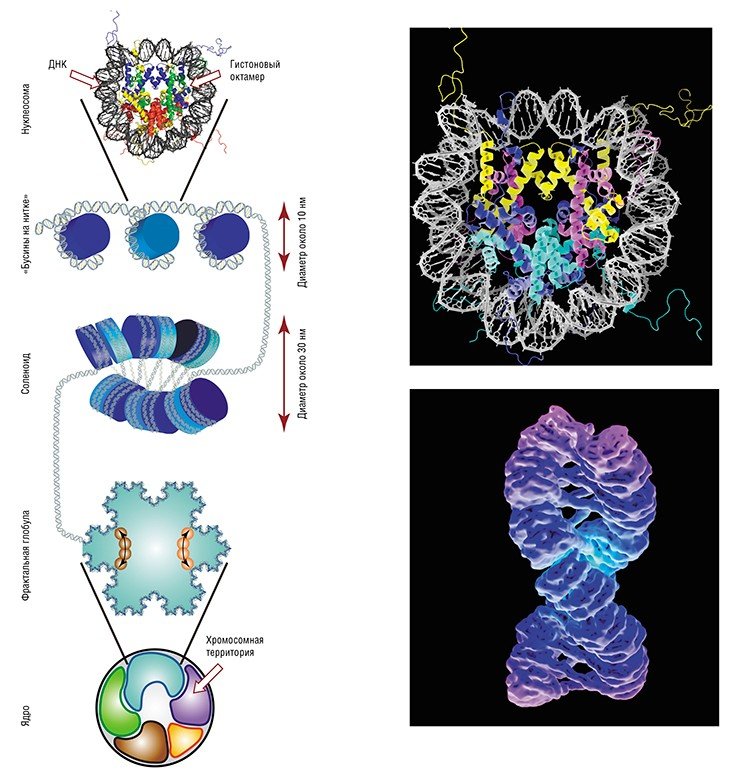
Фрактальная глобула образуется за счет взаимодействия участков ДНК на коротких и длинных расстояниях, и хромосома занимает наконец свою так называемую «хромосомную территорию». Фрактальная структура позволяет упаковать в конечный объем объект практически бесконечной длины, причем так, что межхромосомные контакты будут маловероятны. Конечно, поддержание такой структуры требует определенных затрат энергии, но они окупаются, так как в результате автоматически достигается изолированность друг от друга нитей ДНК разных хромосом, которые теперь не могут спутаться. В противном случае было бы гораздо дороже «распутывать» нити ДНК, разрезая и сшивания их во время митотического деления клетки, когда надо быстро и точно поделить между дочерними клетками наследственный материал.
Расставим барьеры
Итак, задача упаковки ДНК в ядро решена, но теперь возникает другой вопрос – как до нее добраться белкам, копирующим и считывающим информацию с матрицы ДНК? Для большинства этих белков она будет просто недоступна, во-первых, из-за взаимодействия ДНК с гистонами. Во-вторых, благодаря сильной деформации (изогнутости) нити ДНК, из-за чего многие белки не могут распознать на ней места своего связывания – сайты посадки. Как же природа решает эту проблему?
Есть такие ферменты – АТФ-зависимые хроматин-ремоделирующие белки. Эти крупные молекулы способны своими «руками» хвататься за два разных участка ДНК и, используя энергию АТФ, «схлопываться», отрывая таким образом участок ДНК от нуклеосомы. В результате образуется петля, и когда белок снова «развернется», то нуклеосома, как будто после удара плетки, изменит свое положение в пространстве. Получается что-то вроде знаменитого йо-йо на веревочке. В результате в тех или иных участках ДНК открываются (или закрываются) сайты посадки для ДНК-связывающих белков таких, как белки транскрипции, синтезирующих РНК по матрице ДНК.
Хроматин-ремоделирующих белков, которые постоянно «толкают» нуклеосомы, в ядре много. Но делают ли они это «целенаправленно» или спонтанно? Исходя из наших данных, хроматин-ремоделирующие белки не имеют каких-либо предпочтений к тем или иным генам, и расталкивание нуклеосом происходит по всей длине хроматиновой фибриллы. Как результат, при увеличении или уменьшение концентраций хроматин-ремоделирующих белков в клетке меняется динамика нуклеосом, которые повсеместно переползают с одних участков ДНК на другие.
Итак, несмотря на то, что гистоновые «бусины» имеют некоторые предпочтения к определенным последовательностям ДНК, под действием хроматин-ремоделирующих белков они, как йо-йо, находятся в постоянном движении, зачастую занимая энергетически невыгодные позиции, как, например, в «жестких» участках ДНК.
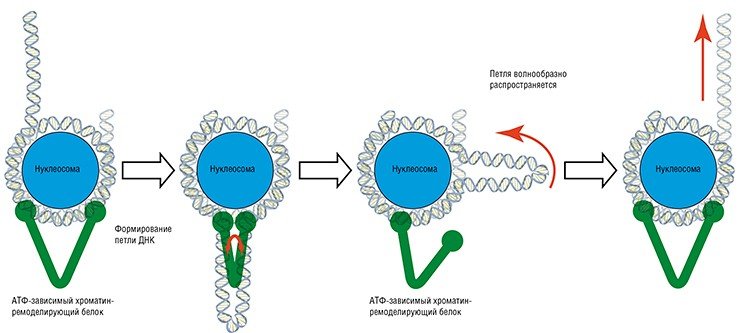
Еще один механизм организации нуклеосом связан с потенциальными барьерами и ямами. Представим, что в результате энергичной «болтанки» нуклеосом под действием хроматин-ремоделирующих белков произошла успешная посадка ДНК-связывающего белка на свой сайт. В этом случае такой белок будет представлять собой барьер, ограничивающий движение нуклеосом. Аналогичным образом, если мы зафиксируем тем или иным способом одну из бусин на нитке ДНК, то это также создаст барьер, который, правда, в физике будет называться энергетической «ямой». Теперь нуклеосомы, отталкиваясь от барьеров и ям, будут самоорганизовываться примерно также, как наши планеты выстраиваются относительно гравитационного поля Солнца.
Известно, что ген может находиться в двух состояниях – активном и неактивном. Когда гены «выключены», то расположение нуклеосом относительно друг друга определяется во многом ДНК-последовательностью и активностью хроматин-ремоделирующих белков. Теперь, если мы сопоставим расположение нуклеосом для разных «молчащих» генов относительно их начала (старта транскрипции), то результат будет выглядеть так, как будто «бусины» нанизали на нити ДНК в произвольном порядке.
Иное дело, когда мы имеем дело с «включенными» генами». В этом случае РНК-полимераза со своей «свитой» (различными белковыми факторами, регулирующими РНК-полимеразу) садится на ДНК в самом начале гена. Этот массивный белковый комплекс уже сам по себе представляет из себя существенный барьер, но для «надежности», как показали наши расчеты, РНК-полимераза «привязывает» первую (+1) нуклеосому в начале гена. Это, в свою очередь, приводит к возникновению потенциальной ямы, относительно которой и выстраиваются остальные «бусины». В результате, сопоставив расположение нуклеосом в активных генах относительно старта их транскрипции, мы увидим стройные ряды фазированных «бусин».
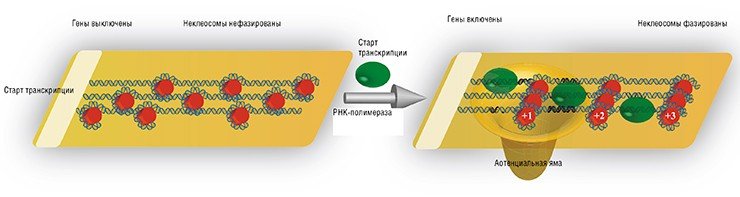
В подобном «фазировании» нуклеосом, возможно, есть немалое преимущество. Если представить транскрипцию в виде бега с барьерами, где РНК-полимераза – бегун, а нуклеосома – барьер, то если препятствия стоят упорядоченно, бегун уверено проходит дистанцию с четким ритмом. Если же переставить барьеры случайным образом, то наш бегун – РНК-полимераза, будет спотыкаться, теряя ритм и темп. Конечно эта гипотеза требует дальнейшей проверки, но, как мы увидим дальше, дистанция между барьерами существенно влияет на экспрессию генов.
Резюмируя, отметим, что глобальное динамическое равновесие в расположении «бусин» поддерживается все же ДНК последовательностью и ее способностью к сгибанию, на что уже накладываются другие факторы, такие как активность хроматин-ремоделирующих белков, расстановка потенциальных барьеров и ям и т.п. Правда, пока мы не знаем, как местоположение «бусин» влияет на формирование фрактальных петель при упаковке ДНК в ядро, и как связать одномерную структуру с трехмерной. Однако решение этой задачи необходимо для полноты понимания процессов, благодаря которым ДНК сворачивается внутри ядра. Это, в свою очередь, даст возможность ответить на ряд ключевых вопросов, касающихся пространственной организации генома и его функционирования в упакованном состоянии внутри ядра. Решение этой проблемы требует комплексного подхода с тесным взаимодействием между биологами и физиками.
Бег с барьерами
Разобравшись с проблемами упаковки ДНК и расставив барьеры, рассмотрим, каким образом они связаны с регуляцией генов, и зададим провокационный. вопрос: не исчерпала ли себя модель генетической регуляции Нобелевских лауреатов Ф. Жакобa и Ж. Моно?
В классической модели Жакоба и Моно регуляция рассматривается с точки зрения включения или выключения генов в ответ на вне- и внутриклеточные сигналы. Например, если мы заменим глюкозу на лактозу в среде, в которой растут бактерии, то включатся гены, отвечающие за метаболизм лактозы. И, как выразился Жак Моно: «что верно для бактерии, то верно и для слона» – гены человека и любых других организмов работают по схожим принципам. Но как в эту схему вписать регуляцию экспрессии генов на уровне упаковки ДНК в нуклеосомы?
Дело в том, что модель Жакоба и Моно по своей сути генно-центрическая. Иными словами, регуляция рассматривается как процесс, независимый для каждого конкретного гена. Однако представим, что мы добавили некоторое число бусин на нитку ДНК. Естественно, это приведет к подталкиванию соседних бусин, что в конечном итоге приведет к изменению как плотности, так и позиций бусин вдоль всей нитки. Иными словами, локальные изменения в размещении нуклеосом на ДНК могут распространяться по всей ее длине, что автоматически повлияет на работу всех генов. Действительно, наши результаты показывают, что удаление АТФ-зависимых хроматин-ремоделирующих белков или изменение концентрации гистонов приводят к тотальным изменениям в расположении нуклеосом. Таким образом, трудно представить, что регуляцию на уровне размещения нуклеосомы можно адекватно описать генно-центрической моделью Жакоба и Моно, а значит, нужны другие идеи и подходы.
Выше мы уже рассмотрели идею, что процесс синтеза РНК, при котором РНК-полимераза бежит по упакованной в нуклеосомы матрице ДНК, можно представить как бег с барьерами. Расстановка барьеров, т.е. расстояние между нуклеосомами, определяется АТФ-зависимыми хроматин-ремоделирующими белками. Если, к примеру, удалить один из ремоделирующих белков – MI-2, то расстояния между нуклеосомами увеличится, если же ISWI – уменьшится. Однако несмотря на разнонаправленные эффекты в расстановке барьеров, вызванные удалением этих белков, мы наблюдаем схожие изменения в работе (экспрессии) генов. Как оказалось, наиболее чувствительны к подобной перестановке короткие гены – при удалении ремоделирующих белков уровень их экспрессии падает. Действительно, при беге на короткие дистанции любые изменения в расстановке барьеров критичны, ведь спортсмен (наша РНК-полимераза) подстраивается под определенный ритм и шаг.
В случае с длинными генами ситуация несколько иная. Ведь при беге на длинные дистанции наш бегун, даже если споткнулся, всегда может нагнать. Однако в случае длинных генов РНК-полимераза часто застревает на самом старте, что связано с трудностями преодоления первого барьера, т.е. той самой первой нуклеосомы, формирующей потенциальную яму. Интересно, что при удалении ремоделирующих белков сила связывания первой нуклеосомы ослабевает и, условно говоря, высота барьера уменьшается. Теперь РНК-полимеразе легче уйти со старта, что приводит к росту экспрессии длинных генов.
Voi la – оказывается, нам и не надо придумывать какие-то сложные модели, чтобы описать, как расстановка нуклеосом влияет на работу генов. Достаточно просто знать их длину!
Смерть уклонистам
К счастью для нас, это еще не все. Модель Жакоба и Моно рассматривает регуляцию экспрессии генов только в рамках «включено/выключено» или «больше/меньше». То есть в большинстве случаев мы исследуем, как меняется средний уровень экспрессии тех или иных генов в ответ на те или иные воздействия. Но помимо средней, есть еще и дисперсия! И этот параметр мы часто игнорируем, списывая на ошибки эксперимента. Но так ли это в действительности?
Считается, что система устойчива, если следует закону Пуассона, при котором дисперсия равна математическому ожиданию (оно же арифметическое среднее). Грубо говоря, мы можем взять сотню клеток и померить экспрессию какого-то гена, т.е. количество синтезируемых молекул РНК. Если система находится в полном равновесии и константы синтеза и деградации не меняются со временем, она будет подчиняться закону Пуассона: число молекул, которое будет синтезироваться и разрушаться за определенное время, не будет меняться, а величина дисперсии не будет превышать среднюю.
Но в живых системах, как выясняется, постоянно происходят серьезные отклонения от пуассоновского процесса, когда дисперсия начинает превышать среднее. И мы постоянно видим это, когда анализируем данные по РНК-секвенированию. Биологическая система никогда не находится в равновесии – для природы это закон. И статистически мы можем оценить величину этого отклонения для каждого активного гена.
В английском языке существует термин робастность, который на русский приблизительно переводится как «помехоустойчивость». Робастность как раз и отражает степень устойчивости системы и может быть выражена через дисперсию, а точнее, через коэффициент вариации – дисперсию, нормированную на среднюю величину. Сейчас, подходя к пониманию принципов регулирования равновесия генов, мы начинаем делить гены на робастные (устойчивые, стабильные) и шумные. При этом мы можем предсказать, каким будет тот или иной ген, исходя из определенных характеристик последовательности его ДНК.
Но на робастность влияет также ряд других факторов, в том числе и расстановка барьеров. Например, мы выяснили, что фазирование нуклеосом относительно начала генов более четкое именно для робастных генов, экспрессия которых наименее отклоняется от пуассоновского процесса. Иными словами, чем лучше расставлены барьеры, тем надежнее бежит РНК-полимераза, и тем стабильнее экспрессия гена. Теперь, если удалить хроматин-ремоделирующие белки из клетки и переставить барьеры, устойчивость системы упадет, что выразится в повсеместном увеличении дисперсии. Значит, ремоделирующие белки отнюдь не селективны, но при этом влияют на стабильность всей биологической системы, сдвигая динамическое равновесие «бусин».
Стоит отметить, что мутации хроматин-ремоделирующих белков очень часто всплывают в скрининговых исследованиях генетической компоненты развития раковых опухолей. Что вполне логично в рамках нашей идеи. Вся эта машинерия, обеспечивающая упаковку ДНК, в большой степени необходима именно для удержания системы в равновесии. Ведь когда увеличивается разброс уровней экспрессии генов в клетках, возрастает вероятность возникновения и отбора жизнеспособных «опухолевых» комбинаций: достаточно появиться лишь одной такой клетке, и она «выстрелит».
К примеру, на примере дрозофил было обнаружено, что при одинаковых условиях эксперимента удаление одного и того же ремоделирующего белка может привести как к увеличению пролиферации клеток, так и к клеточной гибели. Эта картина хорошо вписывается в гипотезу о спонтанном развитии рака, когда в ходе онкогенеза большая часть образовавшихся «аномальных» клеток отмирает, но те немногие, что выживают, начинают неконтролируемо делится.
Так все ли можно описать моделью Жакоба и Моно? Или идеи о поддержании системы в равновесии на уровне нуклеосом помогут выработать нам новый взгляд на здоровье и долголетие человека?
В публикации использованы рисунки Ю. Мошкина
Подготовили Лариса Овчинникова и Мария Перепечаева