Лечить не болезнь, а больного
Широко известный принцип, что «лечить нужно не болезнь, а больного», был провозглашен еще знаменитым врачевателем древности Гиппократом.
Однако многим из нас довелось убедиться на собственном печальном опыте, что современная медицина ориентирована на лечение «отдельных симптомов» у некоего среднестатистического человека. И все же «свет в конце тоннеля» виден: в нашу «постгеномную эру» благодаря новейшим достижениям молекулярной биологии появилось и находит все более широкое распространение понятие «персонализированная медицина». Это дает надежду, что индивидуальный подход к медицинской помощи наконец станет реальностью
Даже древние целители, зачастую имевшие смутные представления о деятельности и строении человеческого организма, считали важным дифференцированно подходить к лечению своих пациентов. Занимаясь, пусть и не всегда успешно, восстановлением «природной гармонии» или «баланса телесных соков» больного, они старались учитывать его физическую конституцию, образ жизни, характер питания и даже особенности места проживания.
Позже, с развитием так называемой классической медицины и появлением ряда новых естественнонаучных дисциплин, таких как анатомия, физиология, биохимия и фармакология, врачи научились справляться с массой недугов, считавшихся ранее неизлечимыми. Но при этом медицина стала во многом «обезличенной», и место реального страдающего человека занял обобщенный статистический образ. Лишь в некоторых случаях (например, при переливании крови или трансплантации тканей) специалисты были вынуждены в обязательном порядке учитывать индивидуальные особенности организма больного.
Но развитие, как известно, всегда идет по спирали. Поэтому неудивительно, что, начиная с конца прошлого века, в специализированной литературе появился и стал все чаще использоваться термин индивидуализированная (персонализированная) медицина. Речь идет о новой модели организации медицинской помощи, которая позволит выбирать диагностические, лечебные и профилактические средства, оптимальные для конкретного человека с учетом его генетических, физиологических и биохимических особенностей. Конечная цель такой медицины – сделать профилактику и лечение болезней при наименьших затратах как можно более эффективными и безопасными.
Молекулярная биология как точка опоры
Фундаментом для развития персонализированной медицины стали выдающиеся успехи, достигнутые в молекулярной биологии за последние десятилетия.
Отправной его точкой стал знаменитый международный проект «Геном человека», стартовавший в 1990 г. Его цель состояла в расшифровке полной нуклеотидной последовательности ДНК и установления точной локализации отдельных генов в нашем геноме. Результаты этого проекта, выразившиеся, в том числе, и в бурном развитии технологий массового секвенирования ДНК, позволили медицинской генетике вплотную приблизиться к клинической практике.
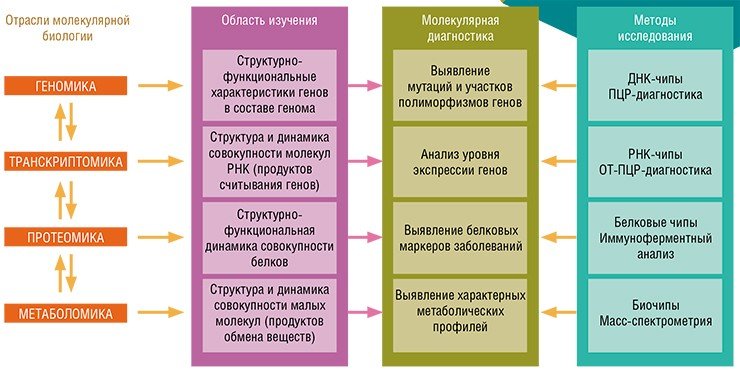
Дальнейшее развитие персонализированной медицины тесно связано с обособлением новых биологических дисциплин, занимающихся изучением различных уровней реализации информации, заключенной в геноме: транскриптома – совокупности продуктов транскрипции (считывания) генов; протеома – совокупности всех белковых молекул и, наконец, метаболома – совокупность относительно небольших молекул-метаболитов, конечных продуктов обмена веществ.
Фармацевтические приложения вышеперечисленных дисциплин – фармакогенетика, фармакогеномика и фармакопротеомика – стали важнейшими основами персонализированной медицины. Разница между фармакогенетикой и фармакогеномикой заключается в том, что первая дисциплина изучает изменчивость пациентов по их реакции на лекарства, соответственно, ее целью является подбор адекватных препаратов для больных определенного генетического профиля; фармакогеномика же занимается разработкой новых лекарственных средств на основе исследований специфического воздействия различных соединений на работу генов на уровне целостного генома.
Почему эти дисциплины так важны? Дело в том, что в наши дни, когда лекарственные препараты назначаются без учета индивидуальных особенностей реакции организма, у 20–75% пациентов проявляется неадекватная реакция на фармакотерапию либо нежелательные побочные действия лекарства. По данным Американской медицинской ассоциации, в 2004 г. в США такие побочные реакции послужили причиной госпитализации 2 млн человек и смерти более 100 тыс. (Зырянов и др., 2008).
Причина подобных явлений в том, что лекарства метаболизируются у разных людей по-разному. Например, скорость выведения их из организма может отличаться в десятки раз! Однако, зная индивидуальные особенности генотипа и процессов «развертывания» генетической информации на уровне целостного организма, можно разработать прогностические тесты, позволяющие еще до начала медикаментозного лечения определить его эффективность и вероятность развития побочной реакции у конкретного пациента.
Выбор оптимального метода фармакотерапии на самом раннем этапе лечения способствует и более четкому соблюдению режима пациентом, и, что немаловажно, сокращению медицинских расходов. Признание факта существования межличностных различий в ответе на фармацевтический препарат – важный шаг к персонализации и оптимизации терапии.
«Технологический» диагноз
Важнейшей основой персонализированной медицины является молекулярная диагностика. Она не отвергает классические методы постановки диагноза, такие как сбор анамнеза, осмотр больного, клиническое обследование, но основной упор при этом делается на высокотехнологичный анализ биологических макромолекул (ДНК, РНК и белки).
Можно выделить несколько аспектов молекулярной диагностики в приложении к персонализированной медицине: раннее выявление болезни; подбор адекватного лечения безопасным и эффективным препаратом; интеграция диагностики и терапии; мониторинг лечения и определение прогноза.
Молекулярная диагностика широко используется для генетического тестирования, а также в генетическом скрининге больших популяций. Например, уже сейчас в роддомах проводится массовое генетическое обследование новорожденных с целью выявления наследственных заболеваний. Классический пример подобных заболеваний – фенилкетонурия, которой в нашей стране болеет один ребенок из 8—10 тыс. У детей с фенилкетонурией в будущем развивается умственная отсталость, но если поставить диагноз своевременно, то для предотвращения развития патологии достаточно будет исключить из рациона ребенка продукты, содержащие аминокислоту фенилаланин.
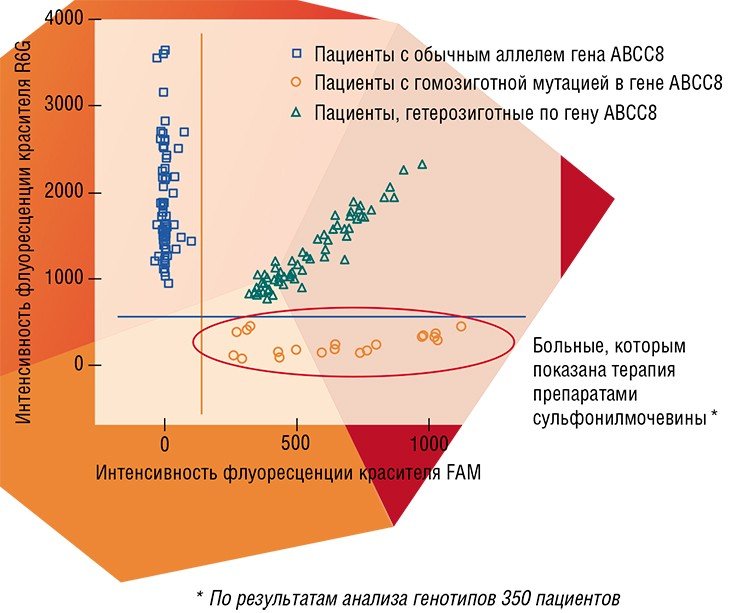
Методы молекулярной диагностики основаны на использовании биомаркеров – выявленных с помошью специальных исследований определенных биологических молекул, указывающих на то или иное состояние систем и тканей организма. К биомаркерам относятся и участки генов, ответственных за тот или иной признак организма, например, за предрасположенность к определенной болезни. И в этом смысле на сегодня важнейшими технологиями в приложении к персонализированной медицине являются генотипирование полиморфизма (вариабельности) генов по единичным нуклеотидам, а также биологические микрочипы, с помощью которых можно обнаружить в клиническом образце протяженные нуклеотидные фрагменты ДНК и РНК.
Биочипы — миниатюрные приборы, предназначенные для одновременной регистрации множества взаимодействий между различными молекулами. В основе этой технологии лежит комплементарность молекул, т. е. способность связываться по принципу «замок—ключ». На пластинке биочипа в строгом порядке закреплено множество так называемых молекулярных зондов, которые избирательно реагируют с определенными участками молекул-мишеней из клинического образца, взятого у пациента.
Биочиповая технология неизмеримо расширила диагностические возможности персонализированной медицины: на ее основе можно создавать портативные устройства для молекулярной диагностики, при этом один биочип может одновременно нести множество самых разнообразных зондов на различные молекулы-мишени. Эта технология также позволяет значительно ускорить процесс разработки новых «персонализированных» лекарственных средств.
Терапия рака
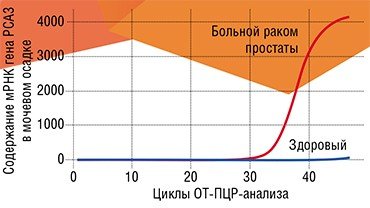
На сегодня лидером по внедрению элементов персонализированной медицины в медицинскую практику является онкология. При оперативном вмешательстве или биопсии в ткани опухоли сегодня можно определить ряд онкологических маркеров, чтобы выработать стратегию лечения для конкретного пациента. Специфические мутации определенных генов, с которыми связана тяжесть течения заболевания и прогноз лечения, уже обнаружены для рака молочной железы, меланомы, некоторых форм рака легкого и рака толстой кишки.
Яркий пример таких биомаркеров – белок-рецептор так называемого эпидермального фактора роста 2-го типа (HER2). В каждом пятом случае рака молочной железы и в 15 % случаев рака желудка наблюдается повышенный синтез этого белка, и в этих случаях болезнь принимает агрессивную форму. Сегодня с помощью специального теста можно вовремя обнаружить такую особенность пациента и назначить специфический блокатор (Yamauchi et al., 2001).
Еще один подобный пример – мутация в гене BRAF, участвующем в регуляции процесса деления клеток. Эта мутация встречается примерно у половины больных метастатической меланомой. Для этого случая также разработан целевой препарат, позволяющий уменьшить тяжесть протекания заболевания (Flaherty, 2010).
Для лечения некоторых форм рака принято использовать интерферон, но такая терапия оказывается успешной только у 20–30% больных, у остальных же вызывает тяжелые побочные эффекты. Молекулярная диагностика с помощью биочипа производства фирмы Hoffmann-LaRoche дает возможность выявить пациентов, чувствительных к этому препарату. Этим больным можно назначать лечение интерфероном на ранних стадиях заболевания, тогда как прежде применение интерферона допускалось лишь в крайних, запущенных случаях болезни (Jain, 2002).
 Один из подходов к лечению злокачественных опухолей состоит в том, чтобы заставить иммунную систему самого организма распознавать и уничтожать клетки сформировавшейся опухоли. При этом надо учесть, что хотя все опухоли возникают по схожему молекулярно-генетическому механизму, они обычно сопровождаются случайными мутациями в разных генах. В результате «молекулярный отпечаток» опухоли, на который должна реагировать иммунная система, имеет уникальный характер у каждого больного. На этом основании компания Antigenics Corporation начала производить «абсолютно персонализированные» средства иммунотерапии рака из опухолевых тканей самих больных (Jain, 2002).
Один из подходов к лечению злокачественных опухолей состоит в том, чтобы заставить иммунную систему самого организма распознавать и уничтожать клетки сформировавшейся опухоли. При этом надо учесть, что хотя все опухоли возникают по схожему молекулярно-генетическому механизму, они обычно сопровождаются случайными мутациями в разных генах. В результате «молекулярный отпечаток» опухоли, на который должна реагировать иммунная система, имеет уникальный характер у каждого больного. На этом основании компания Antigenics Corporation начала производить «абсолютно персонализированные» средства иммунотерапии рака из опухолевых тканей самих больных (Jain, 2002).
Известно, что у разных пациентов сильно варьирует и реакция на химиотерапию, что может быть обусловлено генетическими различиями метаболизма. Соответствующее тестирование пациентов могло бы помочь избежать тяжелого и неэффективного лечения.
К сожалению, в России, особенно в отдаленных регионах, на сегодняшний день не имеется достаточного числа клинических лабораторий, в которых можно проводить тестирование опухолевого материала от каждого больного. И в этом смысле достижения фармакогеномики в нашей стране практически не используются, хотя, согласно ожиданиям, в течение ближайшего десятилетия появятся молекулярно-диагностические технологии, которые будут учитывать специфику всех применяемых онкологических препаратов.
Для сердца и сосудов
Еще один бич нашего времени – гипертоническая болезнь, которая относится к так называемым многофакторным заболеваниям. Для лечения гипертонии создано множество фармакологических препаратов: диуретики, a-адреноблокаторы, блокаторы кальциевых каналов и т. д. Они различаются по механизму действия, эффективности, а также по вызываемым побочным действиям. Подбор эффективного и достаточно безопасного комплекса препаратов для конкретного больного зачастую является для врача сложной и нестандартной задачей. Поэтому неудивительно, что пока лишь у менее трети всех гипертоников удается добиться хорошего контроля за давлением крови (Rusnak et al., 2001).
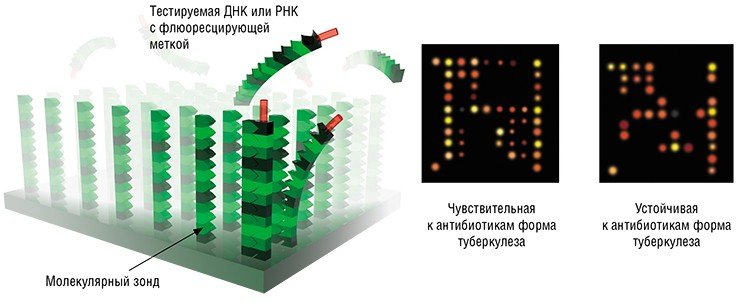
Микрочип способен определять не только опасные для человека виды ортопоксвирусов, но и герпесвирусы 1, 2 и 3 типов. Важность такой одновременной диагностики в том, что болезни, вызванные этими вирусами, имеют схожие клинические проявления, но требуют разного лечения
В последние годы для решения этой проблемы также начинают привлекать возможности персонализированной медицины. Например, было показано, что на эффективность препарата фосиноприла – ингибитора ангиотензинконвертирующего фермента (АКФ) – влияет полиморфизм гена, кодирующего этот фермент (Stavroulakis, Makris, 2000). Компания Sequenom выпускает тест для выявления пациентов, которых следует в первую очередь лечить препаратами группы антагонистов АКФ. Такое тестирование позволяет уменьшить число лекарственных препаратов, необходимых для адекватного лечения.
Всем также известно, что одним из основных факторов развития стенокардии – формы ишемической болезни сердца, является повышенный уровень «плохого» холестерина в крови. Для его снижения используют препараты группы статинов (симвастатин, аторвастатин и др.). В 2002 г. компания Genaissance закончила масштабное клиническое исследование, цель которого заключалась в поиске специфических генетических маркеров, связанных с эффективностью дейcтвия этих препаратов. В результате удалось выявить около сотни генов, которые могут быть связаны с «ответом» пациента на статины (Jain, 2002).
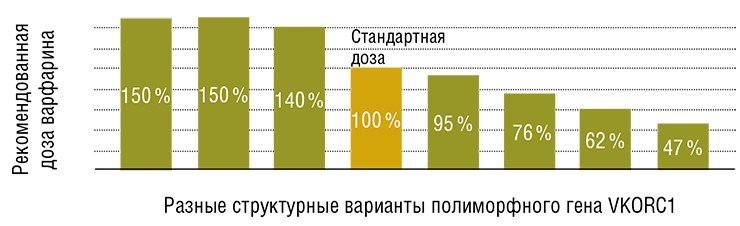
Имеется еще немало примеров, демонстрирующих применение передовых геномных технологий для индивидуализации лечения больных. Предполагается, что в ближайшее время персонализированная медицина будет активно развиваться в таких областях, как кардиология, иммунология и заболевания центральной нервной системы. В более отдаленной перспективе ее возможности будут использоваться при лечении метаболических расстройств и даже респираторных заболеваний.
Трудности роста
Работа над конкретными технологическими решениями в области молекулярной диагностики идет постоянно. Однако сегодня мы явно недооцениваем сложность превращения громадных объемов данных, полученных в научных исследованиях, в новые клинически ценные продукты.
Как это ни печально, но большинство открытых за последнее десятилетие биомаркеров в настоящее время нельзя использовать для улучшения уже существующих клинических тестов. Дело в том, что потенциально значимый биомаркер должен быть воспроизводимым, чувствительным и специфичным. Поэтому сначала его требуется валидировать, т. е. подтвердить на сотнях клинических образцов тканей, что подразумевает существование больших коллекций образцов от пациентов и соответствующих баз данных. Такой же длительной и дорогостоящей апробации требует и разработанное для определения маркера технологическое решение.
Поэтому неудивительно, что большинство открытых биомаркеров так и остаются лишь упоминанием в научных публикациях. Например, простой поиск по ключевым словам «cancer marker clinical validation» (клиническая валидация опухолевых маркеров) в базе данных Medline выдает 1592 результата, тогда как по ключевым словам «new cancer marker» (новые опухолевые маркеры) – почти 30 тысяч!
Во многом именно эта «болевая» точка замедляет развитие современной персонализированной медицины в России, и именно здесь должны быть приложены значительные усилия для преодоления имеющихся проблем.
 Есть и другие, более объективные, препятствия. К ним относится, в частности, неполнота имеющихся на сегодня фундаментальных знаний о связях между генотипом и фенотипом – реальной реализацией наследственной информации на уровне индивидуума. Современный технический уровень биоинформатики не всегда позволяет адекватно обрабатывать огромные массивы данных.
Есть и другие, более объективные, препятствия. К ним относится, в частности, неполнота имеющихся на сегодня фундаментальных знаний о связях между генотипом и фенотипом – реальной реализацией наследственной информации на уровне индивидуума. Современный технический уровень биоинформатики не всегда позволяет адекватно обрабатывать огромные массивы данных.
До сих пор не вполне ясен и экономический аспект внедрения новых медицинских технологий в практическую медицину. Маркетологи испытывают затруднения с оценкой стоимости такого лечения, но есть все основания считать, что массовое использование технологий персонализированной медицины со временем должно окупиться за счет повышения эффективности диагностики и, в конечном итоге, снижения сроков лечения и реабилитации больного.
Что же врачи и их пациенты могут ждать от персонализированной медицины в будущем?
На рынке будут появляться новые портативные диагностические устройства. Дальнейшее развитие информационной сферы обеспечит доступ пациентов к своим медицинским данным в электронном виде, включая генетический профиль.
Благодаря появлению возможности определять генетическую предрасположенности к тем или иным болезням, врачи будут разрабатывать комплекс индивидуальных профилактических мер, а в случае наступления заболевания – назначать лечение в соответствии с генетической конституцией больного, включая конкретно для него изготовленное лекарство.
Но это, конечно, идеальная ситуация. Что касается нашей страны, то развитие в России персонализированной медицины связано, в первую очередь, с активизацией фармакогеномных исследований социально значимых заболеваний человека, таких как рак и сердечно-сосудистые заболевания, лекарственная терапия которых особенно сложна и дорогостояща. По мнению специалистов, необходимо инициировать создание электронных экспертных систем и банков биоматериалов, а также проведение продолжительных эпидемиологических проектов, которые на сегодня в России полностью отсутствуют (Баранов, 2011).
Кроме того, очень важно проводить большую просветительную и образовательную работу среди работников здравоохранения и фармацевтов, а также создавать новые учебные программы для высшей школы, сфокусированные на возможностях и технологиях персонализированного лечения. Наконец, и сами пациенты, как«конечные потребители» медицинских услуг, должны иметь возможность получать достоверную -информацию относительно ограничений и преимуществ новой медицины.
Литература
Федорова О. С., Коваль В. В. Протемика – высокотехнологичная рыбалка // НАУКА из первых рук. 2010. №2 (32). С. 84—90.
Коптюг А. В., Мамонтов Е. В., Суховей Ю. Г. На пути к персонализированной медицине // НАУКА из первых рук. 2011. №2 (38). С. 90—97.
Коптюг А. В., Мамонтов Е. В., Суховей Ю. Г. На пути к персонализированной медицине. Динамическая модель развития опухоли // НАУКА из первых рук. 2011. № 6 (42). С. 44—51.
Лифшиц Г. И., Новикова Я. В. Терапия: персональная доза // НАУКА из первых рук, 2010. №2 (32). С. 91—94.
Синяков А. Н. Диагноз – дело техники! // НАУКА из первых рук. 2007. №5 (17). С. 40—49.
Черноносов А. А. Красноречивые метаболиты // НАУКА из первых рук. 2010. №2 (32). С. 84—90.
Davies K. The $1,000 Genome: The Revolution in DNA Sequencing and the New Era of Personalized Medicine. New York: Free Press, 2010. 340 p.
Jain K. K. Personalized Medicine. Basel: Jain PharmaBiotech Publications, 2003.
Jain K. K. Textbook of Personalized Medicine. New York: Springer, 2009. 419 p.