Экзосомы – межклеточная почта
Давно известно, что клетки «общаются» друг с другом посредством сигнальных молекул, которые они выделяют в межклеточную жидкость. Но открытия последних лет радикально изменили взгляды на механизмы этого взаимодействия. Выяснилось, что, помимо сигнальных молекул, клетки секретируют везикулярные (пузырьковые) структуры, которые могут перемещаться по организму и избирательно проникать в другие клетки, доставляя в них белки и нуклеиновые кислоты и таким образом влияя на их жизнедеятельность
Нельзя сказать, что до открытия «путешествующих» пузырьков-везикул биологи совсем не подозревали о том, что клетки секретируют подобные структуры, как и о возможности межклеточного переноса нуклеиновых кислот. Так, было известно, что при содержании в культуре клетки выделяют в среду ДНК и РНК, а в крови животных обнаруживали циркулирующие внеклеточные молекулы нуклеиновых кислот. Однако секретируемым клетками везикулярным структурам приписывалась роль «мусорщиков», убирающих из клетки ненужные вещества, а появление в кровотоке нуклеиновых кислот зачастую объясняли их поступлением из погибших клеток. При этом не предпринималось никаких попыток установить, в составе каких структур секретируются из клеток эти макромолекулы.
Все изменилось в 2007 г., когда было обнаружено, что крошечные внеклеточные пузырьки, которые выделяют клетки, несут в себе функционально активные генетические программы (Valadi, 2007). Начались активные исследования структуры везикул, механизма их биогенеза и биологической активности. Оказалось, что эти внеклеточные образования являются не «мусорщиками», а транспортерами биологических макромолекул, среди которых – короткие регуляторные РНК (микро- и другие некодирующие РНК) и даже кодирующие матричные РНК (мРНК). С помощью мРНК эти «посланники» могут побуждать клетки-реципиенты синтезировать белки, которые до этого в них не присутствовали.
В исследования везикулярных структур включились ведущие биологические и биомедицинские лаборатории. В 2011 г. в Гетеборге (Швеция) было основано Международное общество по внеклеточным везикулам, а уже на следующий год состоялась первая конференция, посвященная исключительно этой области исследований. Тогда же был основан и журнал Journal of Extracellular Vesicles. С тех пор Общество проводит ежегодные симпозиумы, школы и конференции.
Какими они бывают
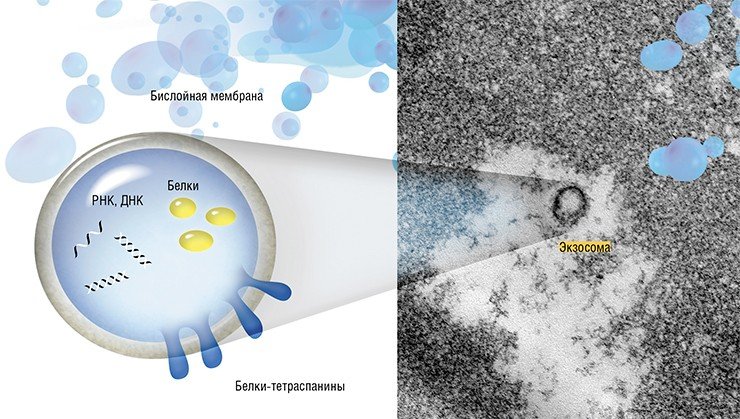
Внеклеточные везикулы представляют собой сферические структуры размером от 40 до нескольких сотен и даже тысяч нанометров. Их подразделяют на разные типы в зависимости от размеров, состава и способа образования.
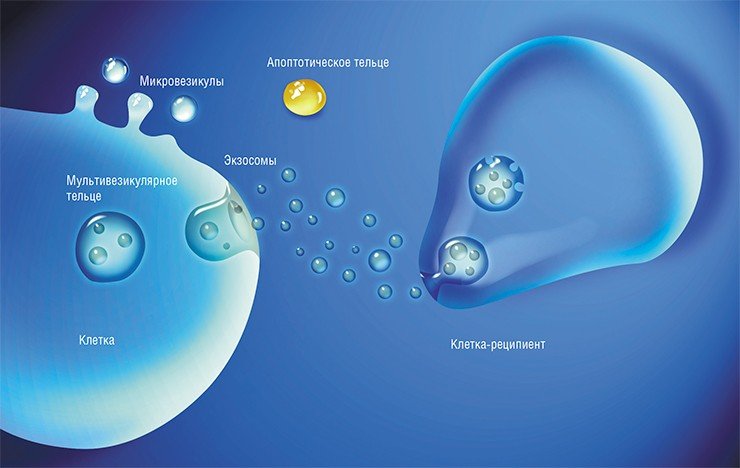
Самый большой (до 5000 нм) размер среди внеклеточных везикул имеют апоптотические тельца, которые представляют собой фрагменты клеток, разрушившихся в результате апоптоза – процесса запрограммированной клеточной гибели. Ученые «доэкзосомной» эпохи часто предполагали именно этот вариант, когда находили в кровотоке нуклеиновые кислоты. Микровезикулы, размер которых может достигать 1000 нм, образуются путем отпочковывания в окружающую среду участка плазматической мембраны клетки.
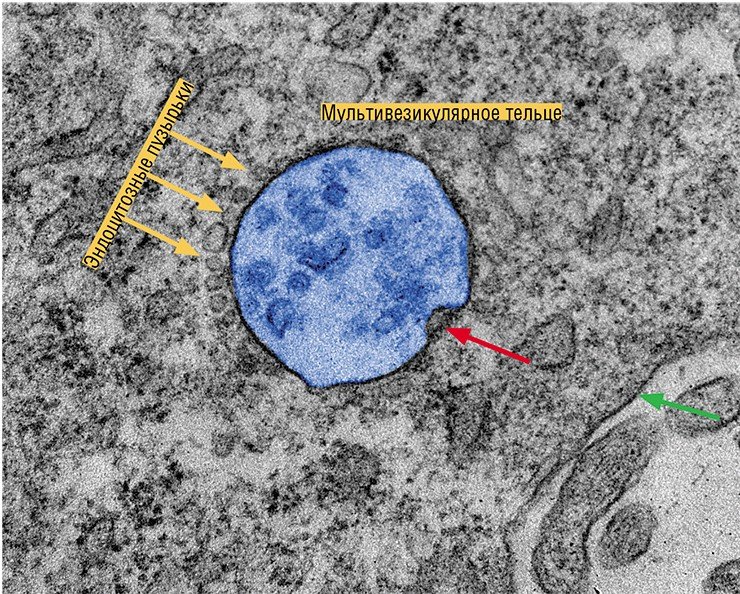
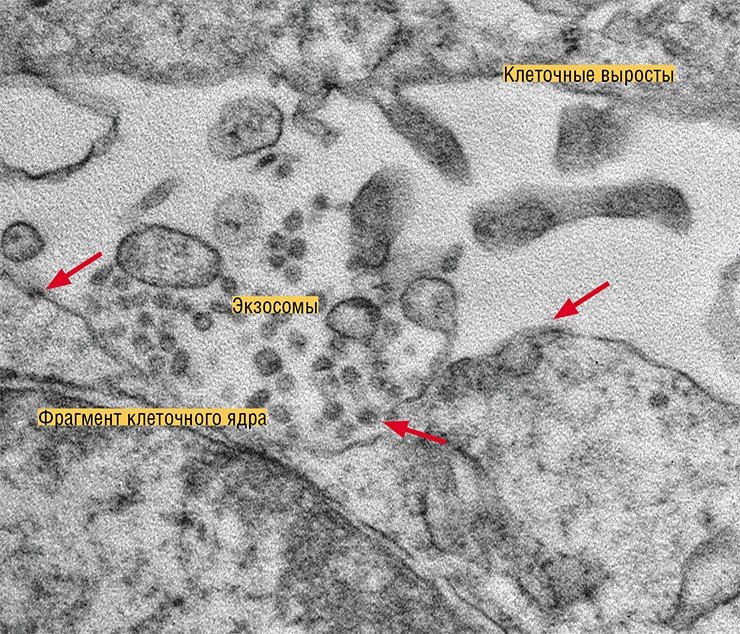
Но наибольшее внимание научного мира сейчас приковано к экзосомам. Эти везикулы, имеющие размер от 40 до 100—150 нм, образуются в эндосомах – мембранных внутриклеточных органеллах, связанных с транспортом вещества внутри клетки. Экзосомы формируются путем «впячивания» участка эндосомальной мембраны в просвет органеллы, который затем отшнуровывается. Эндосома, содержащая экзосомы, называется уже мультивезикулярным тельцем. Эта клеточная структура либо уничтожается протеолитическими ферментами, либо направляется к мембране клетки, где сливается с ней и «раскрывается», выбрасывая свое содержимое во внеклеточную среду.
Везикулярные структуры могут секретировать самые разные клетки. В зависимости от вида клеток и условий культивирования они несут разные наборы РНК и белков, а также могут содержать ДНК. Например, было показано, что экзосомы клеток разных видов рака могут переносить двуцепочечную ДНК, в которой присутствуют те же мутации, что и в ДНК родительской раковой клетки (Thakur et al., 2014).
«Длинные руки» клеток
Сегодня не вызывает сомнений, что экзосомы участвуют во многих процессах в организме. С ними, к примеру, связывают терапевтические эффекты стволовых клеток – недифференцированных («незрелых») клеток, из которых формируются специализированные клетки и ткани.
Стволовые клетки уже давно пытаются применять в медицине, и не без успеха. Так, имеются положительные результаты экспериментов по восстановлению повреждений печени, почек, легких, кожи и даже сердечной мышцы после инфаркта с помощью инъекций стволовых клеток. Есть предположение, что такое регенеративное действие оказывают не сами клетки, а секретируемые ими продукты, в том числе микровезикулы, которые переносят специфические наборы матричных и малых интерферирующих РНК (Rani, 2015).
Экзосомы, выделяемые антигенпрезентирующими дендритными клетками, играют важную роль в развитии иммунного ответа. Эти клетки захватывают антигены – чужеродные молекулы и представляют их другим клеткам иммунной системы – T-лимфоцитам, участвующим в дальнейших иммунных реакциях организма. Экзосомы, как и их клетки-прародительницы, также имеют встроенный в мембрану молекулярный главный комплекс гистосовместимости, в составе которого антигены «представляются» иммунным клеткам организма.
Экзосомы вовлекаются и в развитие вирусных инфекций. Так, клетки, зараженные ВИЧ, могут с помощью экзосом распространять по организму вирусные белки и РНК, таким образом способствуя ослаблению иммунной системы и развитию инфекции (Madison, 2015; Teou, 2016).
Много экзосом выделяют и клетки злокачественных опухолей. Дело в том, что наибольшее число экзосом продуцируется при пониженной концентрации кислорода (гипоксии), а такое состояние характерно для опухоли. Экзосомы содействуют развитию и распространению рака в организме, увеличивая проницаемость сосудов и подготавливая почву для успешного метастазирования.
Так, в случае глиобластомы, одной из самых распространенных и агрессивных опухолей мозга, экзосомы ускоряют рост раковых клеток и способны вызывать злокачественную трансформацию нормальных клеток. Экзосомы заметно влияют на микроокружение опухолевых клеток, меняя состав поверхностных белков клеток нейроглии – вспомогательного «персонала» мозговой ткани и уровень секреции цитокинов (небольших гормоноподобных пептидных молекул), снижая тем самым способность макрофагов захватывать опасные объекты. В клетках микроглии (вспомогательных иммунных клетках центральной нервной системы) экзосомы провоцируют накопление белка матриксной металлопротеиназы, характерного для клеток опухоли и стимулирующего развитие метастазов и ангиогенез (разрастание сосудов) (Gourlay, 2016).
Одно из свойств глиобластомы, способствующих ее быстрому распространению, – образование инвадоподий. Эти выросты клеточной мембраны, богатые сократительным белком актином, могут разрушать внеклеточные тканевые структуры благодаря действию ферментов протеаз, расщепляющих белки. Оказалось, что рост и регуляция инвадоподий также могут быть опосредованы экзосомами (Hoshino, 2013).
Перспективы в диагностике и терапии
Исследования экзосом уже привели к получению практических результатов, и в первую очередь в диагностике: при ряде заболеваний из биологических жидкостей человека можно выделить экзосомы, несущие маркеры – определенные РНК и белки, которые можно проанализировать. Такие методы диагностики называют «жидкой биопсией», и они гораздо менее травматичны, чем обычная тканевая биопсия, и занимают меньше времени.
Именно на таком принципе работают диагностические наборы для обнаружения немелкоклеточного рака легкого и рака простаты производства компании Exosome Diagnostics (США). С их помощью определяют наличие особых «раковых РНК» в экзосомах, выделенных из крови пациента, что дает возможность поставить диагноз на ранней стадии болезни. Компания готовится представить подобные наборы для определения генетических мутаций при раке легкого, что важно для выбора стратегии лечения.
Можно простимулировать культивируемые клетки выделять много экзосом, например, создавая им стрессовые условия. Для этого можно уменьшить в среде концентрацию глюкозы, изменить кислотность, температуру или степень насыщения кислородом либо добавить определенные химические вещества.В промышленном масштабе получать экзосомы пока не научились, но зато экзосомоподобные везикулы легко можно выделить из обычного молока. И такие структуры уже успешно опробованы в качестве переносчиков химиопрофилактических и химиотерапевтических препаратов. Также предпринимаются попытки разработать технологии создания искусственных экзосомоподобных везикул из клеточных мембран. Так, исследователи из Южной Кореи разработали технологию, позволяющую срезать с клеток фрагменты клеточной мембраны, которые потом сами собираются в везикулы диаметром 100—300 нм (Yoon, 2015)
Ведутся исследования возможностей диагностики заболеваний и на основе белковых маркеров экзосом. К примеру, уже описаны белковые «палитры» экзосом, характерные для разных типов рака молочной железы, что позволяет детально характеризовать заболевание и отслеживать эффективность его лечения.
Экзосомы перспективны и как универсальные инструменты для адресной доставки в клетки терапевтических препаратов. За счет присутствия в мембране особых липидов и белков они могут специфично связываться только с определенными клетками. Сами же экзосомы практически не иммуногенны, нетоксичны, устойчивы в биологических средах и хорошо защищают свое содержимое от разрушения. А небольшой размер этих везикул позволяет им легко проникать в различные органы и ткани, минуя, в том числе, и гематоэнцефалический барьер, защищающий мозг.
С помощью экзосом можно доставлять в клетки не только химиопрепараты, но и терапевтические нуклеиновые кислоты. Например, компания Codiak совместно с Онкологическим центром Андерсона при Техасском университете (США) разрабатывает на основе экзосом препарат для лечения рака поджелудочной железы. Известно, что одна из причин возникновения этого типа рака – мутация в протоонкогене Kras, которая приводит к синтезу мутантной формы соответствующего фермента и злокачественной трансформации клетки. Созданные исследователями экзосомы доставляют в раковые клетки малую молекулу РНК, специфичную к мутантному гену, что подавляет его работу по механизму РНК-интерференции. Это приводит к замедлению метастазирования и увеличивает выживаемость у лабораторных животных (Kamerkar, 2013).
Дальнейшие исследования в этой области могут привести к созданию эффективных лекарственных средств против разных видов рака.
Исследования в области экзосом сегодня находятся на переднем крае мировой науки. Множество научных коллективов и организаций занимаются изучением их строения, биогенеза, возможностей для применения в качестве диагностических маркеров и терапевтических средств. Такой работой занимаются и специалисты Института химической биологии и фундаментальной медицины СО РАН (Новосибирск): как приложениями экзосом в диагностике, так и их лекарственным «наполнением» для адресной доставки в клетки.
Несмотря на уже накопленную информацию, мы многое про экзосомы еще не знаем. Например, известно, что одни и те же клетки могут секретировать экзосомы с совершенно разными наборами молекул, но вот как именно функциональное состояние клеток влияет на содержимое экзосом, остается загадкой. Однако перспективы применения подобных структур в медицине очевидны, а дальнейшие фундаментальные исследования должны принести уже в ближайшее время много открытий.
Литература
Edgar J. R. Q&A: What are exosomes, exactly? // BMC Biology. 2016. V. 14. N. 1. P. 46.
Rani S., Ryan A. E., Griffin, M. D. et al. Mesenchymal Stem Cell-derived Extracellular Vesicles: Toward Cell-free Therapeutic Applications // Molecular Therapy. 2015. V. 23. N. 5. P. 812—823.
Raposo G., Stoorvogel W. Extracellular vesicles: Exosomes, microvesicles, and friends // Journal of Cell Biology. 2013. V. 200. N. 4. P. 373—383.
Valadi H., Ekstrom K., Bossios A. et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells // Nature Cell Biology. 2007. V. 9. N. 6. P. 654—659.