Мир РНК: вчера и сегодня
Долгое время считали, что рибонуклеиновая кислота (РНК), ближайшая «родственница» знаменитой ДНК, выполняет в организме служебные функции, являясь лишь посредником в сложнейших внутриклеточных процессах. И хотя признавалось, что на ранних этапах эволюции жизни РНК могла играть главенствующую роль, но казалось очевидным, что она давно уступила первенство более специализированным молекулам – катализаторам и носителям информации. Однако открытие множества регуляторных РНК, связанных с феноменом некодирующего «темнового генома», буквально перевернуло представления о современном «мире РНК» и послужило толчком к поиску и созданию новых диагностических и лекарственных средств
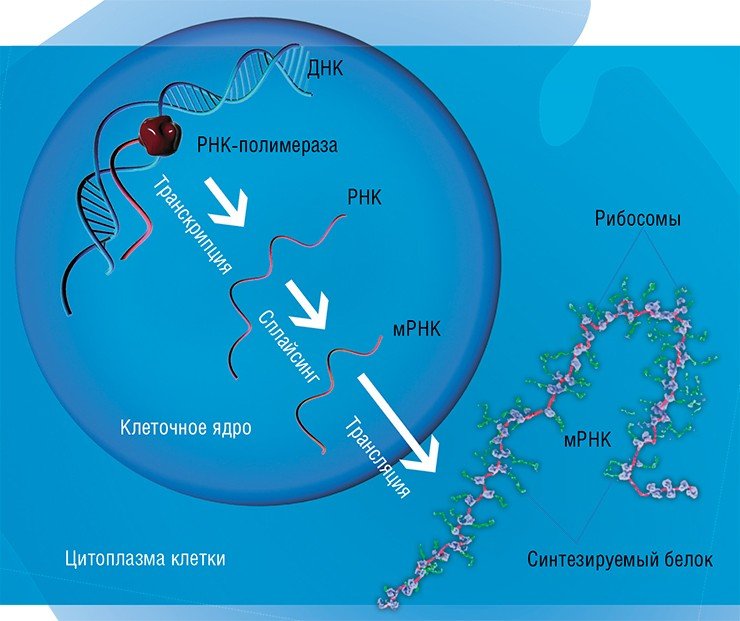
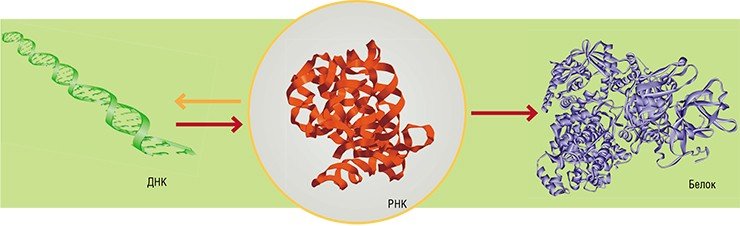
Классический взгляд на процесс реализации наследственной информации в живой клетке сформировался еще в начале второй половины XX в. Согласно нему, вся наследственная информация, определяющая жизнь организма, закодирована в виде последовательности нуклеотидов в особом биополимере – дезоксирибонуклеиновой кислоте (ДНК). «Размножение» и передача этой информации происходит путем удвоения молекул ДНК с участием специальных белков-ферментов.
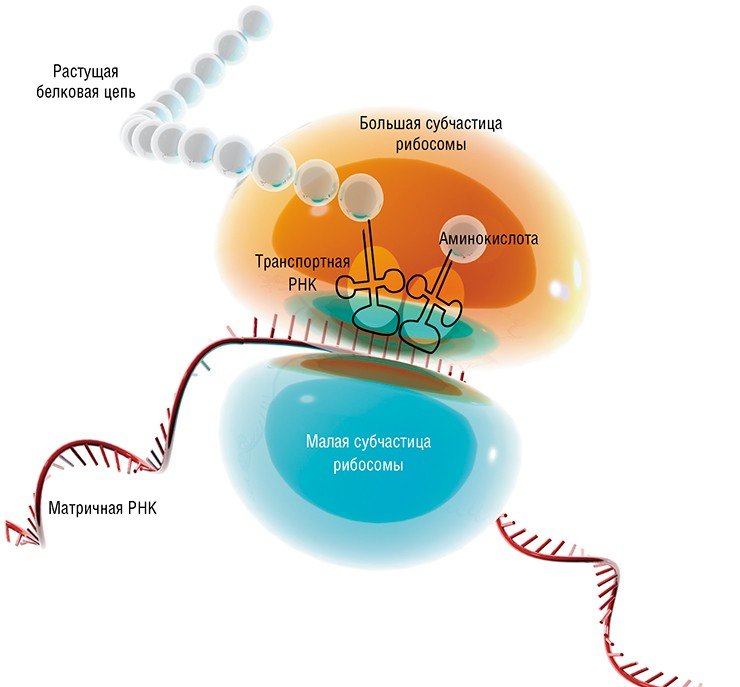
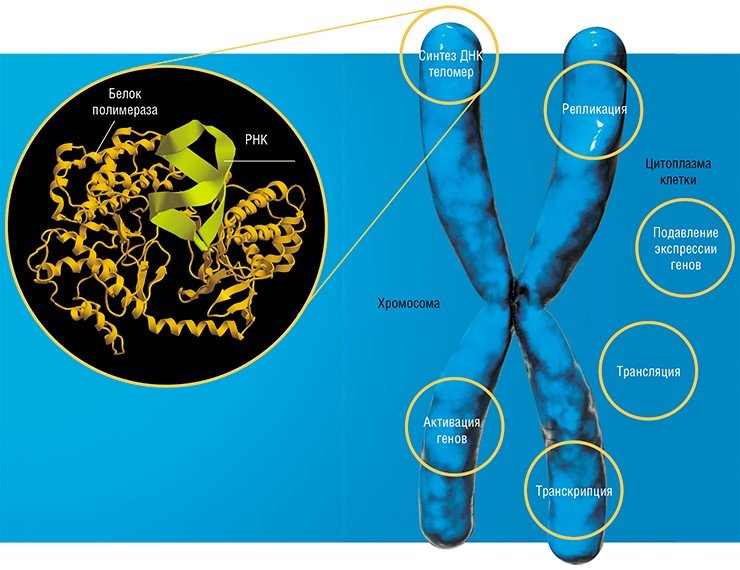
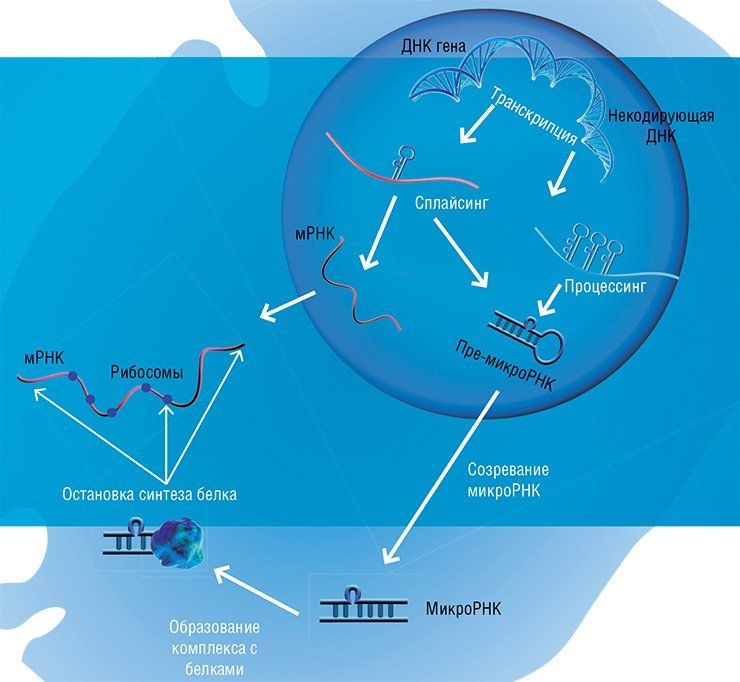
Когда участок ДНК, в котором содержится информация о строении того или иного белка, – ген – начинает «работать», с него с помощью специальных ферментов считывается «промежуточная» информация в виде молекул рибонуклеиновой кислоты (РНК). Нуклеотидная последовательность этой РНК служит «программой»-матрицей для особых молекулярных машин – рибосом, которые приступают к синтезу соответствующего белка
В этой схеме преобразования генетического кода в конечный «полезный продукт» центральным элементом является ДНК. Была даже сформулирована «центральная догма молекулярной биологии», гласившая, что поток информации в живой клетке идет по направлению от ДНК к РНК и далее к белку, и только в этом направлении: синтезировать ДНК или РНК, соответствующую определенному белку, клетка не умеет. Неудивительно, что увлекательная книга молекулярного биолога М. Д. Франк-Каменецкого «Самая главная молекула», вышедшая в 1983 г., была посвящена именно ДНК.
Важная роль отводилась также белкам, как главным строительным «кирпичикам» и, в первую очередь, катализаторам, способным в условиях живой клетки опосредовать самые разные биохимические реакции и процессы. РНК же представлялась скорее «рабочей» молекулой, расходным материалом белкового синтеза. Конечно, помимо матричной РНК были известны и транспортные РНК, переносящие аминокислоты на рибосомы, а также РНК в составе рибосомного каркаса, однако и им отводилась роль скромных «золушек».
Со временем стали накапливаться наблюдения, которые заставляли задуматься: а так ли просто все устроено в геноме? К примеру, оказалось, что у некоторых вирусов наследственная информация зашифрована не в ДНК, а в РНК, и они способны синтезировать ДНК по «матрице» РНК при встраивании своего генетического материала в геном клетки-хозяина. Однако несмотря на отдельные противоречия, взгляды на природу и роль важнейших биополимеров, вошедшие во все школьные учебники, десятилетиями оставались незыблемыми.
Между тем, невзирая на трудности экспериментов с РНК, молекулы которой менее стабильны, чем ДНК и белков, исследователи продолжали упорно изучать эти «немодные» биополимеры. И в конце XX в. классические научные представления начали рушиться под напором новых поразительных открытий.
Жизнь начиналась с РНК
После расшифровки генома человека и других высокоорганизованных животных оказалось, что большая часть ДНК не содержит генов, кодирующих белки. (К слову, когда сравнили геномы различных млекопитающих, оказалось, что по набору генов «царь природы» немногим отличается от той же мыши.) В геноме человека длиной около трех миллиардов пар нуклеотидов ожидали обнаружить более 100 тыс. генов, но их оказалось по крайней мере в три раза меньше! Причем в это число входят все гены, кодирующие белки, а также гены рибосомных и транспортных РНК. Вместе с известными на то время регуляторными последовательностями все эти гены занимают не более 1,5 % геномной ДНК. А что же остальная часть?
С полным пренебрежением к непонятному такую некодирующую ДНК – так называемый темновой геном – стали считать «мусором», накопившимся в процессе эволюции. И хотя впоследствии было обнаружено, что с участков «мусорной» ДНК все же считывается какая-то информация и синтезируется огромное количество РНК, это явление было оценено как «транскрипционный шум».
Самым удивительным открытием стал тот факт, что белки не являются монополистами в умении катализировать биологические реакции. Так, в ядре клетки обнаружился набор небольших РНК, которые при участии белков обеспечивают процесс созревания матричной РНК. Дело в том, что с гена считывается длинная РНК, которую необходимо нарезать на фрагменты и затем определенным образом «сшить», чтобы получилась нужная программа. Правильность этой «сшивки» и обеспечивают специальные РНК.
Был открыт и каталитически активный РНК-белковый комплекс теломераза, благодаря которому происходит синтез концевых участков хромосом. Оказалось, что в рибосоме РНК также выполняет не только структурную роль – из нее построен сам каталитический центр! Таким образом, все ключевые функции в процессе белкового синтеза принадлежат молекулам РНК.
Выяснилось, что РНК, подобно белкам, могут формировать компактные структуры, способные к высокоспецифичному взаимодействию практически с любыми маленькими и большими молекулами. РНК-катализаторы были найдены в природе, их используют как вирусы, так и клетки высших организмов. А вскоре самые различные каталитические РНК научились получать искусственным путем.
Факты упрямо указывали на первенство РНК как биологической молекулы. Да, ДНК является стабильным хранителем информации, но не может функционировать без помощи белков. Белки – эффективные катализаторы, но на роль носителей информации принципиально не годятся. А вот РНК оказалась именно такой универсальной, многофункциональной молекулой, какой и должна быть «прародительница».
Стало ясно, что именно из простых РНК-содержащих систем произошел современный биологический мир. Но куда же делся этот «мир РНК», когда на смену пришли более специализированные молекулы? Не являются ли сегодня РНК своего рода «молекулярными окаменелостями», имеющими хотя и важное, но ограниченное значение? Еще совсем недавно ответ на эти вопросы сомнений не вызывал.
Тридцать лет спустя
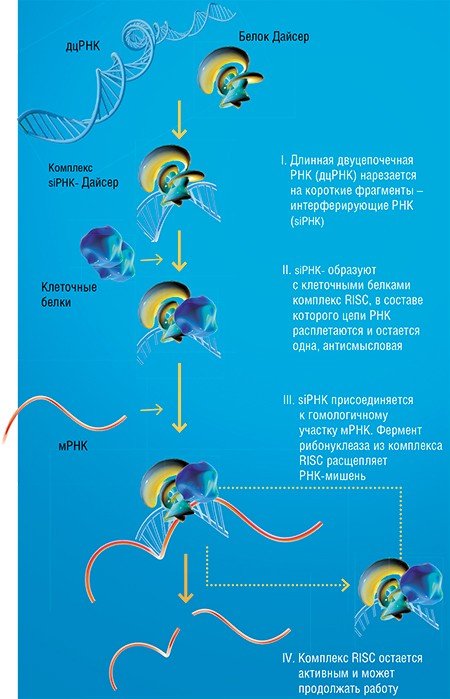 В 1997 г. в Германии состоялась конференция, посвященная исследованиям РНК. Ей предстояло подвести итог масштабной программы исследований РНК: все, что касалось этих биополимеров, представлялось на тот момент ясным и понятным. В этой атмосфере настоящим «взрывом бомбы» прозвучал доклад об открытии РНК-интерференции – ранее неизвестного механизма регуляции функционирования генов с помощью специальных малых РНК.
В 1997 г. в Германии состоялась конференция, посвященная исследованиям РНК. Ей предстояло подвести итог масштабной программы исследований РНК: все, что касалось этих биополимеров, представлялось на тот момент ясным и понятным. В этой атмосфере настоящим «взрывом бомбы» прозвучал доклад об открытии РНК-интерференции – ранее неизвестного механизма регуляции функционирования генов с помощью специальных малых РНК.
Вообще-то удивительно, что обнаружение этого довольно очевидного механизма потребовало так много времени. Ведь теоретически было давно известно, что остановить работу целевой генетической программы, т. е. «заблокировать» конкретную нуклеиновую кислоту, можно путем присоединения к ней небольшого комплементарного фрагмента РНК или ДНК, достаточного по размеру, чтобы обеспечить избирательность действия.
Именно такой способ избирательного регулирования функций нуклеиновых кислот был впервые предложен еще в 1960-х гг. новосибирским исследователем Н. И. Гриневой и ее коллегами, работавшими под руководством будущего академика РАН Д. Г. Кнорре. Ученые справедливо решили, что лучший способ направленно воздействовать на гены – использовать так называемые антисмысловые олигонуклеотиды, т.е. короткие комплементарные фрагменты ДНК или РНК (Belikova et al., 1967).
И вот десятилетия спустя было доказано, что этот механизм направленного воздействия на генетический материал функционирует в живых системах при регуляции экспрессии генов. Это тот редкий случай в истории науки, когда явление сначала было описано теоретически, затем его схема реализована в эксперименте и лишь десятилетия спустя оно обнаружено в природе.
Забегая вперед, нужно отметить, что своими работами сибирские ученые открыли новое направление прикладной молекулярной биологии, которое сегодня бурно развивается во всем мире. Уже получены первые фармацевтические препараты на основе интерферирующих микроРНК, а в будущем ожидается создание широчайшего спектра лекарств, в том числе и для избирательной инактивации уже самих микроРНК (такие ингибиторы даже получили специальное название – «анти-мир») и других некодирующих РНК.

На той же конференции 1997 г. было заявлено об обнаружении в клетках мозга и других органов множества разнообразных некодирующих РНК, концентрации которых меняются в зависимости от состояния организма. Стало очевидно, что речь должна идти не о свертывании, а о расширении дальнейших исследований РНК.
Сокровища «мусорной» ДНК
Очень скоро были получены данные о чрезвычайно широком распространении РНК-интерференции в природе и начаты работы по практическому использованию интерферирующих РНК для создания терапевтических препаратов и генетически модифицированных организмов.
Более того, было показано, что в организме синтезируется огромное число – тысячи видов – некодирующих РНК, информация о которых содержалась в той самой якобы ненужной «мусорной ДНК». Были обнаружены микроРНК-регуляторы активности генов, макроРНК, выполняющие различные регуляторные функции, а также множество других РНК с пока неизвестными функциями. Удивительно, что многие РНК находятся не только в клетках тканей, но и в крови, и способны «путешествовать» по организму.
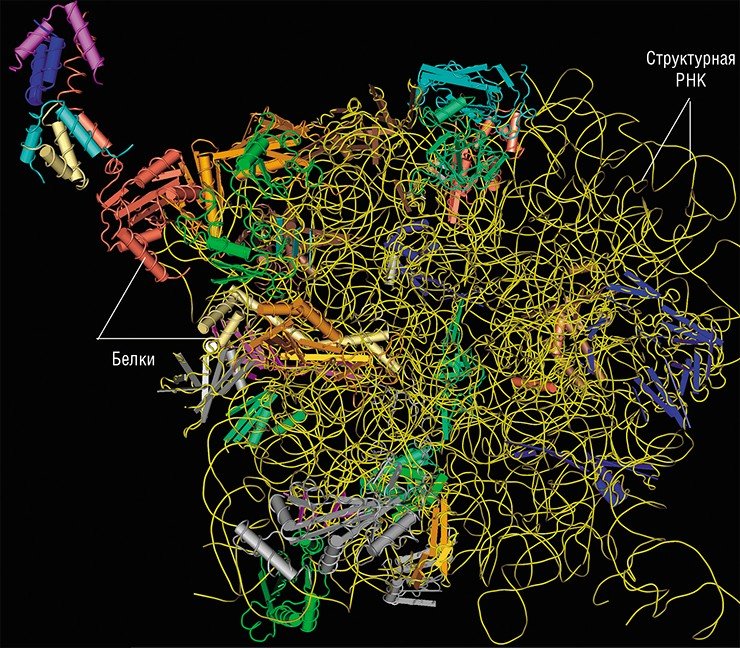
Длинные некодирующие РНК пока что относительно мало изучены, и механизм их действия установлен лишь в некоторых случаях. Исследователи склоняются к заключению, что такие РНК играют роль организаторов сложных функциональных структур, включающих различные биомолекулы. Молекула РНК идеально подходит на подобную роль: она может содержать в себе различные модули, которые способны связываться как с конкретными белками, так и с участками ДНК. Такие РНК-модули могут располагаться определенным образом относительно друг друга, благодаря чему появляется возможность создавать супрамолекулярные ансамбли любой степени сложности. Самый наглядный пример такой структуры – рибосома.
Таким образом, именно благодаря РНК создаются основные структуры клетки, делающие ее «живой». Длинные некодирующие РНК управляют также работой генетического аппарата клетки. Они включают и выключают работу целых областей хромосомы, определяя точки специфической модификации хромосомных белков.
С состоянием организма тесно связаны и концентрации разнообразных микроРНК в органах и тканях. Эти РНК, участвуя в регуляции активности огромного числа генов, воздействуют на важнейшие физиологические и метаболические процессы, протекающие в отдельной клетке и в организме в целом.
Например, с помощью определенного набора микроРНК можно изменить степень клеточной дифференциации – получить из специализированных клеток недифференцированные стволовые либо, напротив, управлять дифференциацией стволовых клеток в нужном направлении. Доказано, что с помощью микроРНК регулируется дифференциация клеток жировой ткани, метаболизм липидов, секреция инсулина и других гормонов и т. д.
Судя по последним данным, в сферу «юрисдикции» РНК попадает свыше 60 % всех генов. Фактически, именно микроРНК «руководят» развитием целых органов и организма в целом, запуская одни процессы и останавливая другие по соответствующим «биологическим часам».
В составе специальных транспортных мембранных структур, таких как экзосомы, микроРНК могут передаваться не только между тканями и органами одного организма, но даже между организмами. Например, в молоке матери содержатся экзосомы с микроРНК, которые играют важную роль в становлении иммунной системы ребенка, причем уровень их секреции особенно высок в первые шесть месяцев лактации (Kosaka et al., 2010).
Неудивительно, что интерес к таким транспортным структурам и составу переносимых ими микро- и других некодирующих РНК сегодня крайне высок, и недавно начатые исследования были подхвачены тысячами ученых из разных стран. Было даже организовано международное общество по внеклеточным везикулам, а в апреле 2012 г. в Швеции состоялась первая конференция по этой тематике, где было объявлено о создании специализированного журнала.
Точки приложения
Итак, некодирующие РНК являются главными регуляторами, управляющими функциями генов и целых генетических ансамблей, при этом число известных некодирующих РНК постоянно растет. На их концентрацию и соотношение влияют и протекающие в организме патологические процессы (например, опухолевые). Отсюда очевидна перспективность применения методов количественного анализа некодирующей РНК для целей медицинской диагностики. А подавление активности РНК, ассоциированной с развитием болезни, должно стать новым подходом в терапии.
Сегодня известно, что с помощью определенных микроРНК можно блокировать развитие рака предстательной и молочной желез (Tavazoie et al., 2008). МикроРНК рассматриваются и в качестве потенциальных лечебных средств в терапии сердечно-сосудистых заболеваний (Latronico & Condorelli, 2009). Ведутся клинические исследования экзосом, содержащих микроРНК, которые циркулируют в крови при меланомах и различных формах рака легких (Rabinowits et al., 2009).
Подобные исследования активно ведутся и в Сибирском отделении РАН. Благодаря разработанной в Институте химической биологии и фундаментальной медицины СО РАН оригинальной методике высокопроизводительного секвенирования РНК появилась возможность быстро и точно получать информацию о профиле микроРНК в различных клинических образцах. Уже опубликованы данные о спектрах микроРНК здоровых людей (Semenov et al., 2012), ведется работа по определению соответствующих РНК-профилей при различных патологиях.
В ИХБФМ получены и обнадеживающие экспериментальные данные о возможности проведения противоопухолевой и антиметастатической терапии ферментом РНКазой А, который влияет на концентрацию и спектр опухолевых микроРНК в клетках и сыворотке крови больных животных (Mironova et al., 2012).
Исследованиями микроРНК с целью развития диагностических методов занимаются и в недавно организованном Институте молекулярной и клеточной биологии СО РАН (Новосибирск). Например, там был изучен профиль экспрессии некоторых микроРНК при различных опухолях щитовидной железы.
Детальное изучение свойств РНК подтолкнуло исследователей к созданию новых технологий, обещающих принести огромную пользу человечеству уже в ближайшем будущем. Речь идет о широко известной технологии SELEX, позволяющей получать молекулы РНК с заданными свойствами – аптамеры, которые способны селективно и прочно связываться с молекулой-мишенью. Суть аптамерной технологии в том, что сначала химико-ферментативными методами создаются так называемые РНК-библиотеки случайных последовательностей, содержащие огромное множество разнообразных молекул РНК. Затем из этого множества методами молекулярной селекции по способности специфично взаимодействовать с целевой молекулой отбирают аптамеры и нарабатывают их в нужном количестве, хотя искомая РНК может быть представлена в составе библиотеки единственной молекулой.
Сегодня в качестве аптамеров и терапевтических средств используется не только РНК с обычной «природной» структурой: с помощью различных химических модификаций можно получить молекулы, устойчивые к действию разрушающих РНК ферментов, которых много в биологических средах. Такие «искусственные» РНК имеют большие перспективы в диагностике заболеваний: например, можно получить РНК-аптамеры к молекулам – маркерам заболеваний и на их основе создать биосенсоры, обладающие уникальной чувствительностью.
Сочетание основанных на РНК биоаналитических подходов к диагностике заболеваний с новыми -терапевтическими средствами на основе микроРНК и некодирующих РНК в ближайшем будущем должно привести к новому прорыву в медицине.
С каждым годом исследователи открывают все новые и новые грани удивительного «мира РНК». Высокопроизводительные технологии секвенирования нуклеиновых кислот позволили обнаружить в клетках и крови огромное множество разнообразных РНК, среди которых оказались транскрипты тех участков ДНК, которые ранее считались «молчащими».
В результате в конце XX в. удалось открыть природный механизм огромной значимости, управляющий работой клеточного генома, который задолго до этого события был предвосхищен сибирскими учеными в идее «антисмысловых нуклеотидов».
Раскрытие многих тайн «мира РНК», который долгое время скрывался от исследователей за ширмой более узкоспециализированных молекул, белков и ДНК, приблизило нас к пониманию фундаментальных вопросов происхождения жизни. И более того: этот мир РНК, претворившийся в новые перспективные биомедицинские технологии, постепенно становится частью повседневной жизни человечества.
Литература
Власов В. В., Власов А. В. Жизнь начиналась с РНК // НАУКА из первых рук. 2004. № 2 (3). C. 6—19.
Власов А. В. Эволюция в пробирке // НАУКА из первых рук. 2006. № 1 (7). С. 50—59.
Власов В. В. Лекарство для генов // НАУКА из первых рук. 2007. № 2 (14). С. 56—59.
Карпова Г. Г., Грайфер Д. М., Малыгин А. А. Рибосома – минифабрика по производству белков // НАУКА из первых рук. 2006. № 6 (12). С. 46—53.
Франк-Каменецкий М. Д. Самая главная молекула, Москва: Наука, 1983.
Черноловская Е. Л. РНК-интерференция: клин клином… // НАУКА из первых рук. 2008. № 1 (19). С. 54—59.
Knorre D. G., Vlassov V. V., Zarytova V. F. et al. Design and targeted reactions of oligonucleotide derivatives, Boca Raton, CRC Press, 1994.
Vlassov V. V., Pyshnyi D. V., Vorobjev P. E. Nucleic acids: structures, functions, and applications. In Handbook of nucleic acids purification, Ed. D. Liu, Boca Raton, CRC Press, 2009.