Первые победы в 30-летней войне со смертельным онкогеном
По данным Минздрава России за 2018 г., самый летальный вид рака в нашей стране – рак поджелудочной железы. Более 90% больных с таким диагнозом живут не более пяти лет после начала болезни. Подавляющее большинство этих пациентов имеют мутацию в онкогене KRAS – как, впрочем, и многие больные раком легких, половина больных раком толстой и прямой кишки… Ген KRAS кодирует белок, мутантные формы которого стимулируют рост злокачественной опухоли и ее метастазирование. Исследователи уже три десятилетия бьются над задачей «выключения» онкогенного гена, и сегодня на этом фронте достигнуты очевидные успехи
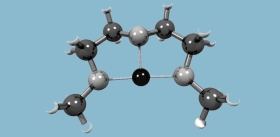
Ген KRAS кодирует небольшой белок, запускающий целый каскад реакций, стимулирующих клеточный рост. В результате его мутации начинается бесконтрольное деление клеток, и такие мутации характерны примерно для четверти всех видов рака. Но хотя ген KRAS был открыт уже более 35 лет назад и считается одной из самых важных мишеней в терапии рака, он успел заслужить репутацию «не поддающегося лечению». Однако исследователи не прекращают поиски эффективных способов подавления работы «мутантных» белков, ответственных за рост смертельных опухолей.
Для воздействия на такой объект, как белок, можно использовать две стратегии. Первая – попытаться изменить (нарушить) пространственную структуру белка с помощью молекулы-ингибитора. Хотя в случае KRAS сделать это трудно: в пространственной структуре этого белка практически нет «карманов», куда могло бы встроиться лекарство. Вторая стратегия – уменьшить активность самого гена и тем самым подавить синтез опасного белка. Сегодня на обоих этих направлениях достигнуты многообещающие результаты.
Что касается первой стратегии, то еще в 2013 г. ученые из Калифорнийского университета в Сан-Франциско (США) обнаружили небольшую молекулу, способную проникнуть в бороздку одного из мутантных белков – KRAS G12C. Такая мутация обнаруживается в 13% наиболее распространенных опухолей легких и в 2–3% других опухолей. На основе улучшенной версии этой молекулы были созданы лекарства, и сейчас уже две американские биотехнологические компании объявили об успешных результатах их доклинических и клинических испытаний.
Так, уже в первых испытаниях препарата AMG510 на больных раком легких на последней стадии у двух из четырех пациентов после 6 недель лечения опухоль уменьшилась. А недавно аналогичные результаты были получены на выборке из 13 больных. Есть вероятность, что AMG510 может эффективнее работать вместе с противораковыми иммунопрепаратами. Иммунотерапия считается перспективным методом борьбы с раком, но на практике большинству пациентов она не помогает. Однако при совместном введении AMG510 и препарата, активирующего иммунные клетки Т-киллеры, удалось подавить рост опухолей у девяти из десяти лабораторных мышей. Эту лекарственную комбинацию уже начали тестировать на больных людях.
Вторая стратегия борьбы с «неподдающимся» мутантным геном KRAS связана с использованием механизма РНК-интерференции, мало знакомого широкой публике. Этот механизм клетка использует для того, чтобы уничтожать чужеродную генетическую информацию (многие вирусы имеют не ДНК, а РНК-геномы), а также снижать активность собственных генов, работа которых не нужна в данный момент.
Как известно, генетическая информация с ДНК считывается на РНК, которая и служит матрицей – именно по этой матрице «собирается» белок. Чтобы блокировать синтез белка, клетка использует небольшие двуцепочечные молекулы РНК (малые интерферирующие РНК или siРНК). В комплексе с другими клеточными белками siРНК способны распознавать и связываться с конкретной матричной РНК, после чего последняя уничтожается. Синтетические siРНК теоретически можно использовать для регулировки активности практически любого гена, однако доставить их в нужный орган или ткань – дело непростое.
Исследователи из Школы медицины Вашингтонского университета в Сент-Луисе и Университета здоровья Южной Флориды (США) применили специально разработанные наночастицы для доставки в раковые клетки siРНК, точно нацеленные на ген KRAS. Попытки создать подобные препараты предпринимались и ранее, но были не слишком удачны. На этот раз ученые использовали в качестве основы наночастиц пептиды. Как показали результаты доклинических испытаний препарата на клеточных культурах и лабораторных мышах, во всех этих случаях наблюдалось увеличение гибели раковых клеток, и рост опухоли останавливался.
Рак поджелудочной трудно поддается лечению отчасти и потому, что опухоль, как раковина моллюска, окружена очень плотной фиброзной тканью. Но пептидные наночастицы с siРНК справились с этой проблемой. Благодаря своей конструкции они легко попадают в «дырявую» сосудистую сеть микроокружения опухоли, но не проходят через нормальные сосудистые барьеры. А так как они заряжены положительно, их «жадно» поглощают заряженные отрицательно раковые клетки. Все это позволяет избежать неблагоприятных «нецелевых» эффектов лечения.
Подобные подходы, точно нацеленные на конкретные опухолевые мишени, относятся к так называемой таргетной терапии, более безопасной и в некоторых случаях более эффективной, чем обычная химиотерапия. Многие исследователи называют ее будущим онкологической помощи, а увеличение разнообразия подобных препаратов позволит подбирать лечение все более индивидуально.
Фото из статьи E.Л. Челноловской «РНК-интерференция. Клин клином...» и https://visualsonline.cancer.gov