Клетка: из зрелости – в детство
То, что клетки ранних эмбрионов способны превращаться в любые клетки взрослого организма, ученые знают уже три десятилетия. Однако этические проблемы, связанные с использованием эмбрионов, мешали и до сих пор мешают широкому применению таких недифференцированных клеток в медицине. Эти ограничения клеточных технологий удалось преодолеть в 2006 г., когда был открыт простой способ «возвращать в детство» зрелые клетки взрослого организма. Это открытие десятилетия может означать, что революция в медицине уже не за горами
Каждый из нас когда-то был одной клеткой. С того самого момента, когда сперматозоид слился с яйцеклеткой, образуя зиготу, и до тех пор, пока эта клетка не поделилась на дочерние. Потом каждая из этих клеток поделилась еще раз, и еще, и еще…
Сейчас в каждом из нас около пятидесяти триллионов клеток. Какие-то из них проводят нервные импульсы, другие производят соляную кислоту в желудке или инсулин в поджелудочной железе, а некоторые толстым слоем «облагораживают» талию. Так из одной оплодотворенной яйцеклетки получилось множество разных типов дифференцированных клеток. Говорят, что зигота тотипотентна, т.е. способна дать начало вообще любым клеткам организма, даже тем, которых у читателей этой статьи уже давно нет – например, клеткам плаценты эмбриона.
Хотя тотипотентность в процессе развития теряется очень быстро, клетки эмбриона на самых ранних стадиях развития сохраняют плюрипотентность – способность порождать любые клетки, которые в принципе имеются во взрослом организме. В ходе дальнейшего развития организма эмбриональные стволовые клетки постепенно теряют свою плюрипотентность: сначала они превращаются в мультипотентные – способные давать начало многим, но уже не всем клеточным типам, затем в олигопотентные – предшественники только немногих типов клеток, и так далее. Наконец, многие клетки в конце концов становятся терминально дифференцированными, т. е. приобретают свою окончательную форму и функцию и далее уже не делятся (ярким примером таких дифференцированных клеток являются эритроциты – клетки крови, которые лишены клеточного ядра).
Впервые эмбриональные стволовые клетки были получены из мышиных эмбрионов английскими исследователями М. Эвансом и М. Кауфманом в Кембридже в 1981 г., причем Эванс за это достижение был впоследствии удостоен Нобелевской премии. Но прошло еще 17 лет, прежде чем американец Д. Томсон смог сделать то же самое с эмбриональными стволовыми клетками человека. Довольно скоро после этого эмбриональные стволовые клетки, содержащиеся в клеточной культуре вне организма, научились превращать в клетки почти любых типов. На горизонте замаячила революция в медицине: внезапно появилась реальная возможность замещать больные клетки или погибшие в результате инфаркта или инсульта, болезни Паркинсона или Альцгеймера, при травмах спинного мозга, диабете, слепоте, и даже при утере зубов и волос…
На фоне таких головокружительных перспектив неразрешимой оставалась одна принципиальная задача: откуда брать эмбриональные стволовые клетки для взрослого пациента? Ведь они должны быть генетически идентичны собственным клеткам организма, иначе иммунная система их отторгнет.
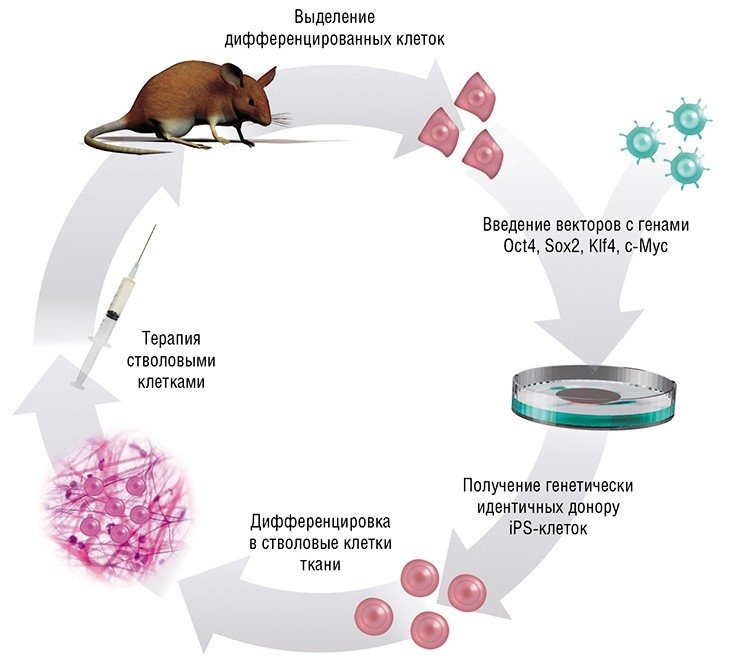
Все изменилось в первом десятилетии нынешнего века, когда японский ученый С. Яманака (2006) показал, что даже терминально дифференцированные клетки можно «перепрограммировать», вернув в плюрипотентное состояние. Такие клетки сейчас принято называть iPS-клетками (от англ. «индуцированные плюрипотентные стволовые клетки»).
Оказалось, что для перепрограммирования клеток достаточно ввести в них сконструированные на основе вирусов активные генетические конструкции, несущие четыре определенных гена. Белки, кодируемые этими генами, представляют собой так называемые транскрипционные факторы, которые связываются с определенными участками ДНК в регуляторных районах других генов, меняя их активность.
 Комбинация этих генов может вернуть почти любой клетке «эмбриональные способности», но в некоторых случаях для превращения одного типа клеток в другой требуется приложить гораздо меньше усилий. Например, чтобы вернуть плюрипотентность клеткам-предшественникам нейронов, достаточно ввести в них один ген, а клетку печени можно превратить в клетку поджелудочной железы, вырабатывающую инсулин, парой других генов. Но вот какие именно гены меняют свою активность под влиянием этих перепрограммирующих факторов, в результате чего клетка меняет свою сущность, в большинстве случаев пока остается загадкой. Позднее, кстати сказать, были разработаны и другие способы перепрограммирования клеток – без участия вирусных конструкций, а с помощью только белков, специальных регуляторных РНК или других, небольших, молекул, способных регулировать активность генов.
Комбинация этих генов может вернуть почти любой клетке «эмбриональные способности», но в некоторых случаях для превращения одного типа клеток в другой требуется приложить гораздо меньше усилий. Например, чтобы вернуть плюрипотентность клеткам-предшественникам нейронов, достаточно ввести в них один ген, а клетку печени можно превратить в клетку поджелудочной железы, вырабатывающую инсулин, парой других генов. Но вот какие именно гены меняют свою активность под влиянием этих перепрограммирующих факторов, в результате чего клетка меняет свою сущность, в большинстве случаев пока остается загадкой. Позднее, кстати сказать, были разработаны и другие способы перепрограммирования клеток – без участия вирусных конструкций, а с помощью только белков, специальных регуляторных РНК или других, небольших, молекул, способных регулировать активность генов.
Главная причина, по которой iPS-клетки привлекают такое пристальное внимание (Яманака получил все престижнейшие научные премии, кроме Нобелевской, которая тоже наверняка не за горами), лежит вовсе не в их интереснейших свойствах, а в этической плоскости. Ведь для получения плюрипотентных эмбриональных стволовых клеток нужны человеческие эмбрионы на ранних стадиях развития. В начале 2000-х гг. велись даже острые дискуссии о том, насколько этичным было бы клонировать пациента, получить генетически идентичные ему эмбриональные стволовые клетки из эмбриона и использовать их для медицинских целей.
Можно по-разному относиться к допустимости такой практики, признавать или не признавать дробинку из сотни развивающихся клеток за человеческое существо, но обойти моральные вопросы здесь все равно не удастся, а достичь удовлетворяющего всех консенсуса, как показывает жизнь, невозможно. Открытие iPS-клеток дало надежду, что появился – или вскоре появится – «этически чистый» и неограниченный источник стволовых клеток. И хотя пока такие клетки по своим свойствам не полностью аналогичны эмбриональным клеткам, а также обладают высоким потенциалом вызывать раковые опухоли, мало кто сомневается в их перспективном будущем.
Сегодня перепрограммирование клеток прочно заняло место в списках самых многообещающих биомедицинских технологий. Возможно, свой вклад в эту историю смогут внести и ученые, работы которых связаны с исследованиями регуляции активности генов.
Известно, что эти процессы в ходе развития клетки регулируются за счет биохимической реакции метилирования, когда специальные ферменты присоединяют метильную группу СН3 к цитозину – одному из азотистых оснований, входящих в состав нуклеотидов ДНК. Такому изменению подвергается только тот цитозин, который в цепочке ДНК соседствует с другим азотистым основанием – гуанином. И таких кусочков ДНК много именно в регуляторных областях генов.
Объемистая метильная группа служит отличным ориентиром для специальных белков, которые связываются с метилированной ДНК и мешают проявлению активности генов. У клеток, которые продвинулись по пути специализации достаточно далеко, метилированы и, соответственно, инактивированы многие гены – просто потому, что они этим клеткам уже не нужны.
Химическая связь между метильной группой и ДНК очень прочна. Конечно, при делении клетки во вновь построенную цепь ДНК будет включаться нормальный цитозин, и через несколько циклов деления в каких-то дочерних клетках метилирование в этом месте может исчезнуть. Однако большинство дифференцированных клеток теряет способность к делению, да и в тех клетках, что ее сохранили, активно работают ферменты, поддерживающие метилирование.
Но значит ли это, что метилирование необратимо? Оказывается, нет. В 2009 г. были открыты сразу два способа, которые клетки используют для активного деметилирования, и оба они оказались основаны на системе репарации* («ремонта») ДНК , которую клетка сама же сначала целенаправленно повреждает!
Изучением процессов деметилирования генов сегодня занимаются и в группе взаимодействий биополимеров Института химической биологии и фундаментальной медицины СО РАН (Новосибирск) в содружестве с учеными из Парижского университета. Вполне вероятно, что на основе результатов исследования работы систем репарации ДНК удастся создать новые, более эффективные методы перепрограммирования клеток.
Литература
Аксенова Л. Особенности национальной регенерации // Наука и жизнь. 2012. № 2. С. 32—37.
Мальцева В.В., Болдырев А.А. Снова о стволовых клетках // Химия и жизнь. 2009. № 9. С. 18—23.
Хохедлингер К. Персональные целители // В мире науки. 2010. № 7. С. 24—31.
*О системе репарации ДНК читайте в «НАУКЕ из первых рук» (№ 6, 2006 г.; № 3, 2007 г.; № 4, 2009 г.)