Позолотить клетку
Коллоидное золото, издавна применяемое для лечебных целей, и сегодня под именем «нанозолота» активно используется в медицинской практике и в биомедицинских исследованиях. Однако механизм его терапевтического воздействия на организм до сих пор не установлен. Специалистам из Института химической биологии и фундаментальной медицины СО РАН (Новосибирск) впервые удалось проследить начальные этапы реального взаимодействия золотых наночастиц с клетками в условиях клеточной культуры и организма
Китайские, арабские и индийские ученые получали и использовали коллоидное золото в лечебных целях еще в V—IV вв. до н. э. В средние века его применяли многие врачи, включая знаменитого Парацельса, а алхимики пытались на его основе создать средство, возрождающее молодость и здоровье. В 1857 г. М. Фарадей опубликовал первую статью, посвященную методам синтеза и свойствам коллоидного золота, получившего в конце ХХ в. модную приставку «нано-». Последняя оказалась не просто лингвистическим довеском: взгляд на коллоидное золото, как на объект нанотехнологий, вызвал всплеск исследований, выявивших новые свойства давно известного металла и новые области его применения.
Сегодня благородный металл применяется в лечении ревматоидного артрита и других тяжелых аутоиммунных заболеваний, а также в медицинской диагностике в качестве контрастирующего агента. Новым перспективным направлением является использование золотых наночастиц как структурной основы нанокомпозитов, применяющихся для доставки в клетки молекул с лечебным эффектом.
Во всех этих случаях наночастицы золота попадают внутрь организма человека и контактируют с клетками. Но безопасно ли «золотить» организм для борьбы с недугами? Чтобы не навредить пациенту, нужно знать, как наночастицы золота воздействуют на клетки, а для разработки препаратов адресной доставки необходимы сведения о путях проникновения наночастиц в клетку и их перемещении внутри клетки. Очень важен и вопрос о «судьбе» попавшего в клетки нанозолота. Как ни странно, ответы на эти вопросы нельзя найти среди тысяч современных публикаций, посвященных исследованиям этого материала.
Чтобы приблизиться к пониманию механизмов взаимодействия золотых наночастиц с клетками, исследователи из ИХБФМ СО РАН изучили проникновение сферических золотых наночастиц размером около 16 нм в клетки HeLa – широко применяемой культуры клеток человека, а также в клетки гепатомы А1 – опухоли, растущей непосредственно в перитонеальной полости мышей (клетки этой формы опухоли локализуются в асцитической жидкости свободно, не формируя плотных скоплений).
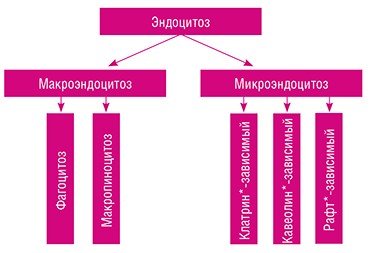 Наночастицы золота добавляли к питательной среде, в которой растут клетки культуры HeLa. При температуре 37 °С в них начинает работать так называемый эндоцитоз – процесс захвата клеткой веществ путем втягивания участка плазматической мембраны с последующим формированием внутри клетки пузырьков с внеклеточным содержимым. В зависимости от размеров формирующихся пузырьков говорят о макро- и микроэндоцитозе.
Наночастицы золота добавляли к питательной среде, в которой растут клетки культуры HeLa. При температуре 37 °С в них начинает работать так называемый эндоцитоз – процесс захвата клеткой веществ путем втягивания участка плазматической мембраны с последующим формированием внутри клетки пузырьков с внеклеточным содержимым. В зависимости от размеров формирующихся пузырьков говорят о макро- и микроэндоцитозе.
Макроэндоцитоз подразделяют на фагоцитоз, который обеспечивает поступление в клетку «твердых» частиц (обломков погибших клеток, бактерий), и макропиноцитоз, служащий для захвата относительно «больших» объемов внеклеточной жидкости.
Все виды микроэндоцитоза – клатрин-зависимый, кавеолин-зависимый и несколько видов рафт-зависимых * – «работают» с отдельными макромолекулами и их группами: захватывают их, сортируют и направляют в «нужное» место; этими же способами проникают в клетку и вирусы. Заканчивая краткий экскурс в терминологию, отметим, что проблемы эндоцитоза относятся к «горячим» направлениям современной биологии и сегодня активно разрабатываются, однако пока хорошо изучен лишь клатрин-зависимый тип эндоцитоза.
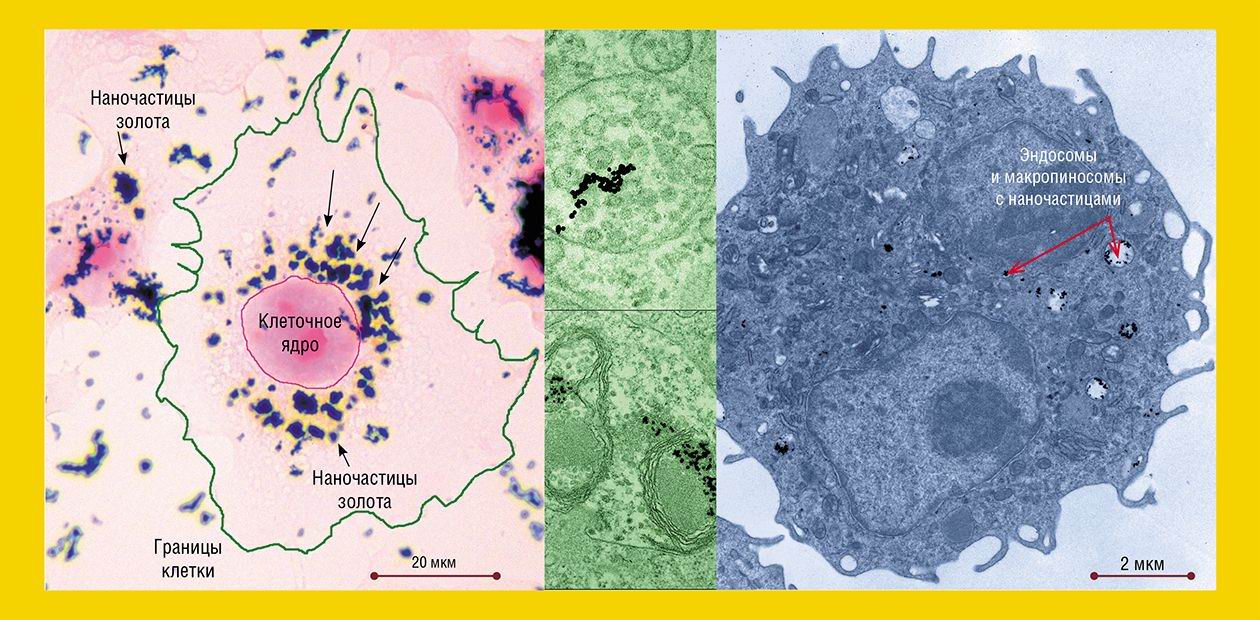
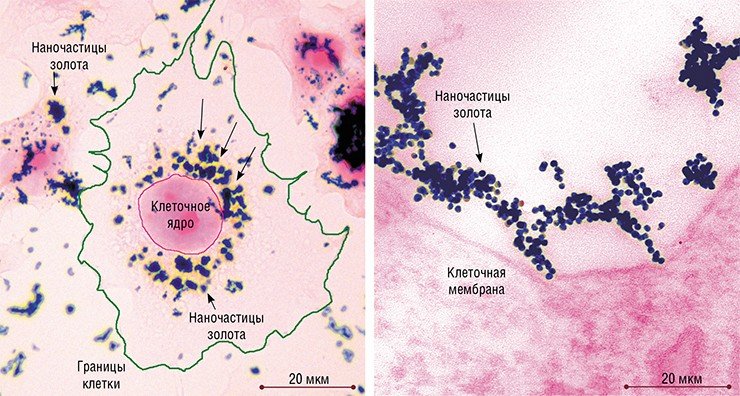
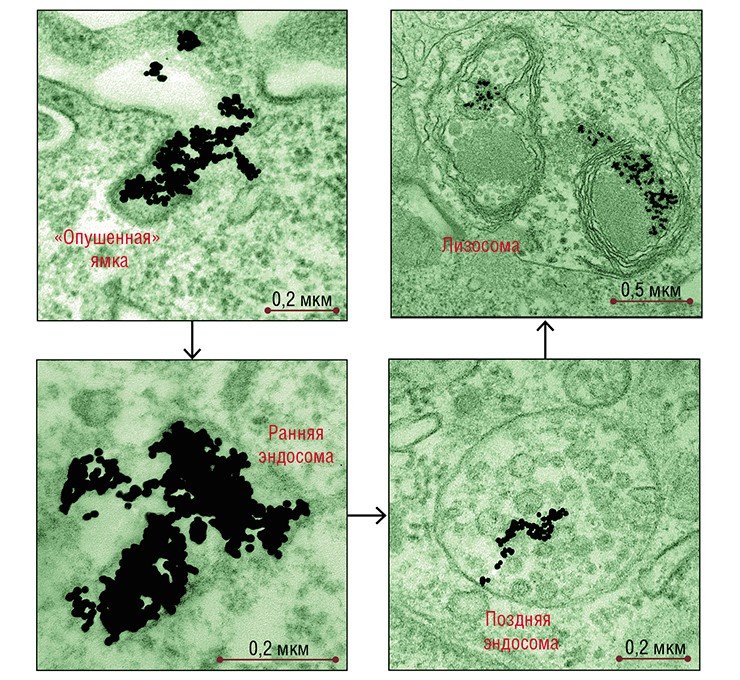
Что касается золотых наночастиц, то уже после 5 минут инкубации с клетками HeLa они обнаруживались в «опушенных» пузырьках и ямках – структурах, характерных для клатрин-зависимого эндоцитоза («опушение»образует белок клатрин). Через 30 минут количество «опушенных» структур достигало максимума, а потом постепенно снижалось.
В полном соответствии с «дорожной картой» клатрин-зависимого эндоцитоза наночастицы поступали на «сортировочную» станцию – в ранние, а затем в поздние эндосомы, сформированные мембраной округлые структуры с трубчатыми выростами. Эндосомы различаются набором ферментов и функциями: в ранних происходит сортировка макромолекул и частиц, а поздние расщепляют поступившие вещества с помощью гидролитических ферментов.
В клетках HeLa число поздних эндосом с наночастицами, как и количество самих наночастиц в них, нарастало в течение нескольких часов. Поздние эндосомы затем, как и положено, трансформировались в лизосомы, функцией которых является расщепление как поступивших извне веществ, так и «отработавших свое» собственных клеточных структур.
Однако клатрин-зависимый эндоцитоз обеспечивал поступление в клетки культуры HeLa лишь части золотых наночастиц. Еще часть попадала в клетку посредством схожего с ним кавеолин-зависимого эндоцитоза (кавеолы – фляжкоподобные углубления плазматической мембраны особого химического состава). Из кавеол наночастицы переносились посредством пузырьков в кавеосомы (аналоги ранней эндосомы), затем – в поздние эндосомы и т. д. Часть наночастиц попадала в клетку также путем рафт-зависимого эндоцитоза, о чем свидетельствовали редкие пузырьки соответствующей структуры у поверхности клеток.
Судя по данным световой микроскопии, ассоциаты наночастиц проникали в клетку и путем фагоцитоза, как другие крупные объекты. Однако тот факт, что через 2—3 суток инкубации основная масса наночастиц находилась в лизосомах или поздних эндосомах, свидетельствует, что основным путем их проникновения в клетки является все-таки микроэндоцитоз.
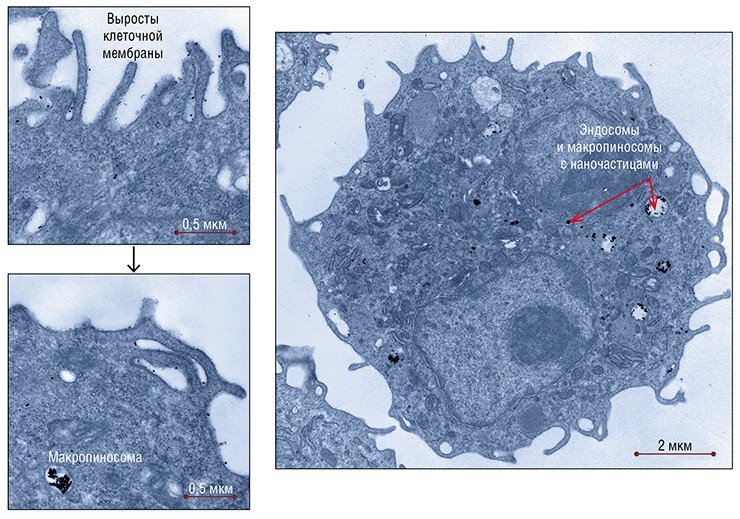
Процесс поглощения нанозолота клетками гепатомы А1 у лабораторных мышей отличался рядом особенностей. В основном наночастицы обнаруживались там в мелких пузырьках и трубочках, отражающих активные процессы рафт-зависимого эндоцитоза, а также в структурах, связанных с макроэндоцитозом – фагоцитозом и особенно макропиноцитозом, которые характерны для этих опухолевых клеток.
В процессе макропиноцитоза на поверхности клетки формируются длинные тонкие выросты-складки, которые смыкаются, захватывая все, что попадет внутрь. В результате образуется мембранный пузырь – макропиносома. Процессы утилизации веществ, поступивших в клетку путем макропиноцитоза, изучены слабо – априори считается, что макропиносомы впоследствии сливаются с лизосомами, без чего невозможна утилизация захваченных клеткой веществ. Несомненно лишь, что этот неспецифический путь поступления веществ не характерен для «нормальных» клеток организма, ведущих строгий «надзор» за поступающим в клетку материалом. Зато клетки опухоли с его помощью могут захватывать большие объемы жидкости, из которой они извлекают питательные вещества.
С течением времени проявления рафт-зависимого эндоцитоза в клетках гепатомы уменьшались, а основная масса наночастиц локализовалась в эндосомах и макропиносомах. И спустя несколько часов после введения наночастиц они продолжали оставаться в эндосомах, при этом трансформация последних в лизосомы не наблюдалась.
Судя по результатам этого исследования, разные типы клеток по-разному взаимодействуют с наночастицами золота. Некоторые ученые предполагают, что золотые наночастицы могут непосредственно связываться с клеточными рецепторами. Однако экспериментальные данные свидетельствуют скорее в пользу другой версии: что наночастицы попадают в клетку пассивно, вместе с другими поглощаемыми веществами, и теми путями, которые являются наиболее «естественными» для клеток данного типа.
В обоих случаях золотые наночастицы «застревали» в замкнутом пространстве эндосомально-лизосомальных структур, будучи изолированы от клеточной цитоплазмы непроницаемой мембранной оболочкой. Эти данные необходимо учитывать при конструировании комбинированных лечебных препаратов, так чтобы лечебная молекула могла отделяться от золотого «носителя» и попадать в цитоплазму клетки еще на стадии формирования ранних эндосом.
Конечно, пока ничего нельзя сказать о том, насколько прочной является эта мембранная «ограда», способна ли она удержать наночастицы до момента гибели клетки и не будут ли заключенные в лизосомы наночастицы провоцировать патологические реакции клеток? Поиск ответов на эти и другие далеко не «нановопросы» является предметом дальнейших исследований. Что же касается возможных практических приложений, то одному их них посвящен Интеграционный проект СО РАН № 9 «Разработка методов лазерного нагрева металлических наночастиц в биологических тканях для термического разрушения патологических клеток», в рамках которого была выполнена эта работа.
Д. б. н. Е. И. Рябчикова, к. х. н И. А. Пышная, Ю. Е. Спицына
(Институт химической биологии и фундаментальной медицины СО РАН, Новосибирск)
Литература
Дыкман Л. А., Хлебцов Н. Г. Золотые наночастицы в биологии и медицине: достижения последних лет и перспективы // ACTA NATURAE, 2011. Т. 3. № 2 (9). С. 36—59.
Chithrani D. B. Optimization of Bio-Nano Interface Using Gold Nanostructures as a Model Nanoparticle System // Insciences J. 2011. 1(3). P. 115—135.
Levy R., Shaheen U., Cesbron Y., See V. Gold nanoparticles delivery in mammalian live cells: a critical review // Nano Reviews. 2010. 1: 4889.
Sharma V., Park R., Srinivasarao M. Colloidal dispersion of gold nanorods: Historical background, optical properties, seed-mediated synthesis, shape separation and self-assembly // Materials Science and Engineering: R: 65 (2009). P. 1—38.
*Клатрин и кавеолин – белки, обеспечивающие изгибание плазматической мембраны и формирование пузырьков; рафты – скопления липидов в плазматической мембране, организованные особым образом