Бактериофаг, мы тебя видим!
Прошло сто лет с того времени, как английский микробиолог Ф. Туорт отметил прозрачные стекловидные пятна в колониях микрококков, где погибли бактериальные клетки. После открытия бактериофагов их исследования долгое время имели феноменологический характер из-за недостаточного развития экспериментальных методов. Ученые не имели возможности детально изучить особенности противобактериального воздействия бактериофагов, так как последние нельзя увидеть не только невооруженным глазом, но и с помощью светового микроскопа. Изучение вирусов, в том числе вирусов бактерий, вышло на принципиально новый уровень лишь с созданием и внедрением в научную практику электронного микроскопа
С появлением электронной микроскопии стало понятно, что бактериофаги являются даже не микро- а наноорганизмами, так как их размеры не превышают 100 нм. Также оказалось, что по своему строению они отличаются колоссальным разнообразием. Соответственно, возник вопрос об их номенклатуре. В основу первой классификации, которая была предложена еще в 1943 г., легли особенности строения фагов, установленные с помощью электронной микроскопии. Один из ее основоположников, Э. Руска, в своей общей схеме классификации вирусов выделил бактериофаги отдельно, разделив их на три типа по морфологическим характеристикам (Ackermann, 2009).
В основу современной систематики бактериофагов, созданной в 1967 г., легла классификация, включавшая шесть морфотипов. Но по мере открытия новых бактериофагов в нее включались новые семейства, роды и виды. С развитием методов молекулярной биологии появились дополнительные критерии классификации, учитывающие тип нуклеиновой кислоты и (или) композицию белков в составе фага.
Применение в исследованиях бактериофагов современных молекулярных методов, позволило выявить множество особенностей этих интересных организмов. Сами бактериофаги в свою очередь оказались для молекулярных биологов очень полезным методологическим инструментом (Brussow, 2013).
Была бы голова, а хвост будет
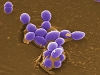
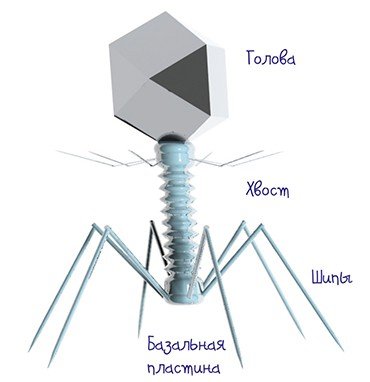
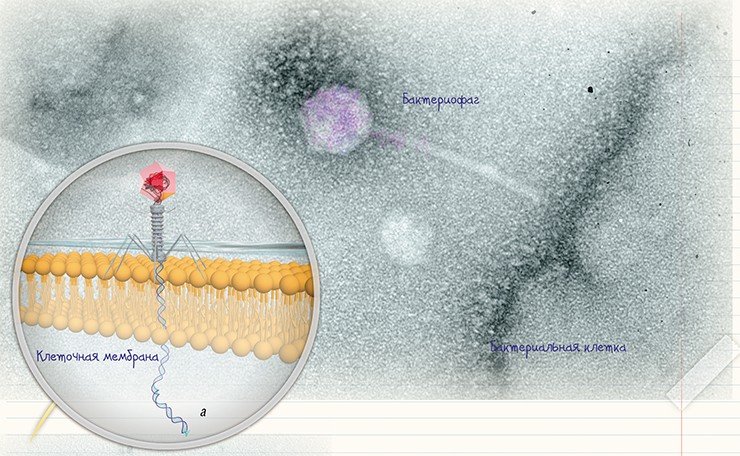
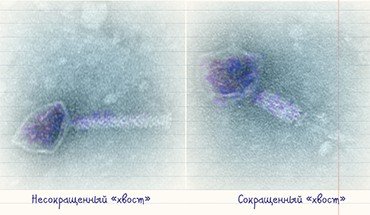 Бактериофаги, по сути, устроены сравнительно просто: каждый такой вирус представляет собой комплекс нуклеиновой кислоты и белков, упакованных особым образом. Форма их может быть причудлива, однако около 96 % всех известных бактериофагов имеют «хвостатый» фенотип (Matsuzaki et al., 2005): у них имеется «голова» икосаэдрической формы (белковый резервуар, где упакована нуклеиновая кислота) и «хвост» – белковая структура, где расположены элементы, способные прочно связываться с рецепторами (особыми белками или полисахаридами) на поверхности бактерии. Разные виды «хвостатых» бактериофагов различаются размерами «головы», длинной и тонкой структурой «хвоста».
Бактериофаги, по сути, устроены сравнительно просто: каждый такой вирус представляет собой комплекс нуклеиновой кислоты и белков, упакованных особым образом. Форма их может быть причудлива, однако около 96 % всех известных бактериофагов имеют «хвостатый» фенотип (Matsuzaki et al., 2005): у них имеется «голова» икосаэдрической формы (белковый резервуар, где упакована нуклеиновая кислота) и «хвост» – белковая структура, где расположены элементы, способные прочно связываться с рецепторами (особыми белками или полисахаридами) на поверхности бактерии. Разные виды «хвостатых» бактериофагов различаются размерами «головы», длинной и тонкой структурой «хвоста».
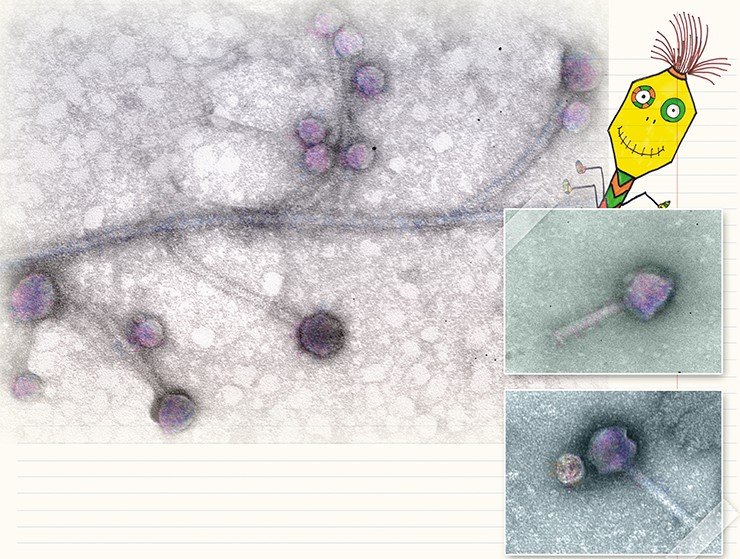
 Чтобы узнать вид бактериофага, нужно определить его ультраструктурные характеристики, для чего используют метод негативного контрастирования. Образцом может служить любая суспензия, содержащая фаги: вода из природного источника, смывы с кишечника животных или суспензия бактериальных клеток после инкубации с бактериофагом в условиях лаборатории. На каплю подготовленной суспензии помещают специальную медную сетку, покрытую тонкой полимерной пленкой, на которую и сорбируются бактериофаги. Затем сетку обрабатывают контрастирующим веществом (обычно уранилацетатом или фосфорно-вольфрамовой кислотой), которое окружает частицы бактериофага и создает темный фон, на котором бактериофаги, имеющие низкую электронную плотность, становятся видны в электронном микроскопе.
Чтобы узнать вид бактериофага, нужно определить его ультраструктурные характеристики, для чего используют метод негативного контрастирования. Образцом может служить любая суспензия, содержащая фаги: вода из природного источника, смывы с кишечника животных или суспензия бактериальных клеток после инкубации с бактериофагом в условиях лаборатории. На каплю подготовленной суспензии помещают специальную медную сетку, покрытую тонкой полимерной пленкой, на которую и сорбируются бактериофаги. Затем сетку обрабатывают контрастирующим веществом (обычно уранилацетатом или фосфорно-вольфрамовой кислотой), которое окружает частицы бактериофага и создает темный фон, на котором бактериофаги, имеющие низкую электронную плотность, становятся видны в электронном микроскопе.
На сегодняшний день с помощью электронной микроскопии описано свыше 6,3 тыс. бактериофагов (Ackerman, Tiekotter, 2012; Ackermann, Prangishvili, 2012). Оказалось, что далеко не у всех бактериофагов можно четко выделить «голову» и «хвост», а что касается их наследственного материала, то наиболее часто встречаются фаги с двуцепочечной ДНК. Систематика бактериофагов очень динамична, поскольку регулярно обнаруживаются новые фаги (Ackermann, 2007).
Охота на бактерию
Совершенствование методов электронной микроскопии позволило визуализировать не только сами бактериофаги, но и процесс их размножения. Наиболее детально исследован процесс проникновения в клетку «хвостатых» бактериофагов, описаны молекулярные механизмы «впрыскивания» фаговой ДНК в цитоплазму бактериальной клетки (Guerrero-Ferreira, Wright, 2013).
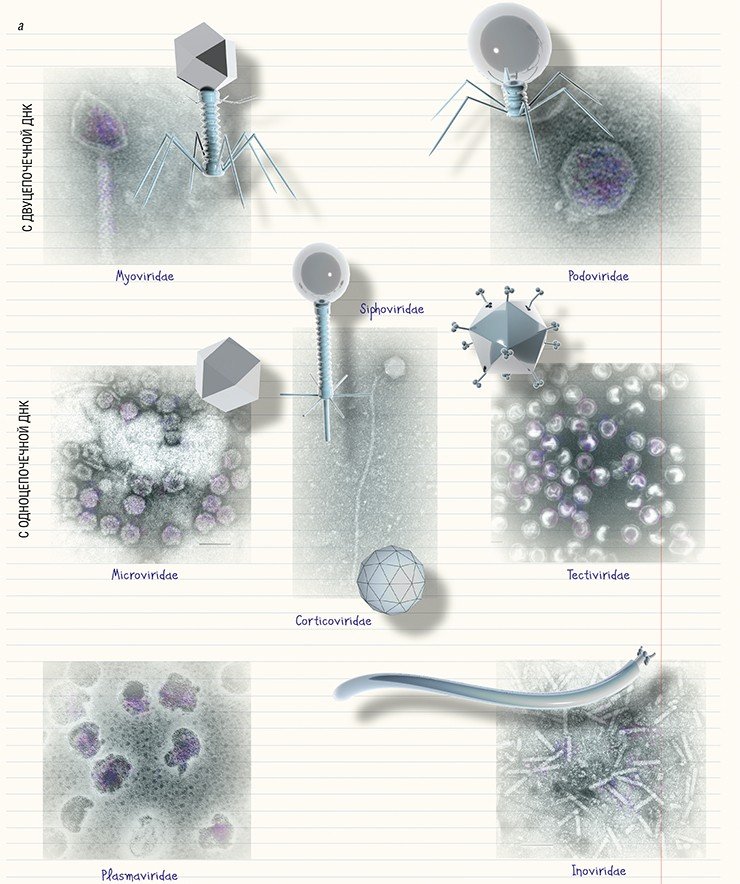
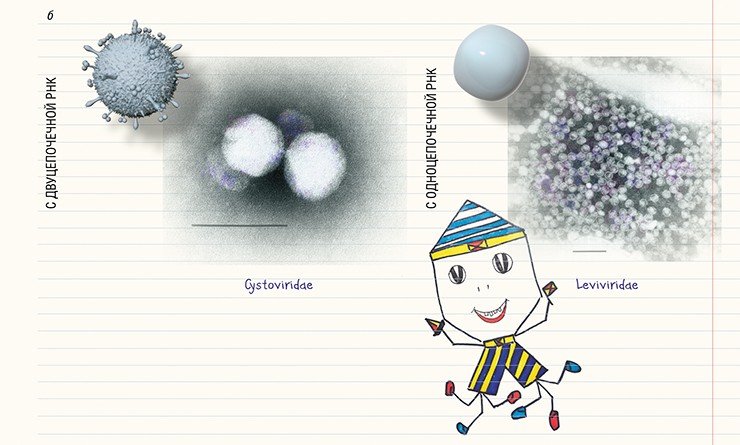
Уникальные характеристики археофагов наряду с существованием трех «клеточных линий» на планете – бактерий, архей и эукариотов (ядерных организмов), свидетельствуют о наличии трех специфических вирусных «доменов», образовавшихся в результате долгой совместной эволюции вирусов и их «хозяев», хотя некоторые из этих вирусов сохранили следы их общего происхождения (Pina et al., 2011)
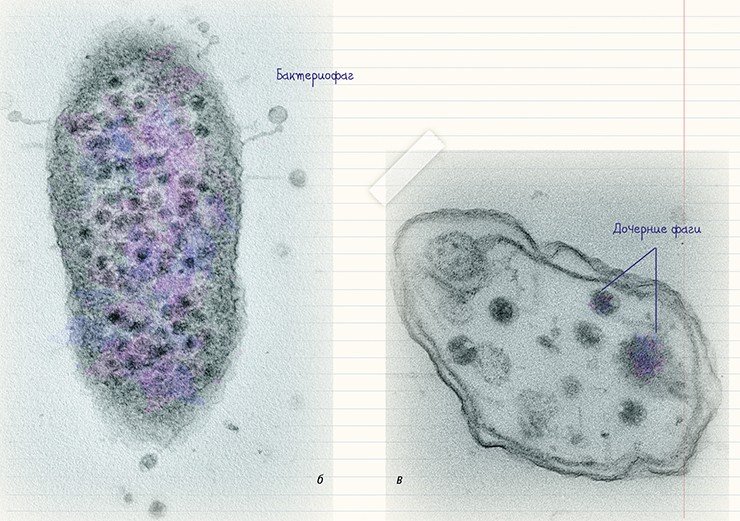
Типичное поведение бактериофага при «нападении» на бактерию можно проследить на примере лизирующего фага. Сначала фаг прикрепляется к поверхности бактерии, используя ее рецепторы в качестве «якоря». Затем его «хвост» с помощью специальных белков внедряется в бактериальную стенку – образуется «канал», по которому нуклеиновая кислота фага вбрасывается в клетку. В течение следующего получаса в клетке бактерии происходит синтез белковых и нуклеиновых компонентов фагов и сборка новых фаговых частиц. После этого клетка разрушается, освобождая зрелые вирионы.
Сочетание методов негативного контрастирования и ультратонких срезов* позволяет проследить все этапы воспроизводства бактериофагов, включая сорбцию частиц фага на поверхности бактериальных клеток, их проникновение в клетки и копирование. К сожалению, эта область исследований разработана существенно хуже, чем визуализация и идентификация бактериофагов методом негативного контрастирования. Между тем ультраструктурные характеристики каждого из этапов жизненного цикла бактериофагов могут быть полезны для адекватной оценки эффективности разрабатываемых методов фаговой терапии.
Бактериофаги, несомненно, представляют собой уникальное явление на нашей планете: с одной стороны, они просто устроены, с другой – характеризуются колоссальным разнообразием как своей морфологии, так и своих потенциальных «жертв».
Для нас эти наноорганизмы не только безопасны, но и «дружествены», так как способны убивать патогенные бактериальные клетки, не затрагивая при этом клетки высших организмов, включая человека, а также сельскохозяйственных животных или растений. Это свойство позволяет использовать бактериофаги для терапии бактериальных инфекций, следуя принципу «враг моего врага – мой друг».
Перспективность фаговой терапии определяется не только самим фактом уничтожения бактерий фагами, но и высокой специфичностью взаимодействия фаг-«хозяин». Наконец, поскольку речь идет о природном феномене, человек может воздействовать на патогенные бактерии, не применяя вредные химические агенты.
* При методе ультратонких срезов клетки заливают в особую смолу, и из получившихся твердых блоков готовят срезы толщиной 60—80 нм на ультрамикротоме с помощью стеклянного или алмазного ножа
Литература
Ackermann H. W., Prangishvili D. Prokaryote viruses studied by electron microscopy. 2012. N. 157. P. 1843—1849.
Ackermann H. W., Tiekotter K. L., Murphy’s law – if anything can go wrong, it will // Bacteriophage. 2012. N. 2:2. P. 122—129.
Bacteriophages methods and protocols / Ed. A. M. Kropinski, R. J. Clokie. Humana Press, 2009. V. 1.
Duckworth D. H. Who discovered bacteriophage? // Bacteriological reviews. 1976. V. 40. N. 4. P. 793—802.
Introduction: a short history of virology // Viruses and man: a history of interactions / Ed. M. W. Taylor. Springer, 2014. P. 1—21.
Krylov V. N. Phage therapy in therms of Bacteriophage genetics: hopes, prospects, safety, limitation // Rus. J. of genetics. 2001. V. 37. N. 7. P. 869—887.
Matsuzaki S., Rashel M., Uchiyama J., et al. Bacteriophage therapy: a revitalized therapy against bacterial infectious deseases // J. Infect. Chemother. 2005. N. 11. P. 211—219.
В публикации использованы фото авторов и рисунки Жени Власова