Рибосома – минифабрика по производству белков
Одним из наиболее сложных процессов, осуществляемых живыми существами, является, пожалуй, синтез белков — важнейших структурных и функциональных «кирпичиков» любого организма. Подлинное понимание молекулярных процессов, лежащих в его основе, могло бы пролить свет на неимоверно давние события, связанные с тайной зарождения самой Жизни...
Во всех живых организмах, от простейших бактерий до человека, белки синтезируются специальными клеточными устройствами рибосомами. На этих уникальных фабриках происходит образование белковой цепи из отдельных аминокислот.
В клетках, ведущих интенсивный белковый синтез, рибосом очень много: так, в одной бактериальной клетке содержится около 10 тыс. этих минифабрик, составляющих до 30% общей сухой массы клетки! В клетках высших организмов рибосом содержится меньше — их число зависит от типа ткани и уровня метаболизма клетки.
Рибосома синтезирует белок со средней скоростью 10—20 аминокислот в секунду. Точность трансляции исключительно высока — ошибочное включение «неправильного» аминокислотного остатка в цепь белка составляет в среднем одну аминокислоту на 3 тыс. звеньев (при средней длине белковой цепи у человека в 500 аминокислотных остатков), т. е. всего одна ошибка на шесть белков.
О генетическом коде
Программа, задающая последовательность аминокислотных остатков в белке, записана в геноме клетки: около полувека назад было установлено, что аминокислотные последовательности всех белков непосредственно закодированы в ДНК с помощью так называемого генетического кода. Согласно этому коду, универсальному для всех живых организмов, каждой из двадцати существующих аминокислот соответствует свой кодон — тройка нуклеотидов, представляющих собой элементарные единицы цепочки ДНК. Любой белок закодирован в ДНК определенной последовательностью кодонов. Эта последовательность называется геном.
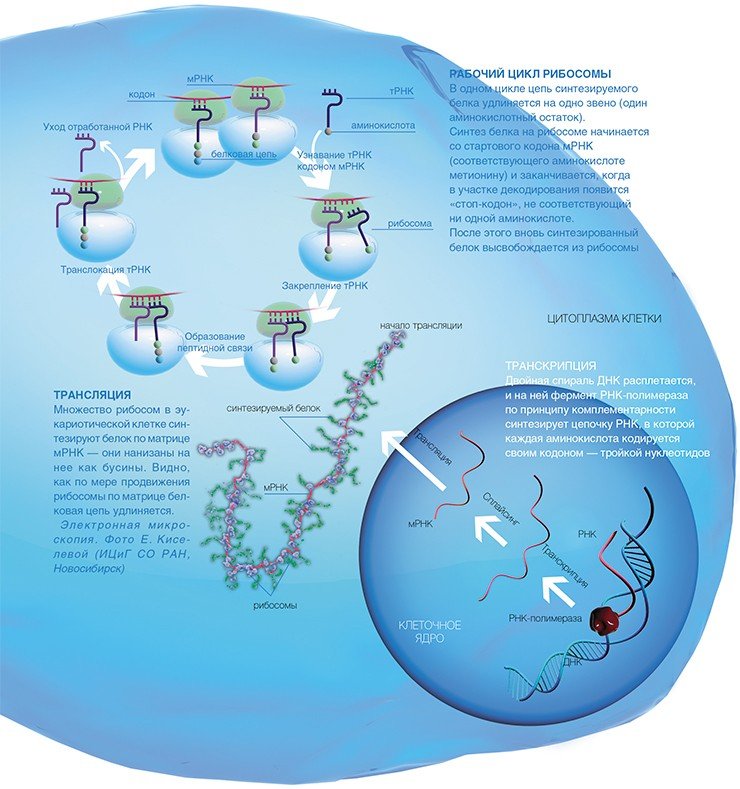
Как же эта генетическая информация доходит до рибосомы? На отдельном гене, как на матрице, синтезируется цепь еще одной информационной молекулы — рибонуклеиновой кислоты (РНК). Этот процесс копирования гена, называемый транскрипцией, осуществляется специальными ферментами — РНК-полимеразами.
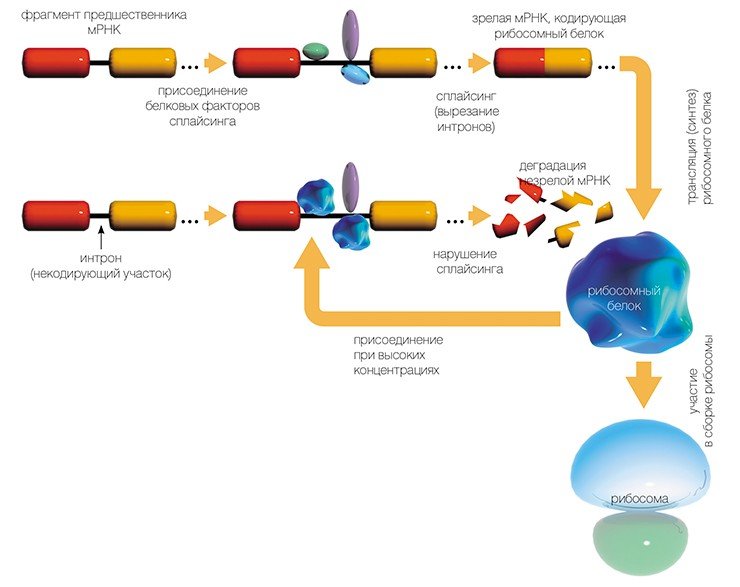
Но РНК, полученная таким образом, еще не является матрицей для синтеза белка: из нее, вырезаются определенные «некодирующие» куски нуклеотидной последовательности (процесс сплайсинга).
Точность белкового синтеза рибосомой исключительно высока — у человека ошибка составляет один на три тысячи «неправильный» аминокислотный остатокВ результате получается матричная РНК (мРНК), которая и используется рибосомами в качестве программы для синтеза белка. Сам синтез, т.е. перевод генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности белка, называется трансляцией.
Декодирование и синтез
В клетках эукариот одну мРНК обычно транслирует сразу множество рибосом, образуя так называемые полисомы, которые можно отчетливо видеть с помощью электронной микроскопии, позволяющей получать увеличение в десятки тысяч раз.

Как поступают в рибосому аминокислоты, являющиеся строительными кирпичиками для синтеза белка? Еще в 50-х годах прошлого столетия были открыты особые «перевозчики», доставляющие аминокислоты в рибосому, — короткие (длиной менее 80 нуклеотидов) транспортные РНК (тРНК). Специальный фермент присоединяет аминокислоту к одному из концов тРНК, причем каждой аминокислоте соответствует строго определенная тРНК. Синтез белка на рибосоме включает три основные стадии: начало, удлинение полипептидной цепи и окончание.
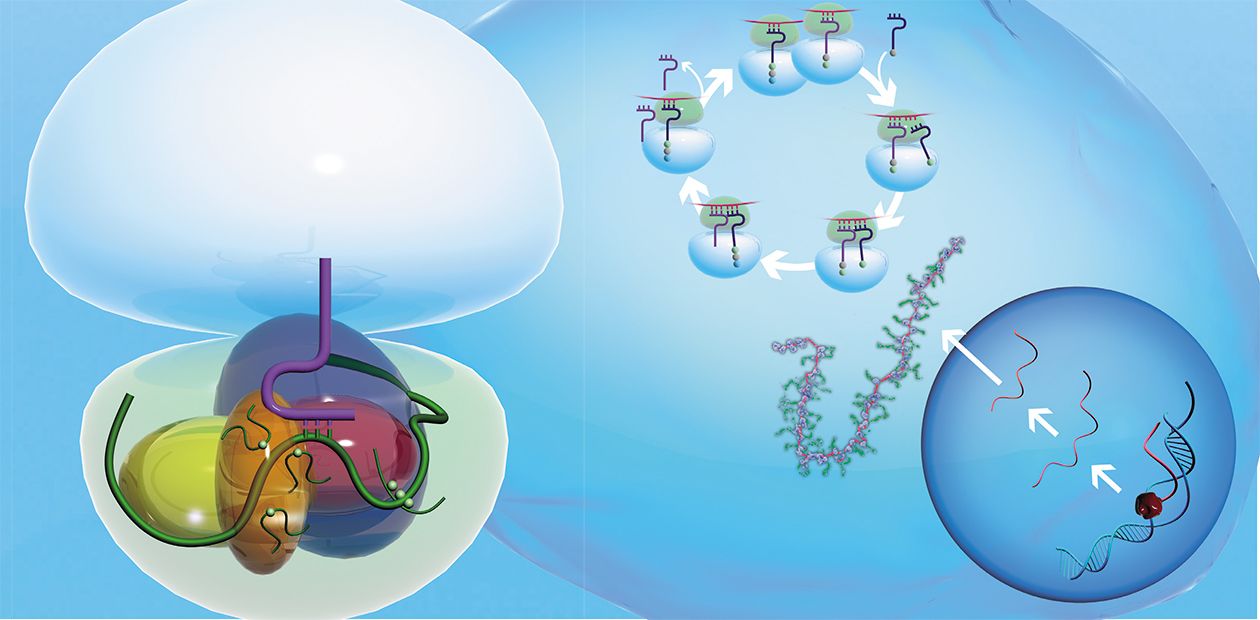
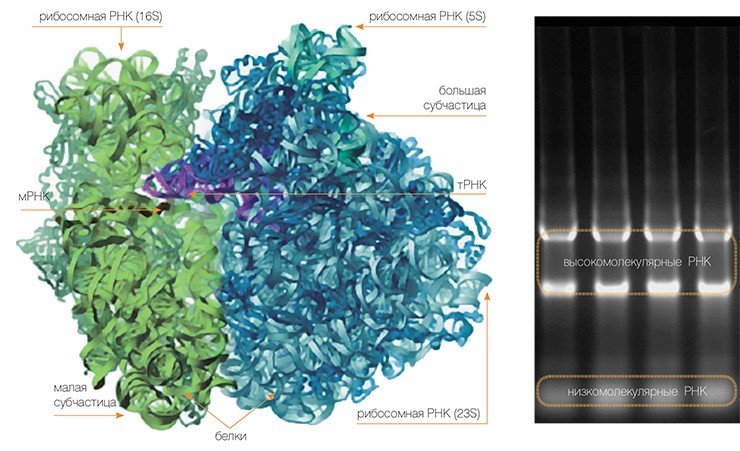
Сама рибосома — одна из самых сложно организованных молекулярных машин клетки — состоит из двух неравных частей, так называемых субчастиц (малой и большой). Ее можно легко разделить на части центрифугированием при сверхвысоких скоростях в специальных пробирках с раствором сахарозы, концентрация которой увеличивается сверху вниз. Поскольку малая субчастица в два раза легче большой, они движутся от верха пробирки к дну с разными скоростями.
Малая субчастица отвечает за декодирование генетической информации. Она состоит из высокомолекулярной рибосомной РНК (рРНК) и нескольких десятков белков (около 20 у прокариот и более 30 — у эукариот).
В раковых клетках резко повышается уровень некоторых рибосомных белков. Возможная причина — сбои в механизмах авторегуляции их производстваБольшая субчастица, ответственная за образование пептидной связи между аминокислотными остатками, состоит из нескольких рРНК: одной высокомолекулярной и одной (или двух в случае эукариот) низкомолекулярной, а также нескольких десятков белков (более 30 у прокариот и до 50 у эукариот). О масштабе деятельности рибосом можно судить хотя бы по тому факту, что рибосомная РНК составляет около 80 % всей РНК клетки, тРНК, транспортирующая аминокислоты, — около 15 %, тогда как матричная РНК, несущая информацию о белковой последовательности, — лишь 5 %!
Нужно отметить, что рибосомные белки наделены множеством других, дополнительных функций, которые могут проявляться на разных этапах жизнедеятельности клетки. Например, рибосомный белок S3 человека — один из ключевых белков центра связывания мРНК на рибосоме — принимает также участие в «ремонте» повреждений в ДНК (Kim et al., 1995), участвует в апоптозе (запрограммированной гибели клетки) (Jung et al., 2004), а также защищает от разрушения белок теплового шока (Kim et al., 2006).
Кроме того, чересчур интенсивный синтез некоторых рибосомных белков может свидетельствовать о развитии злокачественной трансформации клетки. Например, значительное повышение уровня пяти рибосомных белков было обнаружено в опухолевых клетках толстого кишечника (Zhang et al., 1999). Недавно сотрудниками лаборатории структуры и функции рибосом ИХБФМ СО РАН был открыт новый механизм авторегуляции биосинтеза рибосомных белков у человека, основанный на принципе обратной связи. Неуправляемый синтез рибосомных белков, характерный для опухолевых клеток, вероятно, вызван сбоями именно в этом механизме. Дальнейшие исследования в этой области представляют особый инте¬рес не только для ученых, но и для медиков.
Работает как «рибозим»
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Рибосомные белки, тем не менее, также играют важную роль в работе рибосомы. В отсутствие этих белков рибосомные РНК совершенно неспособны ни декодировать генетическую информацию, ни катализировать образование пептидных связей. Белки обеспечивают необходимую для работы рибосомы сложную «укладку» рРНК в функциональных центрах, служат «передатчиками» изменений пространственной структуры рибосомы, необходимых в процессе работы, а также связывают различные молекулы, влияющие на скорость и точность процесса белкового синтеза.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
Это связано с тем, что многие из методов, успешно использованных для исследования рибосом прокариот, оказались для эукариот неприменимыми. Так, из рибосом высших организмов не удается получить кристаллы, пригодные для рентгеноструктурного анализа, а их субчастицы невозможно «собрать» в пробирке из смеси рибосомных белков и рРНК, как это делается у простейших.
От низших — к высшим
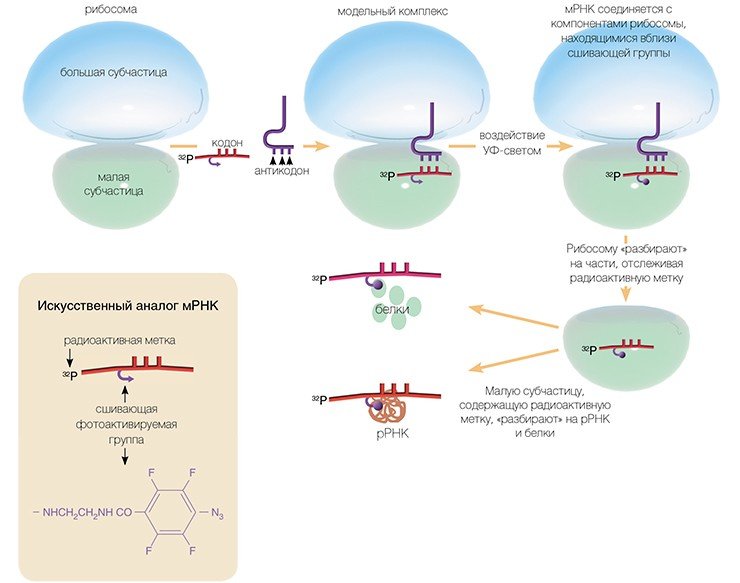
И все-таки способы получения сведений о строении функциональных центров рибосом высших организмов существуют. Одним из таких методов является метод химического аффинного сшивания, разработанный 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.
Метод основан на использовании коротких синтетических мРНК, несущих в выбранном положении химически активные («сшивающие») группы, которые в нужный момент можно активировать (например, облучая мягким ультрафиолетовым светом).
Этот метод и сегодня является основным для изучения структурно-функциональной организации рибосом высших организмов
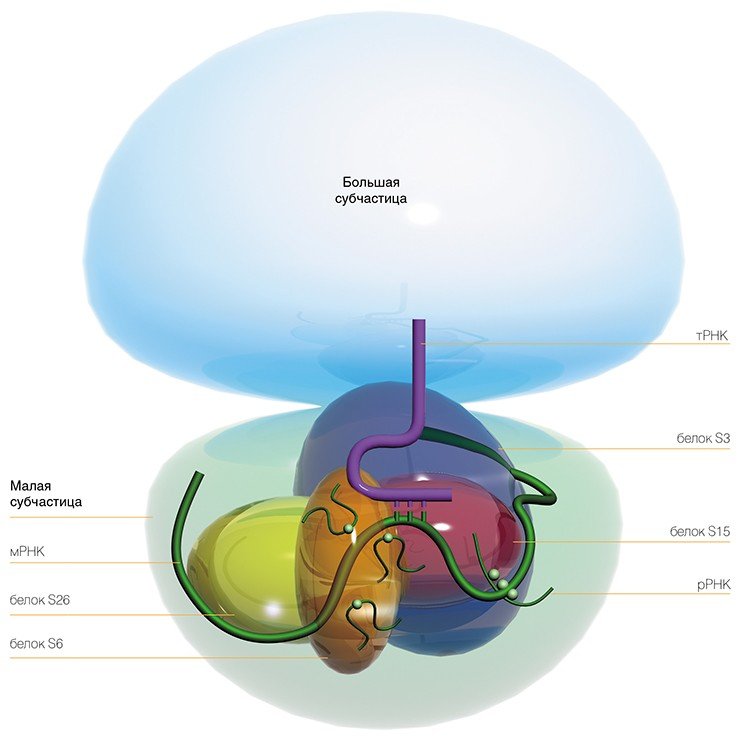
Достоинство этого метода в том, что сшивающую группу можно присоединить практически к любому нуклеотидному остатку мРНК и в результате получить детальную информацию о его окружении на рибосоме. Используя набор коротких мРНК с разным расположением сшивающей группы, нам удалось определить рибосомные белки и нуклеотиды рРНК рибосомы человека, образующие канал для считывания генетической информации в процессе трансляции.
Впервые экспериментально удалось показать, что все нуклеотиды рРНК малой рибосомной частицы человека, соседствующие с кодонами мРНК, расположены в консервативных районах вторичной структуры молекулы рРНК. Более того, их расположение совпадает с положением соответствующих нуклеотидов во вторичной структуре рРНК рибосом низших организмов. Это позволило сделать вывод, что эта часть рибосомной РНК малой субчастицы составляет эволюционно консервативный «кор» (сердцевину) рибосомы, структурно идентичный у всех организмов.
С другой стороны, в устройстве мРНК-связывающего канала рибосом у человека и низших организмов обнаружен ряд принципиальных различий. Оказалось, что у высших организмов рибосомные белки играют намного большую роль в формировании этого канала, чем у прокариот, кроме того, в этом участвуют также белки, не имеющие «двойников» (гомологов) у низших организмов.
Почему же, несмотря на то, что функция рибосомы практически не изменилась в процессе эволюции, в организации декодирующего центра рибосом у высших организмов появились специфичные черты? Вероятно, это связано с более сложной и многостадийной регуляцией белкового синтеза у эукариот по сравнению с прокариотами, в ходе которой рибосомные белки мРНК-связывающего канала могут взаимодействовать не только с мРНК, но и с различными факторами, влияющими на эффективность и точность трансляции. Так ли это, покажут дальнейшие исследования.