Сибирский центр генетических ресурсов – три года спустя
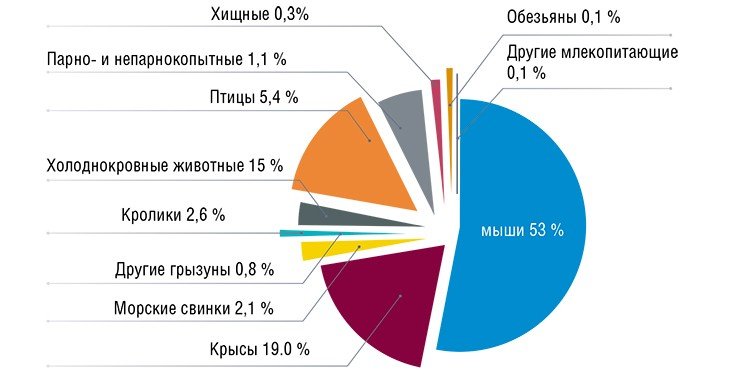
Самой динамично развивающейся областью животноводства в мире сегодня является… разведение лабораторных животных. Именно на мелких лабораторных млекопитающих, таких как мыши и крысы, проводятся основные фундаментальные и прикладные биологические исследования, в том числе ориентированные на разработку новых подходов к лечению болезней.
Безудержный рост числа генетических линий лабораторных животных, моделирующих различные свойства организма, в том числе и наследственные болезни, привели в развитых странах к созданию особых центров и международных ассоциаций генетических ресурсов. При этом согласно международным правилам доклинические испытания лекарственных препаратов и оценку биобезопасности новых материалов и продуктов питания можно проводить исключительно на содержащихся в жестко контролируемых условиях SPF-животных, т.е. животных, свободных от специфических патогенов и практически «стерильных». Ведь любые инфекции являются источником изменчивости экспериментальных данных, снижающей надежность полученных результатов.
В России появился первый претендент на роль такого центра со свободным доступом ко всему мировому «богатству» модельных организмов – ЦКП «SPF-виварий» Института цитологии и генетики СО РАН, уникальный объект научной инфраструктуры Новосибирского научного центра. Уже сегодня новый центр коллективного пользования становится базой для интеграции интеллектуальных усилий ученых разного профиля из десятка академических институтов
Год назад инфраструктура Сибирского отделения РАН пополнилась уникальным для России «SPF-виварием» Института цитологии и генетики СО РАН, соответствующим всем мировым стандартам.
«НАУКА из первых рук» уже писала о создании этого технически очень сложного объекта, предназначенного для содержания практически «стерильных» лабораторных животных, используемых в экспериментальных исследованиях. Новый центр коллективного пользования стал базой для проведения мультидисциплинарных работ специалистами многих институтов СО РАН. Принцип «лечить не болезнь, а больного», провозглашенный Гиппократом в IV в. до н. э., приобретает все большую значимость на фоне экстенсивного роста материальных вложений в фармакологию. Сегодня эффективность лечения даже самыми современными препаратами не превышает 60 %, а негативные побочные эффекты наблюдаются примерно у трети пациентов (Кукес и др., 2008). Поэтому многовековая история поиска подходов к персонализированной медицине, основанной не только на опыте и интуиции врача, но и на объективных оценках индивидуальных свойств пациента, обретает «второе дыхание».
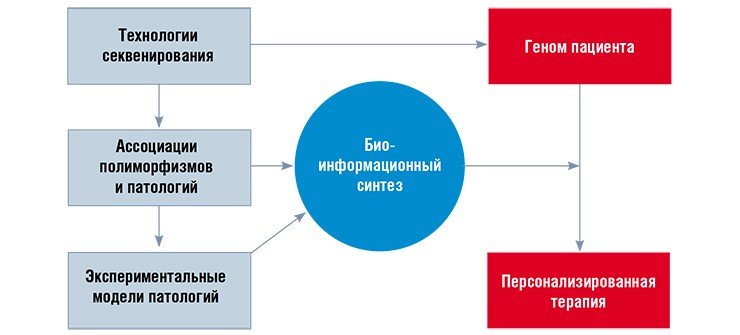
Поводом для оптимизма служат научные достижения, список которых открывает завершившаяся на рубеже тысячелетий полная расшифровка генетического кода человека. Не вызывает сомнения, что уже в ближайшие годы благодаря совершенствованию технологий затраты на прочтение персональных геномов будет покрывать обычная медицинская страховка. Параллельно развитию методов генетического анализа идет накопление информации о влиянии отдельных генов на предрасположенность людей к болезням или, напротив, к достижению выдающихся результатов в интеллектуальной деятельности, творчестве и спорте.
По экспертным оценкам число таких генетических вариаций (полиморфизмов) превышает два миллиона (Bloom, 2001). Выявить среди подобного множества отдельные гены или их комплексы, определяющие те или иные индивидуальные предрасположенности, позволяют современные информационные и компьютерные технологии.
Но достаточно ли будет этого для разработки оптимальных стратегий персонализированной профилактики и лечения болезней или для формирования персональных образовательных «маршрутов»? Дело в том, что организм человека и ближайших к нему видов млекопитающих чрезвычайно сложен. Поэтому для расшифровки механизмов реализации генетических программ, в том числе и приводящих к болезням, приходится прибегать к экспериментальному изучению животных, по генетическим и общебиологическим характеристикам наиболее близким к человеку.
Братья по болезням
Для моделирования генетической предрасположенности к болезням лабораторных животных традиционно селекционируют по наличию у них симптомов интересующей патологии. Таким способом в ИЦиГ СО РАН были созданы линии крыс и мышей, характеризующиеся повышенным артериальным давлением, преждевременным старением, а также некоторыми поведенческими отклонениями от «нормы». Такие организмы являются ценным материалом для расшифровки патогенетических процессов и поиска новых средств профилактики и лечения болезней. Кроме того, среди лабораторных животных удавалось выявлять носителей спонтанных или экспериментально вызванных мутаций, которые приводили к нарушениям морфологии, обмена веществ, иммунных или физиологических процессов, характерных для некоторых болезней человека.
Но все же настоящий расцвет в деле создания экспериментальных животных с генетической предрасположенностью к болезням связан с «постгеномной» эрой, т. е. началом нынешнего века. Сегодня методами генной инженерии можно целенаправленно выключать (нокаутировать) отдельные гены или создавать животных, в геном которых внедрены варианты генов, ассоциированные с болезнями человека.
Один из примеров успешной работы в этой области связан с изучением ревматоидного артрита в Токийском университете (Ивакура и др., 2008; Iwakura et al., 2008). В Японии среди страдающих ревматоидным артритом часто встречаются носители ретровируса HTLV-I. Чтобы понять его роль в патогенезе заболевания, ученые внедрили ретровирус в геном мышей, у которых с определенного возраста действительно стали появляться типичные симптомы ревматоидного артрита. Для сравнительного анализа была создана еще одна линия мышей, у которых предрасположенность к артриту была вызвана выключением гена, отвечающего за выработку противовоспалительного регулятора IL-1 Ra. Далее у каждой из линий были поэтапно нокаутированы ключевые гены воспалительных реакций, которые предопределяют развитие болезни.
Полученные генно-инженерными методами линии мышей позволили в результате выявить наиболее адекватные молекулярные мишени для медикаментозного воздействия. Они оказались разными для артрита, обусловленного разными причинами. Стало понятно, почему лекарственные препараты, помогающие большинству европейцев, оказываются бесполезными для большей части японских больных. Этот случай показывает научно-обоснованные пути формирования технологий персонализированной медицины в приложении к конкретному заболеванию.
Исследования по ревматоидному артриту – лишь один из примеров изучения этнических особенностей формирования болезней, которые по своим симптомам могут быть очень похожи друг на друга. Учет генетических особенностей населения играет большую роль в становлении персонализированной медицины. Он же заставляет отказаться от иллюзорных надежд на решение собственных проблем только за счет импорта знаний. Поэтому развитие исследований в области экспериментального моделирования патологий в государствах, ответственно относящихся к национальному здоровью, поддерживается не только и не столько фармакологическим бизнесом, сколько федеральными средствами. Следует подчеркнуть, что этнический аспект особенно значим для нашей многонациональной страны.
В мышиной кодировке
Для расшифровки всего лишь двух вариантов патогенеза в случае с ревматоидным артритом потребовалось создание восьми линий мышей с заданными генетическими свойствами. Но самих болезней, как и их индивидуальных вариантов, неизмеримо больше.
Собственно, вариантов ровно столько, сколько и пациентов. Обеспечить каждый из них экспериментальными моделями практически невозможно, но понять основные принципы формирования генетически детерминированных заболеваний необходимо. Этот факт предопределяет стремительный рост поголовья экспериментальных животных, наблюдаемый во всех развитых странах.
Помимо моделирования патологий, создание коллекций экспериментальных животных, геномы которых близки к человеку, является одним из ключевых условий для успешного шага от расшифровки «буквенных последовательностей» в генетическом коде человека до осмысленного прочтения этого чрезвычайно сложного текста.
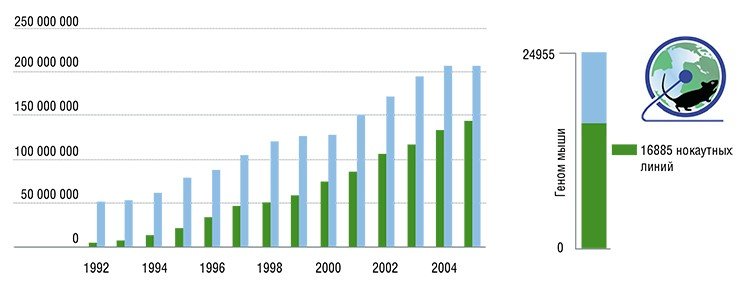
Полное секвенирование генома у мыши было выполнено сразу вслед за таковым у человека. И почти сразу стало ясно, что исходя из одного лишь знания нуклеотидных последовательностей довольно трудно предсказать эффекты на уровне целостного организма (Schofield, 2008). Самый простой подход к получению ответа на вопрос о том, какую роль играет конкретный ген в формировании индивидуальных свойств организма, заключается в изучении фенотипических* эффектов, вызванных выключением этого гена. Для этого нужно иметь коллекции нокаутных линий, число которых должно быть близко к общему числу генов.
Масштабы проблемы «не пугают» современных ученых. Пример их отваги – проект Knockout Mouse Project (KOMP), инициированный Национальным институтом здоровья США в 2005 г. Его цель – создание на основе «популярной» линии лабораторных мышей C57Bl коллекции генотипов, каждый из которых будет иметь нокаут по одному из генов. Вскоре к реализации этого проекта присоединились еще три научные команды, образовав International Knockout Mouse Consortium (IKMC).
Сегодня их объединенными усилиями создано более 16 тыс. линий эмбриональных стволовых клеток с нокаутами кодирующих генов (для сравнения – полный геном мыши содержит около 25 тыс. генов). На основе этих клеточных линий уже создано более полутора тысяч мышей с нокаутами отдельных генов.
Помимо выключения генов, методы генной инженерии позволяют получать животных с управляемой экспрессией (активацией) генов. Управление можно осуществить в любой момент индивидуальной жизни введением фармакологических препаратов. Кроме того, для прямого наблюдения за работой генов создаются линии мышей, у которых активация гена сочетается с синтезом флюоресцирующих белков. Это позволяет буквально «воочию» – с помощью оптических зондов или непосредственно через кожные покровы – наблюдать генетические процессы, обеспечивающие эмбриональное развитие, различные поведенческие, физиологические или патогенетические процессы.
Наконец, с помощью трансгенеза создаются так называемые гуманизированные мыши, у которых некоторые гены замещены генами человека. Этих животных используют для проверки эффективности воздействия лекарств на молекулярные мишени, которые в данном случае полностью являются «человеческими».
В случае генов, кодирующих иммуноглобулины, такая замена позволяет использовать иммунную систему мышей для получения терапевтических моноклональных антител человека (Jakobovits et al., 2007). Первыми такими иммуноглобулинами, которые прошли клинические испытания, стали антитела против интерлейкина-8. Их использовали для подавления иммунных процессов при обострении у больных псориазом. Причем принципиально важно, что ни у одного из пациентов не было выявлено аллергической реакции. В настоящее время стадию доклинических испытаний проходят более десяти вариантов произведенных с помощью мышей человеческих иммуноглобулинов, которые служат антителами против различных факторов роста злокачественных опухолей.
От гена до организма
Вот так мышиный генотип сегодня выступает сразу в трех ипостасях, являясь и объектом исследования, и его инструментом, и производственной мощностью в биотехнологическом цикле. Поэтому неудивительно, что по прогнозу журнала Nature (2004 г.) число генетических линий мышей достигнет 300 тысяч к 2025 г.
Современные технологические возможности, позволяющие адресно воздействовать на отдельные гены и оценивать их активность, создали условия для эффективного решения одной из интригующих задач системной биологии – построения так называемых функциональных траекторий от генов до адаптивных или патологических реакций целостного организма.
В решении этой задачи, наряду с геномными и протеомными исследованиями, большая роль отводится анализу морфологических, физиологических и поведенческих процессов, объединяемых понятием фенотипирование. Эта область получила в последние годы существенную методическую поддержку благодаря прогрессу в создании вышеупомянутых систем прижизненной регистрации флюоресцирующих агентов, в том числе и образующихся при активации отдельных генов, компьютеризации систем наблюдения за поведением животных, а также разработке миниатюрных имплантируемых детекторов вплоть до внедрения в мозг миниатюрной видеокамеры.
Особое место в списке инструментов прижизненного мониторинга занимают магнитно-резонансные томографы, применение которых позволяет контролировать морфологические и функциональные изменения разных систем организма, оценивать усвоение и выведение физиологически активных веществ и даже измерять содержание ряда продуктов обмена веществ (метаболитов) в любой точке живого животного.
Безудержный рост числа генетических линий, моделирующих различные свойства организма, в том числе и наследственные болезни, развитие технологий прижизненных исследований наряду с необходимостью стандартизации условий работы с лабораторными животными послужили предпосылками к формированию особых объектов научной инфраструктуры – центров генетических ресурсов лабораторных животных.
Мышиные ресурсы
В развитых странах специализированные центры генетических ресурсов, призванные обеспечить фундаментальные и прикладные исследования на лабораторных животных, имеют национальный статус. Основу их составляют виварии, где животные, свободных от видоспецифических патогенов (SPF – specific pathogen free), содержатся в стерильных, строго стандартизированных по корму, воде и микроклимату условиях – это крайне важно для воспроизводимости результатов исследований, проводимых в разных лабораториях.
Значимость такой стандартизации возрастает при решении задач постгеномной биологии, поскольку для фенотипирования многочисленных генотипов, полученных генно-инженерными методами, приходится объединять усилия исследовательских лабораторий из разных стран. Кроме того, сохранение SPF- статуса является единственно возможным условием для выживания и размножения иммунодефицитных генотипов.

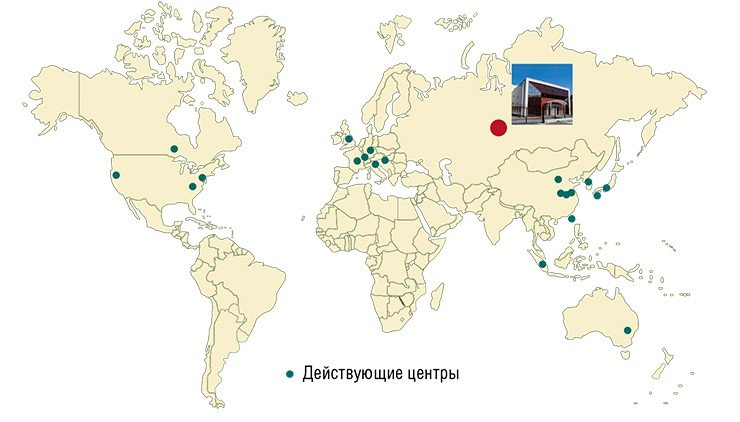
На международном уровне деятельность ресурсных центров координируют такие организации, как Федерация международных мышиных ресурсов (FIMRe) и Азиатская ассоциация ресурсов мутантных мышей (AMMRA), объединяющие свыше 25 центров из разных стран. Их суммарное генетическое разнообразие приближается к 30 тыс. мышиных генотипов.
Обмен генетическими линиями между центрами осуществляется двумя путями: традиционной отправкой племенного поголовья или пересылкой замороженных эмбрионов в специальных контейнерах c жидким азотом. Последнее вызвано тем, что поддержание в живом разведении даже существующих генетических линий чрезвычайно затратно. Поэтому в современных центрах генетических ресурсов создаются криобанки и лаборатории репродуктивных технологий, где проводится полный цикл работ: получение эмбрионов на ранних стадиях развития (2—8 клеток); их замораживание и хранение при температуре жидкого азота; размораживание и трансплантация суррогатным матерям для получения потомства и последующего разведения.
Как обстоят дела в нашей стране? Успешное продвижение вопроса о приеме России в ВТО влечет за собой ряд следствий, в том числе относящихся к исследованиям на лабораторных животных. В частности, все действующие в стране виварии должны быть приведены в соответствие с международными стандартами.
К настоящему времени в дополнение к имеющим международную аккредитацию питомнику лабораторных животных и лаборатории биологических испытаний Филиала Института биологической химии РАН (Пущино), построены и введены в эксплуатацию несколько вивариев, где лабораторные животные содержатся в SPF-условиях. Речь идет о вивариях ГНЦ Прикладной микробиологии и биотехнологии (Оболенск), Института физиологически активных веществ РАН (Черноголовка), Института эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Московского государственного университета. Основная задача этих учреждений состоит в проведении доклинических испытаний лекарственных препаратов на широко распространенных линиях лабораторных животных, основным источником которых является Пущинский питомник, где поддерживается восемь линий мышей и четыре – крыс. В последние годы в этом питомнике появились первые трансгенные и нокаутные животные.
Вместе с тем в РФ до сих пор нет ни одного специализированного центра генетических коллекций лабораторных животных, который был бы ассоциирован международными федерациями FIMRe или AMMRA и получил бы свободный доступ ко всему мировому «богатству» модельных организмов. Все это существенно тормозит фундаментальные и инновационные исследования в самых передовых областях знания. Поэтому создание современного центра генетических ресурсов смело можно отнести к разряду сверхактуальных задач, без решения которых практически невозможно развивать конкурентоспособную отечественную науку.
На роль такого центра сегодня с полным правом может претендовать ЦКП «SPF-виварий» Института цитологии и генетики СО РАН, строительство которого было профинансировано Министерством экономического развития и который был сдан в эксплуатацию в 2009 г.
В содружестве наук
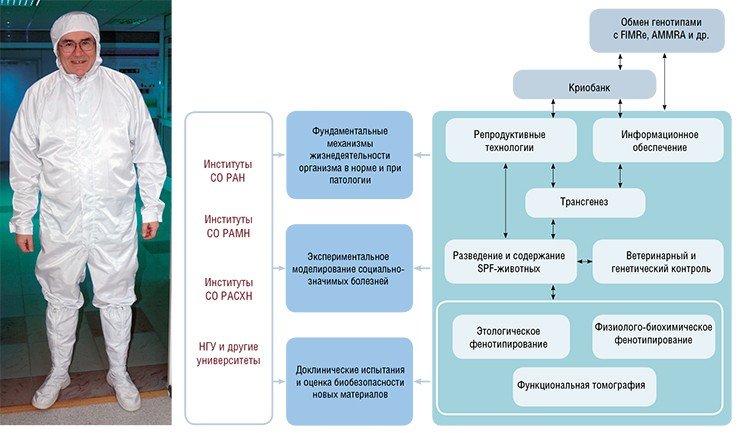
В основе концепции строительства и технологического развития первого в Сибири и на Дальнем Востоке центра, отвечающего всем международным требованиям к работе с экспериментальными животными, лежит принцип мультифункциональности. Это позволяет совмещать фундаментальные исследования, связанные с фенотипическим изучением геномов, с прикладными работами в области биомедицины, фармакологии и нанобиобезопасности. Технические возможности центра позволяют обеспечить криохранение десятков тысяч генотипов, поддержание до ста племенных ядер мышей и крыс, а также проведение исследований в соответствии с требованиями «надлежащей лабораторной практики» (good laboratory practice – GLP) в сверхстерильных условиях барьерной зоны площадью 1400 м2.

Сегодня уже можно говорить о первом опыте работы и первых научных результатах, полученных в этой уникальной для России ресурсной и научно-исследовательской структуре.
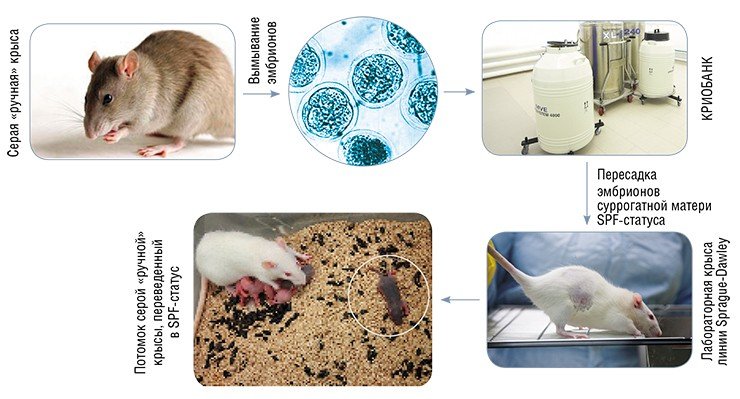
Уже в течение первого года функционирования «SPF-вивария» в нем получили «прописку» первые генетические линии мышей и крыс, включая два нокаутных генотипа. К концу 2010 г. удалось перевести в SPF-статус уникальную линию «ручных» крыс, полученных в ИЦиГ СО РАН на основе селекции от диких предков. Для этого был применен метод трансплантации эмбрионов стерильным суррогатным матерям. Успех этой работы доказал готовность комплекса по криоархивированию к сотрудничеству с мировыми центрами генетических ресурсов.
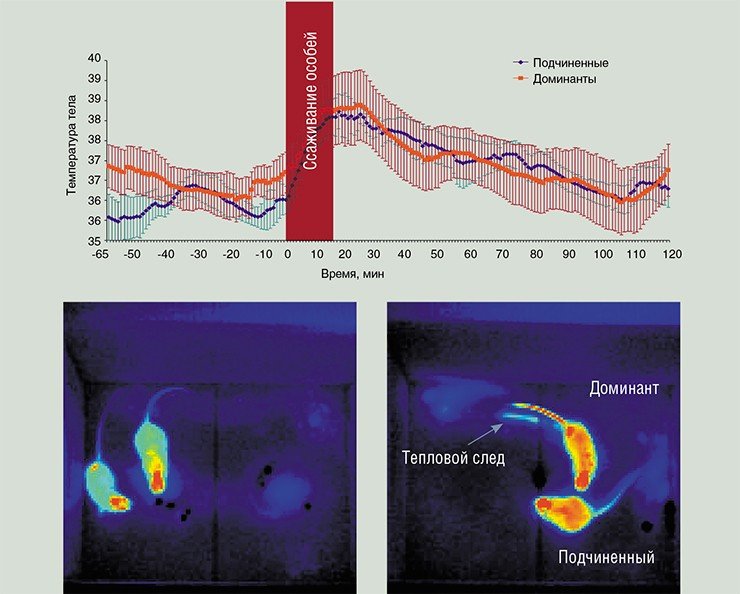
Регистрация внутренней температуры и тепловых потоков с поверхности тела обогащает поведенческое тестирование, использующееся в нейрофизиологических и фармакологических исследованиях, информацией о сосудистых реакциях особи на эмоционально значимые стимулы. Еще одной областью применения этих методов может служить контроль за развитием раковых опухолей, а также и мониторинг очагов воспаления, например, во время испытаний новых кремов или аэрозолей.
Но для того чтобы приборы для регистрации температурных реакций стали привычными инструментами поведенческих и биомедицинских исследований, их необходимо адаптировать к условиям эксперимента. Только при проведении биологических испытаний можно разработать программное обеспечение для автоматической обработки регистрируемых сигналов и для их перевода в термины, понятные биологам.
Сегодня на базе ЦКП «SPF-виварий» ИЦиГ СО РАН имеются все условия для экспериментальной «доводки» оборудования и методов, разрабатываемых в институтах СО РАН, что может существенно расширить сферу применения приборов, первоначально предназначенных для решения сугубо специальных задач
После отладки уникального магнитно-резонансного томографа на базе «SPF-вивария» совместно с Международным томографическим центром СО РАН был сформирован межинститутский сектор томографии.Уже в первый год работы вивария здесь было исследовано свыше 300 различных лабораторных животных. В результате были получены детальные морфологические описания структур мозга у генетических линий мышей и крыс, моделирующих такие социально значимые патологии, как гипертония, преждевременное старение, нарушения психики. Доступность МРТ-томографии на животных позволила сотрудникам МТЦ и других институтов физического и химического профиля ускорить проверку новых технологий, включая испытания оригинальных контрастирующих агентов.
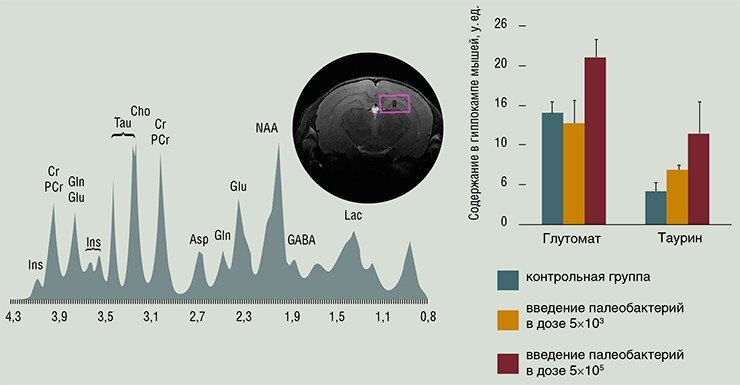
Эффективность содружества профессиональных физиков, химиков, биологов и математиков отчетливо проявилась и в быстром освоении самых передовых томографических методов. В частности, на основе функциональной томографии получены первые данные о пространственном распределении в мышином мозге зон, проявляющих активность в ответ на социально значимые стимулы. Методом прижизненной ЯМР-спектроскопии начато изучение метаболомных профилей головного мозга у животных разных генетических линий, в том числе при испытании препаратов лечебного и профилактического действия.

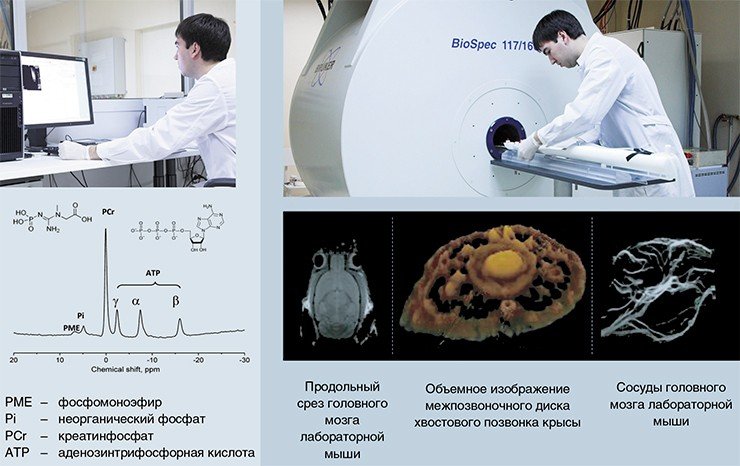
Методы ЯМР-спектроскопии позволяют изучать содержание метаболитов в любой точке организма безо всякого ущерба для него самого. Есть только два ограничения: точка должна быть неподвижной в течение нескольких минут (при регулярных дыхательных колебаниях возможна виртуальная фиксация анализируемой области), а ее размеры должны быть не менее 8 мм3. Наиболее удобным и интересным объектом является головной мозг.
Технология протонной и фосфорной ЯМР-спектроскопии освоена в межинститутском секторе томографии лабораторных животных МТЦ СО РАН и ИЦиГ СО РАН. Менее чем за полгода выполнен ряд исследований, показавших хорошие перспективы прижизненной спектроскопии для изучения нейрохимических основ изменчивости поведения животных.
Другой источник неинвазивной метаболомной информации – низкомолекулярные органические соединения, содержащиеся в выделениях организма. Они эффективно детектируются с помощью хроматографических и хромато-масс-спектрометрических методов, однако качественное разделение сложных химических смесей обычно требует длительного времени.
Преодолеть пропасть между биологическим изучением запахов и расшифровкой их химической природы помогло создание портативных высокопроизводительных поликапиллярных хроматографов, таких как разработанный в ИНГГ СО РАН хроматограф ЭХО-В-ФИД. С его помощью удалось исследовать паровую фазу образцов мочи контрольных и антигенстимулированных самцов мышей и идентифицировать хроматографический пик, отвечающий на активацию иммунной системы. Одновременно в образцах были идентифицированы соединения, уровень которых коррелирует с репродуктивным статусом самцов.
Пока среди методических подходов, привлекаемых к описанию новых генотипов лабораторных животных, неинвазивная метаболомика занимает скромное место. Но ее значение будет возрастать в связи с развитием и снижением стоимости аналитических технологий. К тому же обнаруженные таким способом диагностически значимые закономерности могут напрямую использоваться в медицинской и ветеринарной диагностике
Первой крупной научной задачей, выполненной совместно сотрудниками семи новосибирских академических институтов на базе ЦКП «SPF-виварий», стала оценка биобезопасности наноматериалов. Впервые в России эти работы были проведены в полном соответствии с международным GLP-стандартом. Исследования потребовали предварительной подготовки: был создан инструментарий для измерений размеров и формы наноматериалов, а также устройства для воздействия на животных аэрозолями, содержащими наночастицы двуокиси кремния («Таркосил 25»).
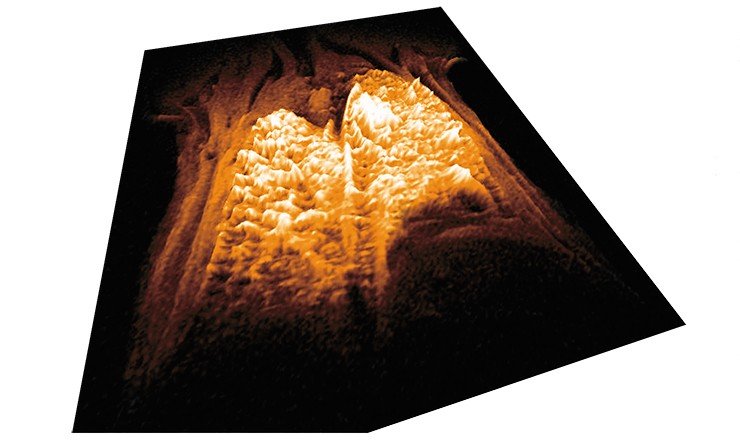
Методом МРТ были получены объемные изображения легких, позволяющие количественно оценить распределение в них наночастиц. Исследование комплексной иммунофизиологической реакции мышей на поступление в верхние дыхательные пути нанопорошка показало, что реакция легочного иммунитета наблюдается только при введении частиц размером менее 100 нм, и только у генетической линии мышей с преобладанием так называемого гуморального типа иммунного реагирования. Установление фактов генотип-зависимых эффектов наноаэрозолей может иметь значение для разработки критериев профессионального отбора людей, занятых на производстве наноматериалов.
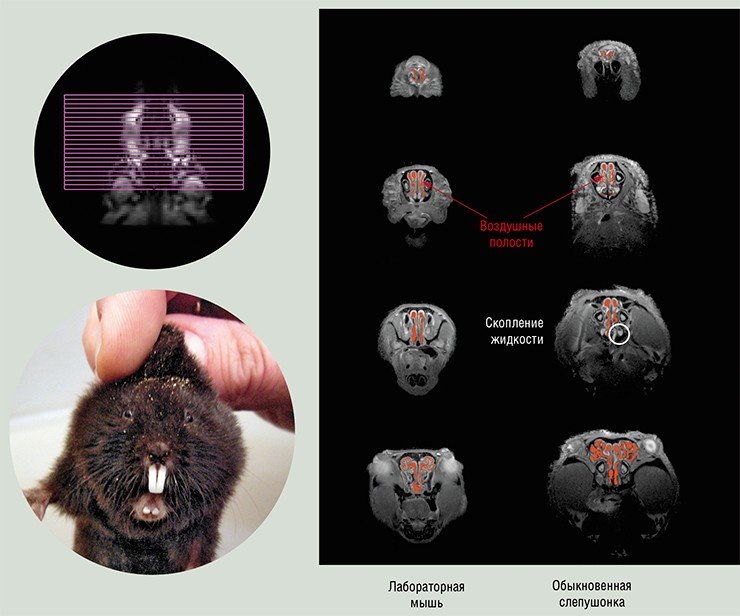
Однако нос человека – один из самых просто устроенных. Нос мыши насыщен разнообразными обонятельными рецепторами. Судя по послойным ЯМР-изображениям носовых ходов лабораторной мыши, их причудливая геометрия предполагает гораздо большую сложность в организации воздушных потоков по сравнению с человеческими.
Еще сложнее устроен нос у обыкновенной слепушонки, небольшого грызуна, прокладывающего многочисленные подземные тоннели в поисках корма – корневищ растений. Затраты энергии повышаются во время рытья в 2–3 раза, соответственно возрастает интенсивность дыхания и вероятность попадания пыли в легкие. Томография носа слепушонки показала две интересные особенности: площадь поперечного сечения носовой полости в области максимального расширения в 20 раз превышает входную, что существенно больше, чем у мыши; в нижних отделах носовых ходов находятся скопления жидкости, отсутствующие у мышей и других наземных млекопитающих.
Сложная форма носовых ходов и наличие в них жидкости позволяет сравнить нос слепушонки с пылесосом с водяным фильтром. Эффективность такой защиты покажут аэродинамической модели, а также содержание животных в атмосфере с пылевыми частицами, в том числе наноаэрозолями. Более детальное изучение вида, специализированного для жизни в запыленной среде, может внести вклад в разработку новых методов защиты респираторной системы человека от воздействия частиц разных размеров. В решение этой задачи сегодня включаются специалисты четырех институтов СО РАН. Отрадно, что поводом для интеграции служат не только уникальные научные технологии и инструменты, но и уникальные животные-обитатели сибирского региона
Расшифровка геномов человека и близких к нему видов животных революционизировала весь комплекс исследований генетического разнообразия млекопитающих. Возможности современных биотехнологий вывели в разряд важнейших ресурсов постгеномной биологии лабораторных животных, что наглядно иллюстрирует экспоненциальный рост числа научных статей, написанных по результатам изучения трансгенных животных. Так, только за последние 2,5 года число публикаций с ключевым словом «transgenic mouse» выросло более чем на 30 тысяч!
Необходимость в накоплении конкретных знаний о реализации генетической информации диктуется не только невообразимой сложностью живых организмов, но и отсутствием «типовых конструкций» в рамках каждого биологического вида, включая человека. Поэтому в биомедицинские исследования, ориентированные на поиск методов лечения «больных, а не болезней», привлекается все большее число разнообразных живых генетических «моделей».
Одним из стимулов для создания последних служит стремительное накопление информации об ассоциациях «ген-патология». Возможность изучать животных с генотипом, точно отвечающим запросу исследователя, задает новый вектор биологических исследований, диктующий необходимость в интеграции интеллектуальных усилий ученых разного профиля, а также финансовых вложений разных стран.
В редакционной статье «Мышиная меганаука», опубликованной в престижном журнале Nature (2010, 3 June), исследования генетического разнообразия лабораторных животных были сопоставлены по масштабам и значимости с мегапроектом Большого адронного коллайдера. Биологов призывают объединиться для просветительского давления на политиков с целью перенаправления финансовых потоков в область социально значимой научной активности, направленной на изучение фундаментальных основ здоровья человека.
России для полноценного взаимодействия с мировой наукой в этой области необходимо иметь хотя бы один центр генетических ресурсов, отвечающий международным требованиям. И такой центр сегодня формируется в Сибирском отделении РАН на базе ЦКП «SPF-виварий» ИЦиГ СО РАН. В работе нового центра заинтересованы многие академические институты, а также классические, медицинские и сельскохозяйственные университеты и возрождающееся фармацевтическое производство.
Поскольку частоты генов, ассоциированных с болезнью, и сам характер этих ассоциаций могут иметь этнические особенности, создание условий для развития научных основ персонализированной медицины должно входить в разряд национальных приоритетов. И в первую очередь это должно относиться к центрам генетических ресурсов, поскольку они являются неотъемлемым элементом научно-технологического комплекса, призванного решать одну из главных задач государства – поддержание здоровья нации.
Литература
Мошкин М.П. ПОСТГЕНОМНАЯ ЭРА или Зачем нужны 300 тысяч линий мышей // НАУКА из первых рук, 2008. № 4 (22). С. 16—53
* Фенотип – совокупность всех признаков и свойств организма, сформировавшихся в процессе индивидуального развития