На пути к персонализированной медицине. Проблемы лекарственной терапии онкозаболеваний
Сегодня едва ли найдется человек, в той или иной мере не знакомый с проблемами рака – одной из самых пугающих и распространенных болезней наших дней. Вместе с тем благодаря информации о новейших достижениях в борьбе с этой «чумой современности», появляющейся в средствах массовой информации, создается впечатление, что болезнь почти побеждена. К сожалению, прогресс в лечении рака, достигнутый за последние десятилетия, весьма незначителен. особенно по сравнению с ростом масштаба затрат
Многие специалисты считают, что нынешние подходы к лекарственной терапии онкологических заболеваний во многом малоэффективны из-за невозможности предварительной «примерки» препаратов на конкретного больного и отсутствия адекватного механизма предсказания их действия. т.е. того, что составляет суть «персонализированной медицины». Авторы предлагают привлечь для «персонализации» схем применения лекарств при раковой терапии математическое моделирование. В будущих выпусках журнала будет подробно рассказано об «инструментарии», созданном в рамках такого подхода, и опыте его применении в клинической практике
Функция врача сводится к тому, чтобы подогнать человека под определенный
шаблон-диагноз, а затем выдать ему соответствующие таблетки
В. В. Синельников, «Возлюби болезнь свою»
В конце прошлого года практически все новостные ресурсы мира обошли сенсационные заголовки типа «Таблетка аспирина в день – и вы не болеете раком!». Поводом к ним послужили результаты серии исследований, опубликованные в журнале «Ланцет», согласно которым регулярный прием малых доз аспирина уменьшает вероятность риска умереть от рака прямой кишки.
Именно эта новость заставила авторов незамедлительно взяться за перо, чтобы познакомить читателей с проблемами и методами персонализации терапевтического лечения рака – одной из самых пугающих и распространенных болезней современности.
Сегодня едва ли найдется человек, в той или иной мере не знакомый с проблемами рака. Вместе с тем средства массовой информации своими материалами о новейших достижениях в борьбе с этой «чумой современности» создают впечатление, что болезнь почти побеждена. В крайнем случае, что до полной победы осталось совсем немного. К сожалению, эти представления далеки от действительности.
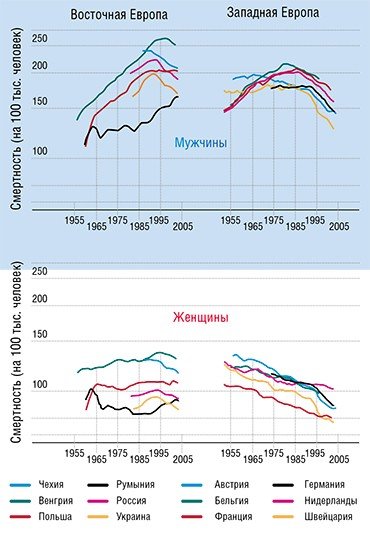
Чтобы количественно оценить масштабы бедствия под названием «рак», обратимся к статистике, например, к материалам Европейского проекта «Современная борьба с раком», опубликованным в 2008 г. (Coleman et al., 2008), и к июльскому номеру журнала «The European Journal of Cancer» за 2009 г., целиком посвященному результатам европейской программы EUROCARE-4. В этих работах представлены данные о результатах лечения онкологических больных более чем в трехстах организациях-участниках программы.
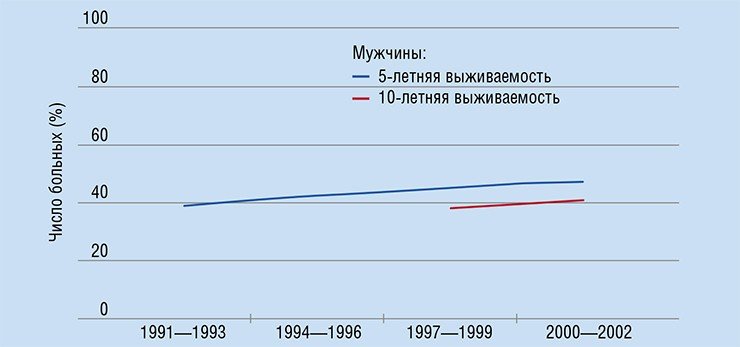
По прогнозам экспертов, на тот момент в странах Евросоюза ожидалось появление более трех миллионов новых случаев заболевания раком в год, причем эта цифра с течением времени должна только увеличиваться. По оценкам участников проекта, около двух миллионов человек в Евросоюзе умирают в год от рака или его последствий. Причем в Европе, численность населения которой составляет не более одной восьмой от численности мировой популяции, регистрируется около четверти всех случаев онкологических заболеваний.
Какова же ситуация с излечением? За последние десять лет число излеченных больных увеличилось в Евросоюзе всего на 2—7 % (в зависимости от типа рака, локализации и т. д.). Используя все современные медицинские достижения, за эти десять лет удалось «добавить» пациентам в среднем лишь 6—18 недель жизни (средняя продолжительность жизни онкологического пациента в Евросоюзе составляет от 0,8—2,4 лет в зависимости от типа заболевания). И это в финансово благополучной Европе!
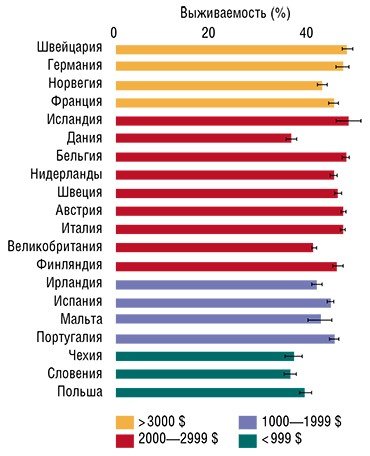
Впрочем, деньги здесь помогают мало. Например, Швейцария тратит на медицину в пересчете на каждого жителя примерно в десять раз больше, чем Польша. Однако соответствующая разница в числе онкологических больных, проживших 5 и более лет с момента диагностики, составляет всего 15—20 %.
Разумеется, есть и успехи. Однако, согласно упомянутым исследованиям, почти все они связаны с превентивными мерами и мерами, направленными на раннюю диагностику (в частности, речь идет о широких программах скрининга населения), а вовсе не с прогрессом в лекарственной терапии. Вместе с тем, число новых методик лечения рака и новых противораковых препаратов растет взрывным образом. Уже в 2007 г. мировые расходы на противораковые препараты оценивались в 31 млрд долл. (почти 60 % из них составили расходы США). Если современные тенденции роста сохранятся, к 2027 г. эти расходы увеличатся в десять раз.
В чем же все-таки дело? Почему прогресс в лечении рака столь незначителен по сравнению с масштабом используемых ресурсов? Многие специалисты сейчас считают, что нынешние подходы к терапии онкологических заболеваний малоэффективны, и нужно разрабатывать новые. Как сказал один из пожилых практикующих врачей: «А что вы хотите? Лечение рака по-прежнему находится на уровне каменного века: мы травим пациентов сильнодействующими ядами и рассчитываем, что болезнь умрет первой».
Дьявол сидит в деталях
В чем же состоит основная проблема и что можно предложить взамен существующих методов терапии рака? Представим себе современного терапевта, к которому поступил на лечение больной с подтвержденным онкологическим диагнозом. Что имеется сегодня в «арсенале» врача? Во-первых, хирургическое вмешательство, по-прежнему являющееся наиболее эффективным методом лечения онкологических заболеваний. Во-вторых, – терапевтические методы, на которых мы и остановимся.
Здесь имеется всего три основных «инструмента»: химические препараты, лучевая терапия (лечение радиационным излучением) и радиоактивные препараты. И в дополнение к ним – накопленный ранее опыт лечения онкологических больных.
 Среди используемых сегодня химических веществ доминируют препараты химиотерапии – так называемые цитотоксики, вызывающие необратимые повреждения и смерть клеток. Но имеется множество препаратов и с другими способами воздействия. Что касается радиотерапии, то наиболее распространено лечение радиационным излучением. Наряду с этим набирает силу терапия с использованием радионуклидных препаратов, содержащих радиоактивные изотопы.
Среди используемых сегодня химических веществ доминируют препараты химиотерапии – так называемые цитотоксики, вызывающие необратимые повреждения и смерть клеток. Но имеется множество препаратов и с другими способами воздействия. Что касается радиотерапии, то наиболее распространено лечение радиационным излучением. Наряду с этим набирает силу терапия с использованием радионуклидных препаратов, содержащих радиоактивные изотопы.
Развиваются также другие методы, например, так называемая фотодинамическая терапия, при которой введенный в ткани нейтральный препарат затем «активируется» световым (лазерным) излучением. Однако по способу воздействия этот метод является вариантом химиотерапии.
Все перечисленные терапевтические «инструменты» разработаны для некоторого «среднестатистического» пациента, но ведь на приеме у нашего врача – конкретный человек! Чем же будет руководствоваться специалист, выбирая тот или иной способ лечения?
Результаты клинических испытаний всех медицинских препаратов, допущенных к применению, обрабатываются статистически, насчет чего существуют строгие инструкции. Апробируются они на группах больных с «одинаковым диагнозом». И препарат поступает к врачам с заданной схемой применения, куда входят противопоказания, дозировки и т. д.
Итак, лекарство работает на группе схожих медицинских случаев, его и применяем – в чем проблема? Дьявол, как известно, сидит в деталях.
Если выбранное лекарство утверждено к применению, то это означает лишь, что при его приеме у значительной доли пациентов примерно (статистически!) с одинаковым диагнозом наблюдался прогресс при лечении заболевания. Статистический подход не позволяет учитывать никаких особенностей конкретного случая. Для статистики каждый больной – лишь один из многих, просто «набор» средних параметров.
Но это не самый главный недостаток статистического подхода. Подобные методы не допускают вопросов «почему?» Например, почему в «статистически однородной группе» при лечении данным препаратом у части больных был значительный положительный эффект, у некоторых – небольшой, а у остальных его и вовсе не было? Отсутствие ответов на подобные вопросы, а в еще большей степени – отсутствие самой постановки таких вопросов, не позволяет ожидать увеличения эффективности применения уже существующих медицинских препаратов. И в какой-то мере принуждает к разработке новых лекарств, которая, естественно, будет происходить также в рамках устоявшейся концепции среднестатистического пациента.
Одно для всех, или уникальное – каждому
Допустим, что в некотором царстве, в некотором государстве одна отдельно взятая компания решила наладить производство туфель для местного женского населения. Причем туфель универсальных, а именно таких, которые бы смогло надеть большинство.
Универсальные туфли производить легко, да и существенно дешевле. Прослушав радиопередачу о среднем жителе, менеджмент компании возликовал: это ж как просто! «Средняя» женщина носит 38-й, но лучше взять с запасом – допустим, 39-й. Или, чтоб совсем надежно, – 40-й!
Сказано – сделано. Выпустили опытную партию туфель 40-го размера – и давай проверять. Взяли группу из сотни дам всех возрастов (хотели 200 для надежности статистики, но сошлись на 100, чтобы сэкономить средства). В результате примерки оказалось, что туфли смогли надеть аж 75 дам! Статистически – результат блестящий. Правда, некоторым туфли слегка жали, а у многих на ноге болтались. А кому-то и вовсе не повезло – туфли на ногу не налезли. Но ничего, для них в следующий раз другая компания что-нибудь выпустит!
 Подобный подход к производству обуви любому покажется абсурдным. А вот по сути идентичный подход к производству лекарств от рака почему-то никого не удивляет. Более того, в этой области вновь и вновь пытаются создать универсальное лекарство «одно для всех». При этом всякий раз удивление вызывает лишь то, что панацеи вновь не получилось.
Подобный подход к производству обуви любому покажется абсурдным. А вот по сути идентичный подход к производству лекарств от рака почему-то никого не удивляет. Более того, в этой области вновь и вновь пытаются создать универсальное лекарство «одно для всех». При этом всякий раз удивление вызывает лишь то, что панацеи вновь не получилось.
…Вторая сказочная компания, учтя опыт первой, резонно рассудила: много женского населения осталось не охвачено. И предложила другой подход – «уникальное для каждого». Иначе говоря, каждой даме шить туфли, которые будут абсолютно точно соответствовать – причем отдельно – каждой ноге. Подход гораздо более прогрессивный, беда лишь в том, что долго и дорого. Настолько дорого, что лишь немногие смогут это себе позволить, и охватить всех, как планировалось, в обозримом будущем вряд ли удастся.
В контексте нашего обсуждения такая стратегия хорошо соответствует модели генетической индивидуализации лекарств, когда они не только подбираются, но и изготавливаются индивидуально для каждого больного. Пока этим способом не удается удовлетворить потребности даже минимального числа нуждающихся. По словам авторитетного эксперта в этих вопросах, координатора международного проекта «Геном человека» Э. Ландера, «идеальный вариант персонализированной медицины, о котором авторы проекта «Геном» мечтали 15 лет назад, пока хорошо работает лишь в презентациях, исследовательских проектах и заявках на гранты».
…Третья сказочная компания решила использовать так называемую «стратификацию» (предварительную разбивку на группы). То есть производить обувь ограниченного числа размеров (допустим, 35, 38 и 44). И не продавать покупателю пару, которая заведомо ему не подойдет, для чего выпускать еще и соответствующие «экспресс-тесты» – картонные стельки четырех размеров. Если нога покупателя будет соответствовать стельке – получай обновку! Если нет – просьба не беспокоить, есть другие магазины.
Такая «примерка» кажется не менее абсурдной, чем ситуация с первой фирмой. Однако идея «стратификации» в терапевтическом лечении рака, которая фактически заключается в подборе больного под определенное лекарство, на сегодня считается одной из наиболее перспективных. Но если идею «стратификации» довести до логического конца, мы должны получить «туфельку для Золушки», т. е. уникальную туфельку для единственной девушки. Однако современная медицина – не принц из сказки: она вынуждена работать в условиях ограниченных ресурсов и, что особенно важно в случае с онкологическими больными, при острой нехватке времени.
Таким образом, все рассмотренные нами стратегии в современных условиях не обеспечивают оптимальную лекарственную терапию. Есть ли приемлемая альтернатива? Обратимся снова к «туфельной» аналогии. Допустим, вы – в магазине, где очень много разной обуви, но при этом размера своей ноги не знаете и примерить обувь не можете. Как вы поступите? Попросите продавца дать (без примерки!) наиболее подходящую пару. Опытный продавец, оценив возраст, сложение и измерив длину ноги, обязательно предложит соответствующую, по его мнению, пару. Но, конечно, он не сможет точно определить, хорошо ли туфли будут сидеть на ноге.
Интересно, что эта ситуация почти в точности повторяет ту, в которой находится современный онколог. Для каждого больного врач на основании некоторых тестов и опыта (как своего собственного, так и своих коллег) из огромного числа существующих лекарств должен выбрать одно. Причем нужно дать прогноз, как оно будет на данного больного действовать, а возможности для «примерки» нет. И лекарство – это не туфли: если оно не подействует, это будет означать дальнейший прогресс болезни, и повторные «попытки» могут оказаться бесполезными из-за упущенного времени.
Не «что», а «как»!
Итак, многие специалисты пришли к выводу, что статистический подход к лекарственной терапии опухолей нужно менять на персонализированный. Здесь есть три возможных решения, которые обсуждались выше: персонализировать лекарства (то есть изготавливать его индивидуально для каждого случая), персонализировать схемы применения уже существующих лекарств, или то и другое вместе.
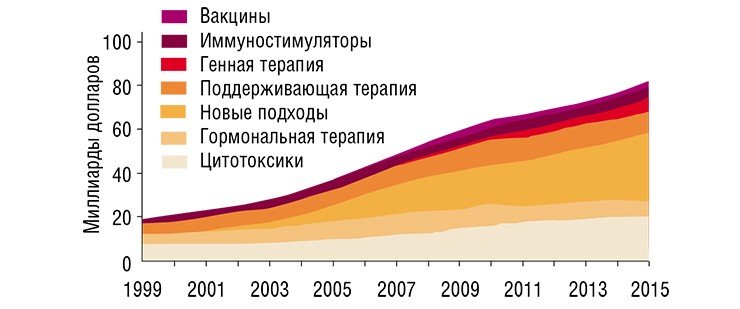
Пока не ясно, как можно поставить «на поток» разработку и производство противоопухолевых лекарств индивидуально для каждого пациента. Поэтому в настоящее время наиболее приемлемым считается вышеупомянутый промежуточный подход «стратификации» (Jrgensen, 2008). В его рамках предлагается проводить экспресс-тесты, помогающие определить, будет ли выбранное лекарство эффективно для конкретного пациента. Имеющиеся на сегодня экспресс-тестовые системы не слишком дороги и просты в практическом использовании, но, к сожалению, они не всегда адекватны и существуют пока лишь для малой доли лекарств и небольшого числа типов опухолей.
Поэтому было бы весьма разумным персонализировать схемы применения уже известных и широко используемых онкологических препаратов. Ведь даже в рамках утвержденных схем их применения имеется широкое «поле для маневра». Поэтому здесь можно добиться хороших результатов с гораздо меньшими затратами, чем при разработке новых лекарств.
А затраты, связанные с лечением онкологических пациентов, уже начинают доминировать при выборе способа лечения. И, судя по всему, во многих европейских государствах системы здравоохранения намерены сдерживать растущие расходы. Во многих случаях, государственная система здравоохранения уже соглашается оплачивать только «эффективно действующие лекарства» (pay for performance). Подобные схемы начинают действовать в английской национальной системе здравоохранения, а швейцарская по закону оплачивает только признанные эффективными методы лечения.
К сожалению, ситуация с терапией онкологических заболеваний в Европе за последние годы во многом ухудшилась благодаря введению в Евросоюзе более строгих регуляторных механизмов сертификации новых медицинских препаратов и методов лечения. Затраты на клинические испытания резко выросли, что привело к заметному уменьшению объема медицинских исследований, и в конечном счете – к росту цен на новые лекарства. Что касается результатов этих мер, то нобелевский лауреат по физике А. Гейм так сказал об этой проблеме на церемонии награждения в Стокгольме: «...как вы думаете, сколько экспериментов, за которые были получены Нобелевские премии, могло быть остановлено, если бы этические нормы или правила здравоохранения и безопасности были такими же суровыми, какими они являются сейчас? Я думаю, много».
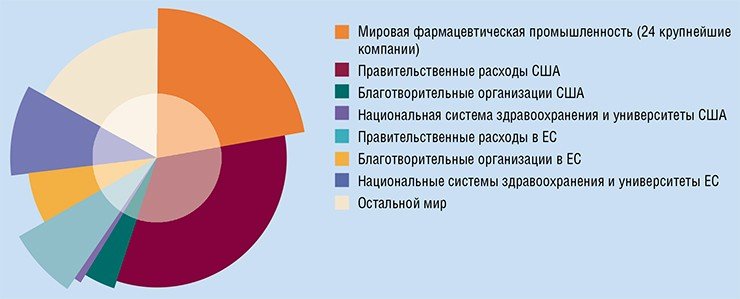
И вот тут самое время снова вспомнить об аспирине, прием которого «уменьшает вероятность риска умереть от рака». Почему этот факт вызвал такой значительный интерес, несмотря на то, что положительный эффект использования противовоспалительных лекарств при опухолевых заболеваниях известен довольно давно? Не потому ли, что на фоне небольшого прогресса в лечении рака доступность лекарств становится острой социальной проблемой? И людям, как всегда, хочется поверить в чудо. Следует признать, что рациональное зерно в этом имеется. Похоже, что назрела необходимость пересмотреть наше отношение к лекарствам, когда мы неосознанно больше доверяем модным, дорогостоящим препаратам. Похоже, стоит приложить больше усилий к тому, чтобы повысить эффективность применения уже существующих, хорошо известных лекарств.
Проблема «среднего»
И вот теперь пора обсудить проблему «среднего пациента». В этом смысле показательным примером служит температура тела, которую используют как общий показатель здоровья. Все знают, что нормальная температура тела (т. е. у здорового среднестатистического взрослого человека) равна 36,6 °С. Но само ее отклонение от нормы ничего не скажет о том, чем болен человек и как его лечить.
Что касается противоопухолевой лекарственной терапии, то сегодня все больше специалистов приходят к выводу о необходимости ухода от «среднего» и учета индивидуальных особенностей пациента и конкретного клинического случая. Оснований для этого предостаточно. Сейчас доказано, что к развитию онкологических заболеваний могут приводить, например, определенные нарушения в питании. Важными факторами канцерогенеза также являются хронический психологический стресс, низкий уровень физических нагрузок, даже смена сезонов (Basso et al., 1992).
С другой стороны, известны многочисленные случаи, когда прогресс в состоянии онкологических пациентов был достигнут с помощью траволечения, гипноза или других немедикаментозных средств. Правда, эти случаи часто не поддаются традиционной научной аргументации.
К сожалению, врачам до сих пор приходится пользоваться тем, что есть в наличии, то есть препаратами и методами, разработанными для гипотетического «среднестатистического» пациента, само существование которого вовсе не очевидно. То есть как бы полагаться на пресловутую «среднюю температуру по палате».
Вообще говоря, обсуждаемый статистический подход можно было бы, хоть и с некоторыми оговорками, принять, если бы не отягощающие обстоятельства. Во-первых, современная концепция разработки новых лекарств также строится на статистическом подходе. И каждый конкретный пациент рассматривается как некоторая реализация воображаемого пациента, для которого и было разработано лекарство, своего рода «отклонение» от «средней нормы».
Второе – наличие существенной зависимости от времени. Наш «пациент вообще» сегодня не такой, как вчера; до применения лекарства не такой, как после его применения и т. д. В реальности мы имеем дело не со случайной величиной, а со случайным процессом. И применение математического аппарата, разработанного для случайных величин и подразумевающего независимость конкретных реализаций от времени, к случайному процессу является неуместным.
Здесь можно ожидать град возражений, сводящихся к утверждению: «поскольку других подходов нет, то и существующие хороши». Позволим себе не согласиться с обеими частями утверждения. Во-первых, как будет сказано ниже, другой подход есть. Во-вторых, если не стремиться к улучшению ситуации целенаправленно, оно не наступит никогда. А современная критическая ситуация требует принятия немедленных мер. К тому же нет нужды отказываться от методов, уже доказавших свою эффективность, – в онкологии заметных результатов можно добиться только с применением всех работающих методов.
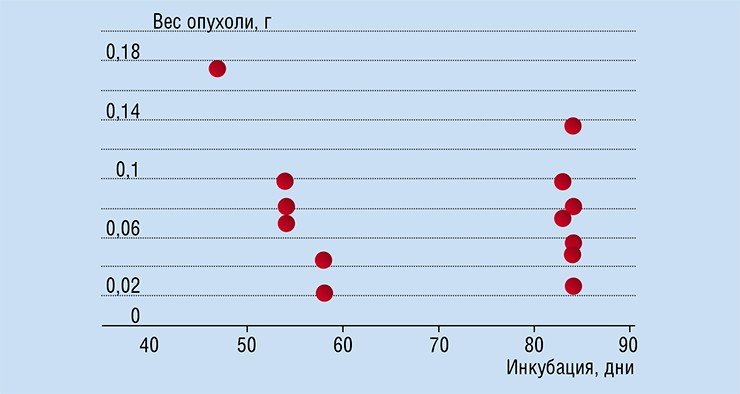
Ситуация с ориентацией на «среднего» усложняется тем, что подобный статистический подход доминирует и при апробации лекарственных препаратов, включающей испытания на лабораторных животных. Более того, бытует мнение, что специальные линии лабораторных животных, используемые для биохимических и медицинских экспериментов, состоят из «полностью идентичных» особей – если не клонов, то близких, как однояйцевые близнецы.
Поэтому предполагается, что раковые опухоли, «привитые» таким животным одновременно и стандартным образом, будут также развиваться одинаково. Однако прямые эксперименты на лабораторных мышах опровергают эту гипотезу об одинаковости. У разных особей наблюдается большая разница в размерах опухоли в один и тот же день инкубации, поэтому говорить об идентичном течении опухолевого процесса даже у животных из одной экспериментальной группы нет никаких оснований. Поэтому, к примеру, схему применения опытных препаратов во время предклинических испытаний желательно заменять на оптимизированную с учетом разницы в развитии опухолей.
Итак, на первый взгляд кажется, что из-за невозможности предварительной «примерки» и отсутствия хорошего механизма предсказания действия определенного лекарства на конкретного больного, путь персонализированной лекарственной терапии закрыт. Но именно для подобных ситуаций давно и успешно применяется математическое моделирование.
Основания для такого выбора понятны. Во-первых, моделирование как раз и нужно для того, чтобы строить прогнозы, причем не только качественные, но и количественные. Во-вторых, компьютерные технологии позволяют оперировать огромным количеством данных, что абсолютно незаменимо при моделировании таких сложных процессов, как динамика развития опухоли. Ну и в-третьих, современный компьютер с его возможностями отображения информации незаменим, когда результаты сложных вычислений требуется «донести до пользователя».
Именно так сегодня разрабатывают конструкции новых самолетов, которые проходят свои первые летные испытания в «виртуальном небе», а архитекторы проектируют новые дома и проверяют, устоят ли они при землетрясении. Что если и врачи-онкологи получат компьютерную программу, которая даст возможность предсказывать действие лекарств на конкретного пациента с его конкретной болезнью? Такая экспертная система позволит специалисту быстро перебрать большое число возможных вариантов и выбрать наиболее подходящий.
В будущих выпусках журнала мы, базируясь на результатах нашей почти десятилетней работы, расскажем о том, как математическое моделирование может помочь персонализировать схемы применения лекарств, об «инструментах», которые могут быть созданы в рамках этого подхода, а также о том, как обеспечивается связь теории и практики.
Литература
Basso A. M., Depiante-Depaoli M., and Molina V. A., Chronic variable stress facilitates tumoral growth: reversal by imipramine administration // Life Sciences. 1992 . V. 50. P. 1789—1796.
Coleman M. P., Alexe D.-M., Albreht T., and Mckee M. Responding to the Challenge of Cancer in Europe // Institute of Public Health of the Republic of Slovenia. Ljubljana. 2008.
J rgensen J. T. Are we approaching the post-blockbuster era? – Pharmacodiagnostics and rational drug development // Expert Review of Molecular Diagnostics. 2008. V. 8. P. 689—695.
Rothwell P. M., Fowkes F. G. R., Belch J. F. F., et al. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials // The Lancet, Early Online Publication, 2010. 7 December.
The European Journal of Cancer. 2009. V. 45. Iss. 6.
При оформлении публикации использованы картины А. Дейнеки «Стахановцы» (1937 г.) и «Футбол» (1924 г.)