Как отредактировать наследственность
Второе место в десятке научных прорывов 2013 г. по версии журнала «Science» занял метод редактирования геномов под названием CRISPR/Cas, позволяющий манипулировать хромосомной ДНК прямо в живых клетках. Система CRISPR/Cas состоит из компонентов адаптивной иммунной системы бактерий, адаптированных для работы в клетках высших организмов (эукариот), включая человека. С ее помощью можно не только изучать тяжелые, в том числе наследственные, заболевания, но и создавать модели для разработки новых способов их лекарственной и генной терапии
Еще c начала прошлого века ученые пытались понять принципы наследования признаков, хранения, воспроизведения и передачи генетической информации. И их усилия не пропали даром: постепенно были выяснены роль и функции в этих процессах основных «молекул жизни» – ДНК, РНК и белков. Раскрытие материальных основ наследственности и изменчивости организмов по праву было признано одним из важнейших научных достижений человечества XX в.
Наконец, благодаря усилиям тысяч ученых, были разработаны методы манипуляции с молекулами нуклеиновых кислот – носителей наследственной информации. Были открыты эндонуклеазы рестрикции (группа ферментов, катализирующих реакцию гидролиза нуклеиновых кислот) и разработаны методы клонирования ДНК. Все эти открытия привели к формированию новой науки – генетической инженерии.
Рубеж между прошлым и нынешним веком был отмечен еще одним важнейшим событием – завершением международного проекта «Геном человека», основной целью которого была расшифровка (определение нуклеотидной последовательности) ДНК всего генома человека. Критики этого проекта утверждали, что его осуществление – пустая трата огромных денежных и людских ресурсов, которая породит больше вопросов, чем ответов. Однако если сейчас трезво взглянуть на результаты этого проекта, то станет очевидно, что он внес неоценимый вклад в развитие современной, в том числе персонализированной, медицины.
В результате его реализации стало возможным раскрытие молекулярных механизмов тысяч наследственных заболеваний, развитие которых связанно с конкретными мутациями – вариантами последовательности ДНК различных генов. Сегодня уже ни для кого не секрет, что и предрасположенность к возникновению многих тяжелых и распространенных болезней, таких как рак, сахарный диабет и гипертония, также определяется генетически. И проект «Геном человека», безусловно, создал основу для лучшего понимания подбных явлений.
Таким образом, к началу XXI в. человечество подошло с огромным багажом знаний о геноме человека и многих других организмов, а также с набором различных методов для его исследования. Казалось бы, чего еще желать? Конечно же, научиться легко и эффективно манипулировать геномами в живых клетках и организмах! Но не является ли это вполне естественное желание лишь очередным капризом ученых?
Все мы знаем, что такое хирургия. Очень упрощенно суть этого медицинского направления заключается в инструментальном удалении больного органа или его части. В случае же трансплантационной хирургии удаленный орган заменяют другим, здоровым. А теперь представьте себе, что аналогичную операцию можно провести на геноме: вырезать «больную» часть молекулы, содержащую мутацию, и заменить ее «здоровой»! Задача, безусловно, более чем актуальная и жизненно важная. Однако для ее решения необходимы соответствующие инструменты. Если хирург пользуется скальпелем или лазером, то для исследователя, который производит операцию на молекуле ДНК, требуются молекулы-инструменты, соответствующие ей по размерам и обладающие высокой точностью.
Одним из таких инструментов, позволяющим манипулировать ДНК в составе хромосом в живых клетках, стала система CRISPR/Cas. Справедливости ради нужно сказать, что подобные инструменты уже были разработаны ранее. Среди них – искусственные ферменты нуклеазы, содержащие специальные ДНК-связывающие домены («цинковые пальцы»); химерные нуклеазы TALENs – искусственные ферменты, способные связываться практически с любой последовательностью гена и изменять ее. Однако явными преимуществами системы CRISPR/Cas являются простота создания, легкость использования и высокая эффективность действия.
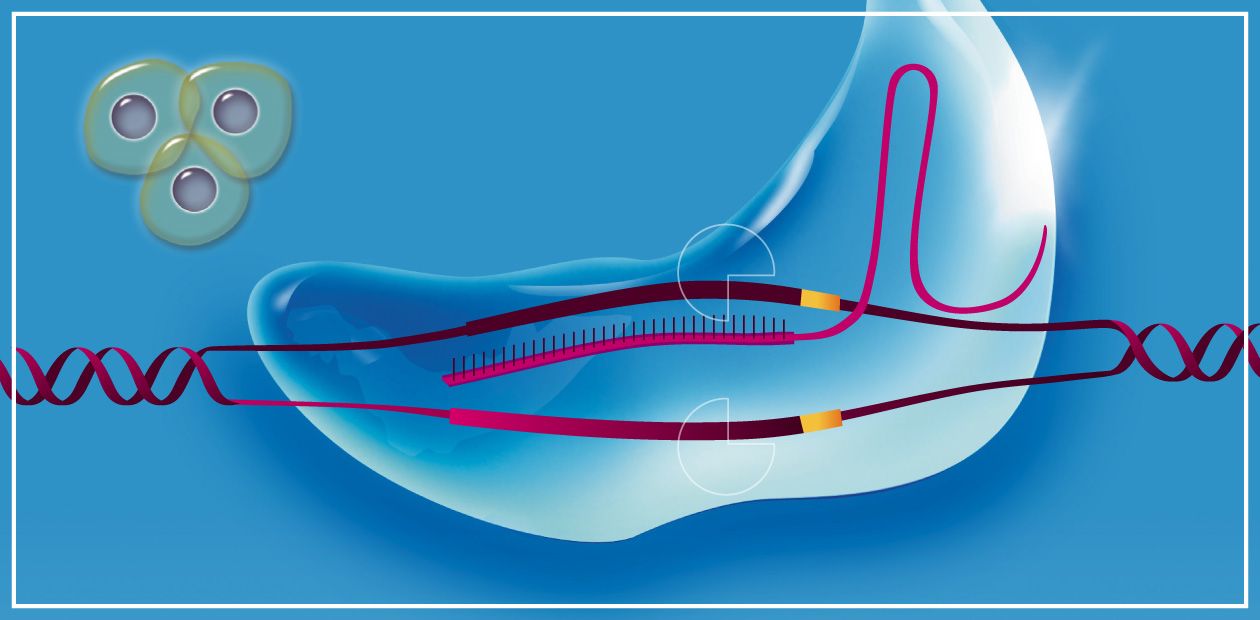
В основу CRISPR/Cas легла защитная система бактерий, своего рода приобретенный иммунитет, позволяющий им эффективно противостоять вирусам-бактериофагам.
Открытие иммунитета у бактерий началось с обнаружения в бактериальном геноме в 1980-х гг. странных участков ДНК, содержащих множественные одинаковые палиндромные повторы (повторяющие некодирующие нуклеотидные последовательности), разделенные неодинаковыми и притом уникальными для каждого штамма бактерий участками – спейсерами. Эти участки ДНК и были названы CRISPR или CRISPR-кассета (от Clustered Regularly Interspaced Short Palindromic Repeats – короткие палиндромные повторы, регулярно расположенные группами).
Результатом транскрипции (считывания информации с CRISPR-кассеты) оказываются короткие некодирующие РНК (crRNA), состоящие из спейсера и части палиндромного повторяющегося участка. Для функционирования системы необходима еще одна некодирующая РНК – tracrRNA. В непосредственной близости от большинства CRISPR находятся также гены, кодирующие белки Cas – ферменты-нуклеазы, способные разрезать нить ДНК.
Для чего все эти молекулы нужны бактериям, выяснилось только около десяти лет назад, когда было сделано открытие, что нуклеотидная последовательность спейсеров в составе CRISPR-кассет у определенной бактерии комплементарна последовательностям геномов вирусов, которые поражают бактерии этого штамма. При поиске механизма данного явления выяснилось, что в случае проникновения вируса его ДНК может рекомбинировать (обмениваться участками) с нуклеотидной последовательность CRISPR-кассеты. В результате с последней могут нарабатываться crRNA, способные специфически распознавать ДНК именно этого конкретного вируса. В случае повторной вирусной инфекции crRNA в комплексе с tracrRNA и белками Cas начинает взаимодействовать с вирусной ДНК, что в итоге разрушает ее.
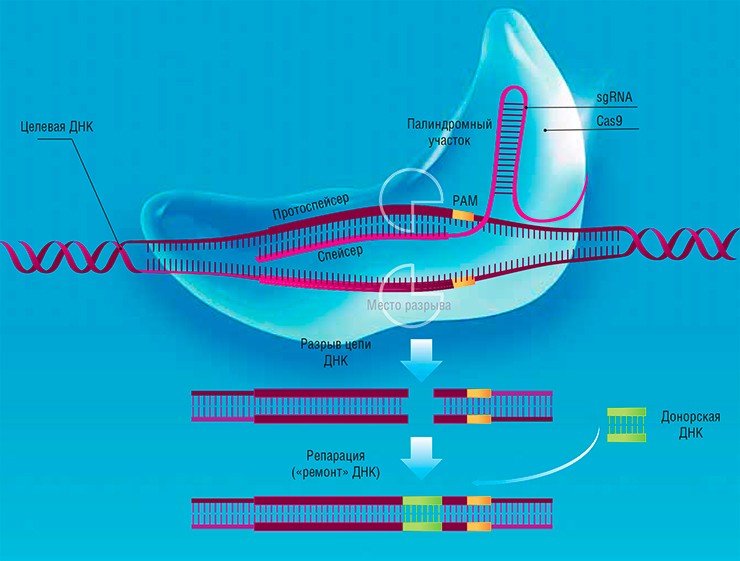
Таким образом, у бактерии формируется «иммунитет» к определенному вирусу, и ее потомки наследуют данное свойство. На основании подобной системы бактерии Streptococcus pyogenes были разработаны инструменты для модификации геномов эукариотических клеток высших организмов.
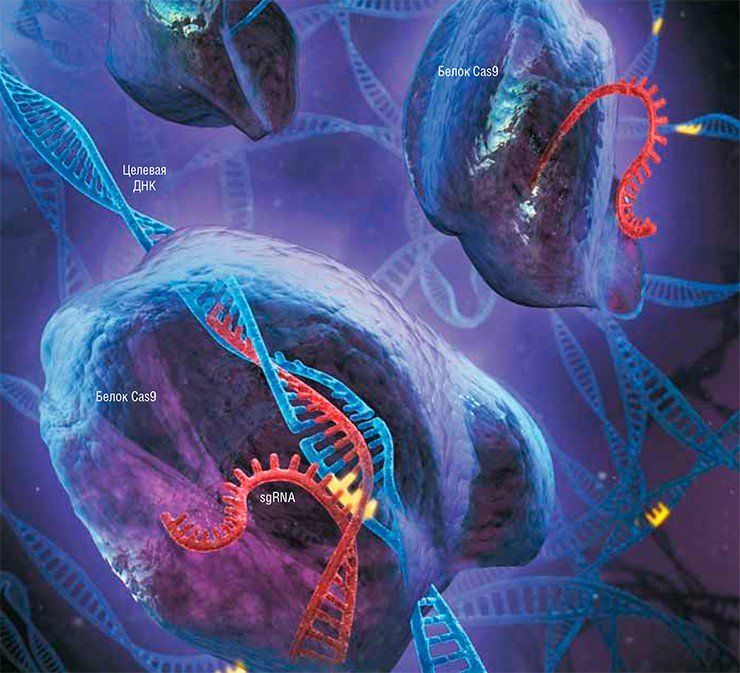
Для этого генные инженеры создали специальные векторы (искусственные генетические конструкции), нуклеотидные последовательности которых кодировали crRNA, tracrRNA и белок Cas9 (при этом crRNA и tracrRNA объединили в одну химерную молекулу – sgRNA). В определенный участок sgRNA поместили короткую последовательность – спейсер, которая может «опознавать» последовательность нужного гена.
Так была создана искусственная система CRISPR/Cas, которая на сегодня состоит из двух основных частей: некодирующей РНК (sgRNA) и нуклеазы Cas9. Использовать ее можно двояким образом. Так, после разрезания целевой молекулы ДНК в нужном месте этот разрыв затем можно «отремонтировать» путем негомологичного сшивания концов, в результате чего образуются небольшие делеции (выпадения) или инсерции (вставки) нуклеотидов. Таким образом можно «выключать» определенные гены и изучать их функции – этот подход уже прочно занял свое место в функциональной геномике.
Если же совместно с CRISPR/Cas в клетку поместить «донорную молекулу» ДНК, то при «ремонте» целевой молекулы в геном может встроиться новый фрагмент. Именно таким способом можно исправлять генные мутации в живых клетках.
В 2013 г. прошел шквал публикаций, посвященных применению системы CRISPR/Cas для редактирования геномов высших организмов, от плодовой мушки и нематоды до мыши и человека. В этих исследованиях решались задачи создания модельных животных, несущих мутации в определенных генах, и клеточных моделей наследственных заболеваний человека, а также исправление этих генетических нарушений.
В настоящее время методы редактирования геномов, такие как TALENs и CRISPR/Cas, начинают выходить из академических лабораторий и внедряться в медицинскую индустрию. В конце 2013 г. группа ученых, в которую вошли пионеры в области изучения этих систем модификации генома, организовала инновационную фирму «Editas Medicine». Цель нового предприятия – развивать методы геномной инженерии и применять их для создания медицинских продуктов.
Безусловно, лидерами в создании и применении систем редактирования геномов являются ученые из США и Европы. Вдохновленный успехами коллег, коллектив лаборатории эпигенетики развития Института цитологии и генетики СО РАН (Новосибирск) активно применяет технологии TALENs и CRISPR/Cas для создания на основе стволовых клеток человека клеточных моделей нейродегенеративных и сердечно-сосудистых болезней человека (болезни Альцгеймера, бокового амиотрофического склероза, болезни Хантингтона и т. д.). Ученые надеются, что эти работы помогут в поиске новых способов лекарственной и генной терапии тяжелых заболеваний.