Смерть ради жизни, или Терапевтический потенциал «клеточного самоубийства»
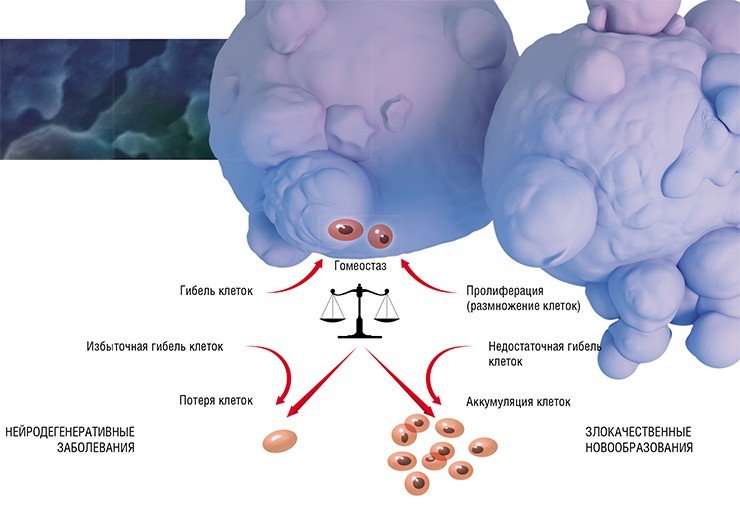
Созидание и разрушение – два неразрывно связанных природных процесса, две оборотные стороны мироздания, и человеческое тело в этом смысле не является исключением. Так называемая «программируемая», т. е. неслучайная, «активная» гибель клеток не только поддерживает структуру и работоспособность живого организма, но и обеспечивает само его формирование в процессе эмбрионального развития. Однако «каждая палка – о двух концах», и нарушения баланса клеточной жизни и смерти могут иметь печальные последствия. Огромный прогресс, достигнутый за последние десятилетия в изучении «горячих точек» этой области биомедицины, позволил не только выяснить детали механизмов, лежащих в основе программируемой гибели клеток, но и создать действенное оружие в борьбе с раком и другими тяжелыми заболеваниями
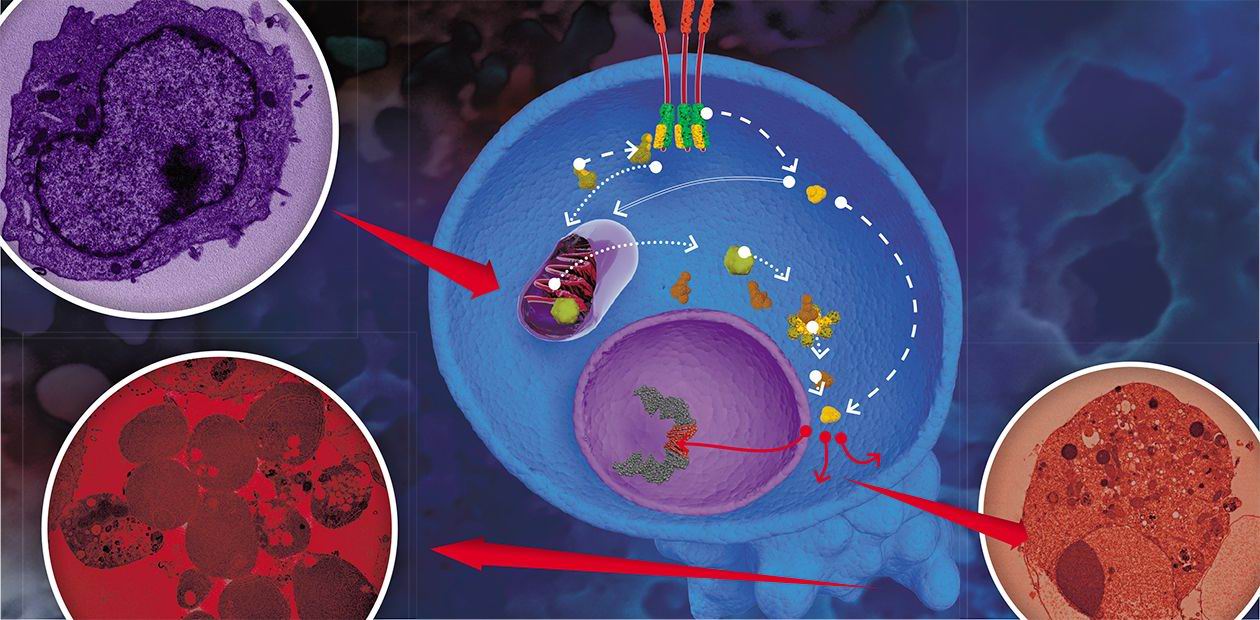
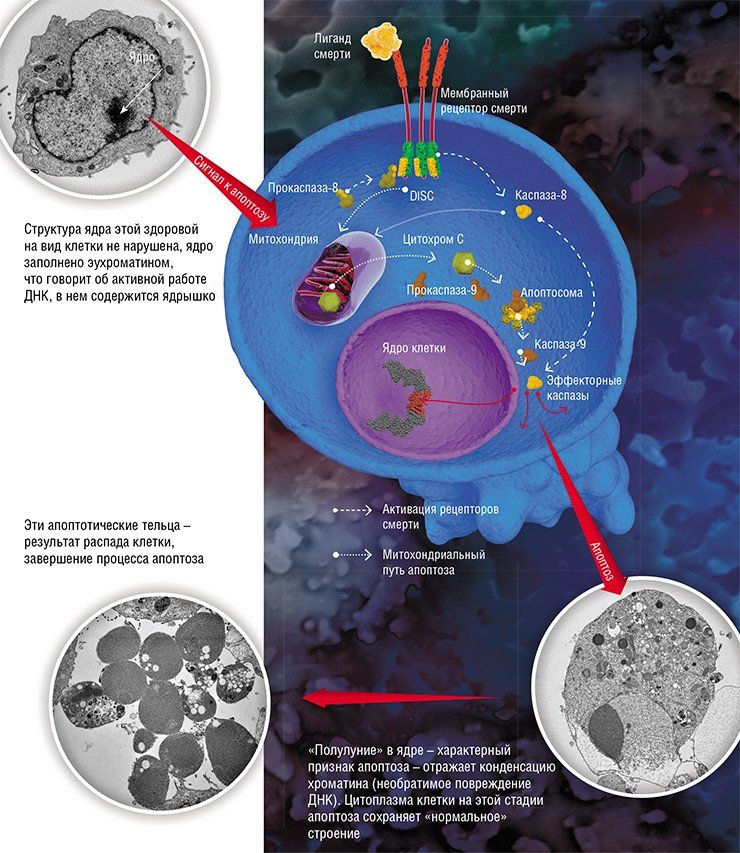
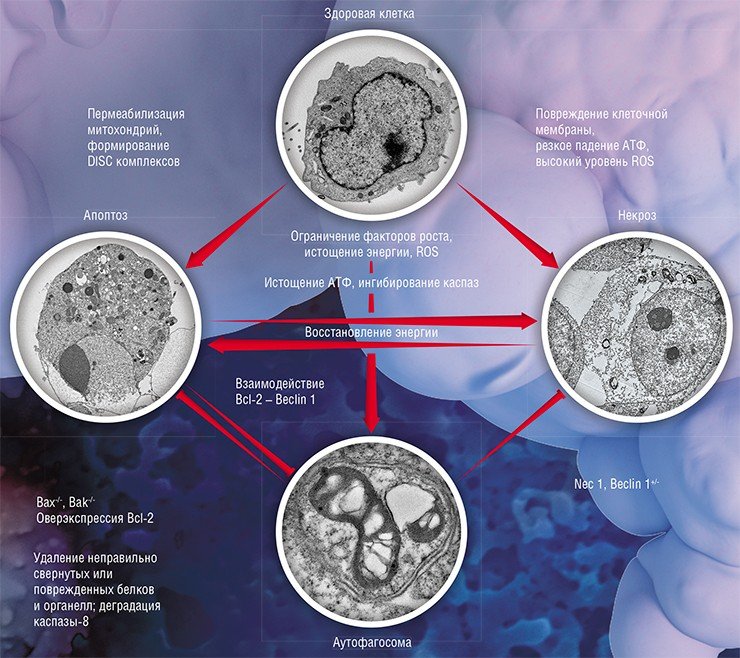
Среди всех типов программируемой клеточной гибели самым известным является апоптоз, в результате которого клетка распадается на отдельные апоптотические тельца, окруженные плазматической мембраной. Которые затем уничтожаются в результате фагоцитоза, явления, обнаруженного великим русским ученым И. Мечниковым, награжденным за это открытие Нобелевской премией в 1908 г. Именно поэтому апоптоз никогда не сопровождается воспалением. Но этот процесс далеко не единственный: согласно номенклатуре, сейчас описано до 12 разновидностей клеточного «самоубийства»!

С нарушениями механизма программируемой клеточной гибели в той или иной мере связан патогенез целого ряда заболеваний. Когда этот механизм работает слишком активно, и погибает слишком много клеток, мы получаем болезнь Паркинсона, болезнь Альцгеймера, цирроз печени, гематологические заболевания… В альтернативной ситуации на первое место выходит рак различной локализации.
Неудивительно, что внимание биологов, химиков и медиков сегодня направлено на изучение происходящих в организме деструктивных клеточных процессов и поиск соединений, которые могут влиять на их активность. К примеру, некоторые фармацевтические фирмы серьезно занимаются изучением механизма пироптоза, обладающего характеристиками одновременно и апоптоза, и воспаления. Оказалось, что путем активации этого процесса можно лечить подагру: в Швейцарии разрабатывается препарат, одна инъекция которого на полгода может избавить больного от мучительных симптомов.
В основе разных заболеваний лежат разные механизмы; соответственно, требуются и разные подходы к их лечению. Одно из основных направлений работ, которыми занимаются мои лаборатории в МГУ им. М.В. Ломоносова и Каролинском институте (одном из крупнейших в Европе медицинских университетов, основанном еще в 1810 г.), – это исследование резистентности (устойчивости) к терапии опухолевых клеток, связанной с нарушениями механизмов программируемой клеточной гибели.
В первую очередь речь идет об одной из разновидностей рака легкого – аденокарциноме легкого, которая плохо поддается традиционному противоопухолевому лечению. Найти же способ усилить чувствительность этой опухоли к химиотерапии нашей группе помогло изучение формирования зародыша … обыкновенной сосны.
От сосны – к человеку
Когда говорят, что кто-то нашел «лекарство от рака легкого», – не верьте. Дело в том, что «рака легкого» как единого заболевания не существует – за этим термином кроется слишком многое. Злокачественные опухоли легкого разделяют на мелкоклеточный рак (около четверти всех случаев) и немелкоклеточный, который, в свою очередь, включает аденокарциному легкого, крупноклеточную карциному и плоскоклеточный рак (сквамозную карциному). Все эти четыре заболевания по происхождению и механизмам образования совершенно различны, и единственное, что их объединяет, – место локализации.
Особенность мелкоклеточного рака легкого в том, что клетки опухоли распределены в здоровой ткани дисперсно, поэтому оперировать ее практически невозможно. Зато этот вид рака неплохо поддается химио- и иммунотерапии, однако если даже одна опухолевая клетка останется «в живых», возникает рецидив, и больной быстро погибает.
Немелкоклеточный рак легкого, напротив, хорошо поддается оперативному лечению, если диагностируется на ранних стадиях, но относительно устойчив к лекарственной терапии. К сожалению, его диагностируют, как правило, на поздних стадиях. Поэтому предпринимается много попыток по созданию препаратов для лечения этой группы опухолей, особенно аденокарциномы как одного из самых распространенных раковых заболеваний легкого (до трети от всех случаев). С проблемой терапии онкозаболеваний я знаком не понаслышке: моей давней любовью была радиобиология, которая занимается обоснованием радиационного лечения.
Один из проектов моей стокгольмской лаборатории был посвящен исследованию программируемой гибели клеток в зародыше сосны, которое мы проводили совместно с коллегами из Сельскохозяйственной академии Швеции. Эмбрион сосны изначально состоит из нескольких клеток, но по мере развития все они погибают в результате программируемой клеточной смерти, за исключением одной, которая и дает жизнь новому растению.
Оказалось, что в этом эмбриональном процессе важную роль играет белок TSN (Tudor Staphylococcal Nuclease), который является эволюционно консервативным, т. е. присутствует у всех организмов, от бактерий до животных, исключая дрожжи. Нам удалось выяснить, что у растений TSN расщепляется с помощью метакаспаз – ферментов, аналогов каспаз животных. Кстати таким образом мы обнаружили первый субстрат для этих ферментов.
Отправив статью с этими результатами в научный журнал, мы получили вопрос от рецензента, что хорошо бы еще узнать, что делает этот белок в клетках млекопитающих. Так мы перешли «от сосны к человеку», продолжив работу с медиками, которые снабжают нас клиническим материалом.
Игра на понижение
Изучая поведение белка TSN в культурах клеток аденокарциномы легкого человека, мы выяснили, что в случае их апоптоза он также расщепляется, и происходит это с помощью фермента каспазы-3. Анализ клинического материала, полученного от наших коллег из Российского онкологического научного центра им. Н.Н.Блохина, показал, что у всех пациентов с аденокарциномой легких экспрессия TSN в опухолевых клетках была выше, чем в нормальных. И, судя по истории болезни, все эти больные оказались устойчивы к химиотерапии.
Следующим шагом стала блокировка производства TSN в культуре опухолевых клеток с помощью методов генной инженерии. В результате мы получили клетки, чувствительные к агентам, повреждающим ДНК, – препаратам первой линии терапии аденокарциномы легкого. Однако здесь есть одно важное «но»: полностью блокировать выработку самого белка TSN в организме человека нельзя, так как он выполняет много функций, в том числе принимает участие в биогенезе микроРНК, регулирующих активность генов. И такое лечение имело бы слишком много негативных побочных эффектов. Поэтому мы пошли «вниз»: стали искать «нижестоящее» звено этого молекулярного механизма, которое можно было бы заблокировать относительно безболезненно.
Генно-инженерная блокировка TSN показала, что он участвует в регуляции активности около 200 генов, в первую очередь гена, кодирующего белок S100A11. Удивительное совпадение: примерно года за полтора до этого вместе с коллегами из лаборатории протеомики мы показали, что этот белок является членом большого семейства, и хотя сам не имеет каталитической активности, но в паре с белком р53 участвует в процессе апоптоза. Блокировка S100A11 дала тот же эффект, что и TSN, но была также небезопасна для организма. Поэтому мы пошли еще «ниже».
Колоссальный прогресс в области исследования механизмов программируемой гибели клеток подтверждается тремя (!) Нобелевскими премиями в области физиологии или медицины, полученными за последние 15 лет, что является уникальным событием. В 2001 г. Нобелевскими лауреатами стали Т. Хант, П. Нерс и Л. Хартуэлл за открытие генетических и молекулярных механизмов регуляции клеточного цикла; в 2002 г. – С. Бреннер, Д. Сулстон и Р. Хорвиц за исследования в области генетической регуляции роста и развития органов и процессов программируемой гибели клетки; в 2016 г. – Ё. Осуми за открытие механизмов аутофагии, посредством которой клетка утилизирует собственные органеллы и макромолекулыБиоинформатический анализ выявил ряд белков, взаимодействующих с S100A11, в том числе те, которые подавляют активность фосфолипазы А2 – фермента, гидролизирующего фосфолипиды. Фосфолипаза А2 является звеном так называемого арахидонового каскада (комплекса биохимических реакций преобразования жирной арахидоновой кислоты), который участвует в регуляции метаболизма опухоли. Заблокировав в раковых клетках производство фосфолипазы, сначала химически, а потом генетически, мы получили нужный эффект – повышение чувствительности опухоли к терапии ДНК-повреждающими агентами, только в меньшем масштабе.
Блокировка TSN давала результат в 100 % случаев, S100A11 – в 85 %, а фосфолипазы А2 – в 65 %. Более низкая эффективность в последнем случае компенсировалась снижением токсического воздействия на здоровые клетки, что очень важно для терапии. На сегодня химики из МГУ синтезировали несколько низкомолекулярных химических препаратов, которые препятствуют выработке фосфолипазы, ведутся исследования их эффективности. Конечно, это компромиссное решение, но неизбежное: как бы вы ни старались, влияния на здоровые клетки не избежать.
На этом наши «углубленные» исследования не закончились: в тот список белков, экспрессия которых меняется при блокировке TSN, попал еще один очень интересный белок, также являющийся членом большого семейства, и сейчас его детальным исследованием занимается моя московская лаборатория.
Российская история
Наша лаборатория исследования механизмов апоптоза на факультете фундаментальной медицины МГУ была создана на средства, полученные по первому конкурсу научных мегагрантов Правительства РФ. Начинали буквально с нуля: нам выделили лишь пустые комнаты, поэтому пришлось делать ремонт и закупать все необходимое, начиная со столов. К счастью, декан, академик В. А. Ткачук поддержал нас и дал возможность пользоваться всем оборудованием, имевшимся на факультете. Пока шел ремонт, двух из трех своих молодых сотрудников я послал за границу – учиться.
Первые два года ушли на создание реально работающей лаборатории молекулярно- и клеточно-биологических исследований – естественно, о получении каких-либо «выдающихся» результатов за такой срок не могло быть и речи. К этому времени грант закончился, и несмотря на то, что проект по всем показателям был полностью выполнен, нам его не продлили. Отказ сопровождался комментарием, что неудача МГУ в том, что были приглашены просто известные ученые, а не нобелевские лауреаты.
Мои молодые сотрудники получают небольшие зарубежные гранты и ездят в Швейцарию, Германию, Швецию, где не только выполняют часть работы по нашей теме, но и знакомятся с организацией работ в других лабораториях. Молодежь должна развиваться. В последнее время мы работали по двум грантам РНФ, которые закончились в 2016 г. Что будет дальше – пока сказать не могу»
Так начался новый этап нашей жизни. Несмотря на отсутствие финансирования, никто из сотрудников не ушел из лаборатории. Мы стали подавать заявки на финансирование в другие организации. И вновь не обошлось без курьезов: в анонимной рецензии из Российского фонда фундаментальных исследований недвусмысленно было указано, что анализ моего CV и списка публикаций не дает уверенности в моей возможности руководить подобным проектом. Интересно, что как раз в это время в Швеции я был руководителем европейского гранта по исследованию системной биологии апоптоза, на который выделили «всего» 11 млн евро. Для сравнения: грант РФФИ составлял 600 тыс. рублей, т. е. на то время около 20 тыс. долларов! Я связался с руководителем фонда и обрисовал ситуацию, которую он оценил как «безобразие». Однако ни имени «эксперта», ни денег мы так и не получили.
Но выход был найден: моим сотрудникам удалось получить молодежные гранты РФФИ, а затем мы начали успешно сотрудничать с только что открытым Российским научным фондом. К этому добавились гранты Президента РФ для научной молодежи, фонда «Династия», государственная поддержка ведущих научных школ… Все это дало возможность моим молодым сотрудникам работать в полную силу, что выразилось в получении ими за этот период четырех премий на различных конкурсах и конференциях.
Важным направлением работы лаборатории является изучение механизмов активации наиболее «мистического» члена семейства каспаз – каспазы-2. Открытый одним из первых, этот фермент до сих пор является наименее изученным. Более 10 лет назад было установлено, что активация каспазы-2 происходит в составе комплекса PIDDosome из трех белков. Мы впервые показали, что каспаза-2 может активироваться вне данного комплекса, и эти результаты были потверждены на нокаутных (с «выключением» гена) мышах в лабораториях Австрии и США. Сейчас проводится детальная характеристика нового комплекса, уже подана заявка на патент. Это теоретическое исследование имеет важное медицинское значение: предварительные данные указывают на специфическую функцию каспазы-2 в развитии опухолей, в частности, гинекологических. В сотрудничестве с клиницистами детально исследуется связь между уровнем экспрессии каспазы-2 и ответом этих опухолей на химиотерапию.
Что говорить, в России работать сложно, но уехать – это бросить молодежь, которая уже привыкла работать по определенным стандартам. Не открою истины, если скажу, что в России, к сожалению, наука часто живет «по понятиям» – за примерами далеко ходить не надо. И пока это так, успеха не дождаться: здесь, как, впрочем, и везде, надо жить по закону и справедливости.
В 2001 г. Нобелевская ассамблея предложила мне и шведскому профессору С. Оррениусу, который в свое время пригласил меня в Стокгольм, организовать конференцию Сell cycle and cell death in disease («Роль клеточного цикла и клеточной гибели в возникновении болезни»). На подобных тематических конференциях выступают только приглашенные докладчики, при этом не менее трети доклада должно быть посвящено новым, еще не опубликованным результатам. Поэтому проводят такие собрания обычно не чаще, чем один раз в 20 лет. Но к нашему удивлению и радости, вторая конференция под таким же названием, приуроченная к 200-летнему юбилею Каролинского института, была созвана уже через 10 лет. А в 2015 г. я вновь получил приглашение участвовать в организации уже третьей конференции, которая и состоялась в июне 2016 г.
Важно отметить, что если на первой конференции обсуждались лишь возможные механизмы изучаемых явлений, то на второй речь шла уже о конкретных заболеваниях, с ними связанных. На последнем же собрании каждый доклад заканчивался рассказом о реальных кандидатах в терапевтические препараты, либо об уже созданных лекарствах.
Несколько препаратов, принцип действия которых основан на феномене программируемой клеточной гибели, уже проходят клинические испытания, а некоторые из них одобрены американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). К ним относятся разработанный фирмой Genentec препарат с предварительным названием анти-PD1 для лечения ряда опухолевых заболеваний; препараты ABT-199 и ABT-293 от фирмы AbbVie, которые подавляют активность антиапоптотических белков семейства Bcl-2 и эффективны при острой и хронической лимфоцитарной и острой миелоидной лейкемии.
«Абсолютно необходимо заниматься образованием. Вместе с моими коллегами И. Лаврик и В. Гогвадзе я преподавал в МГУ курс “Программируемая гибель клеток в биологии и медицине” на английском языке, который посещали свыше 100 молодых сотрудников из МГУ и других университетов и научных организаций Москвы, Владимира и Ростова. В 2015 г. организовал совершенно новый курс “Токсикология в медицине”, посвященный общим механизмам токсикологии и патологии определенных органов, с акцентом на клинические испытания новых препаратов. А весной 2016 г. как гостевой профессор я прочел 16 лекций в Римском университете “Тор Вергата”, одном из старейших университетов итальянской столицы»И конечно, сейчас мы все больше говорим о персонализированной медицине. Еще раз отмечу, что универсального лекарства против рака не существует. Примером может служить химиопрепарат ИРЕССА от швейцарской компании Novartis для лечения аденокарциномы легкого. При клинических испытаниях этого препарата в Японии, где уровень заболеваемости стабильно высок, на лечение положительно отреагировали около 30 % больных – это невероятно хорошие результаты для такой терапии. Однако для американских пациентов эта цифра не превысила 2 %. Понадобилось несколько лет, чтобы выяснить, что результат зависел от наличия у больного определенной мутации в гене белка-рецептора эпидермального фактора роста EGF. Эта мутация распространенна в Юго-Восточной Азии, но практически не встречается в Европе и США.
Сегодня очень высока вероятность ситуации, когда новый и потенциально высоко эффективный препарат будет действовать только при определенных условиях, поэтому подбор лечения должен быть индивидуальным. В Евросоюзе сейчас работает большая и дорогостоящая программа по развитию персонализированной медицины – одного из китов, на котором будет базироваться здравоохранение будущего.
Литература
Kopeina G. S., Senichkin V. V., Zhivotovsky B. Caloric restriction – a promising anti-cancer approach: From molecular mechanisms to clinical trials // Biochim Biophys Acta. 2017. V. 1867. P. 29–41.
Zamaraev A. V., Kopeina G. S., Zhivotovsky B. et al. Cell death controlling complexes and their potential therapeutic role // Cell. Mol. Life Sci. 2015. V. 72. P. 505–517.
Zamaraev A. V., Kopeina G. S., Prokhorova E. A. et al. Post-translational modification of caspases: the other side of apoptosis regulation // Trends Cell Biol. 2017 (in press).