Во власти опухоли: почему метастазы так трудно остановить?
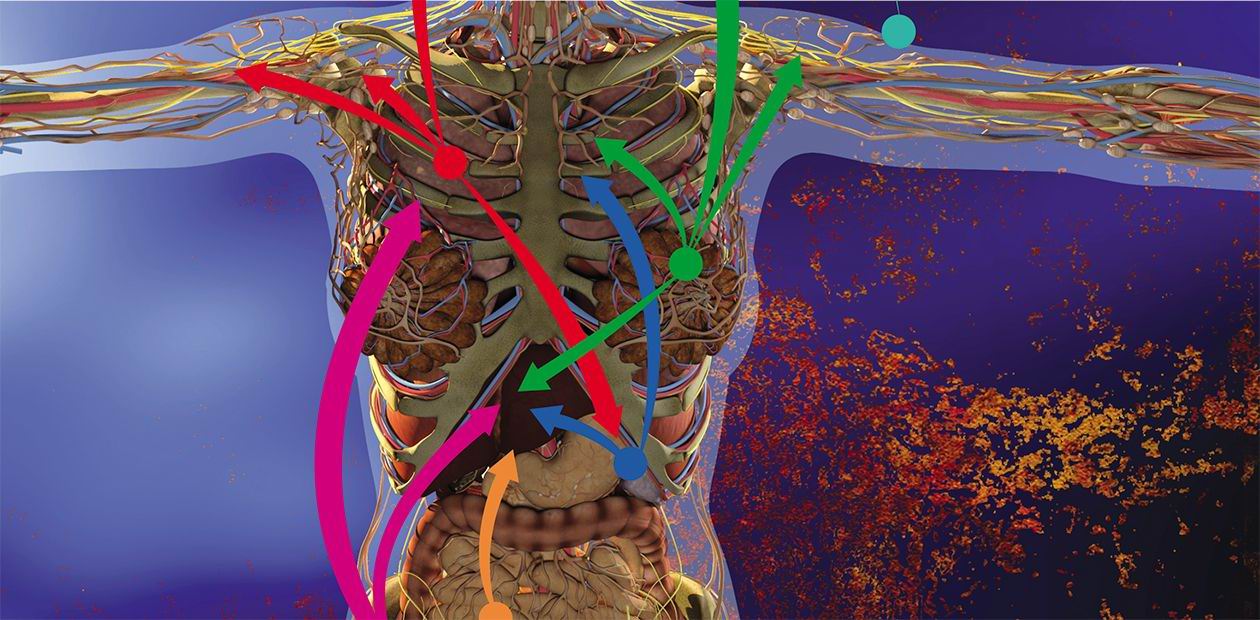
Когда хотя бы одна из 100 триллионов нормальных клеток организма перерождается в раковую и не уничтожается, срабатывает спусковой крючок и запускается рост опухоли. С развитием заболевания некоторые раковые клетки формируют метастазы – вторичные очаги опухолевого роста. И зачастую даже своевременное удаление первичной опухоли и послеоперационная терапия не способны вызвать ремиссию. Оказывается, первичная опухоль уже на ранних этапах своего роста способна «обучать» микроокружение в очагах развития будущих метастазов, да и сами метастазные раковые клетки «подстраивают» работу своих генов так, чтобы лучше прижиться в новом месте. Если мы будем знать, как предотвратить рост и развитие метастазов, то сможем спасти до 90 % людей, умирающих от основных видов рака
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
Некоторые раковые клетки первичной опухоли отделяются от нее и попадают в кровоток или лимфоток, по которому они путешествуют в главные магистрали сосудистой системы. Клетки, преодолевшие этот путь, выходят в строму органа за счет задержки в узких капиллярах и адгезии («прилипания») к внутренней сосудистой стенке. Лишь небольшая часть этих раковых клеток выживает в новой среде, но именно они и становятся родоначальником новых очагов роста опухоли. Процесс рассеивания раковых клеток по организму, названный метастазированием (от др.-греч. «менять, переносить»), был впервые описан еще в 1889 г. британским хирургом и патологоанатомом С. Педжетом, но его механизм долгое время оставался загадкой для научного сообщества.
Педжет провел аналогию между метастазированием и прорастанием семян, которые также выживают лишь в подходящей им «почве»-микроокружении. В те времена этой идее было невозможно дать экспериментального подтверждения, поэтому долгое время преобладала теория американского патолога Дж. Юинга, согласно которой основную роль в распространении метастазов по организму играют особенности динамики кровотока и устройство сосудистой системы.
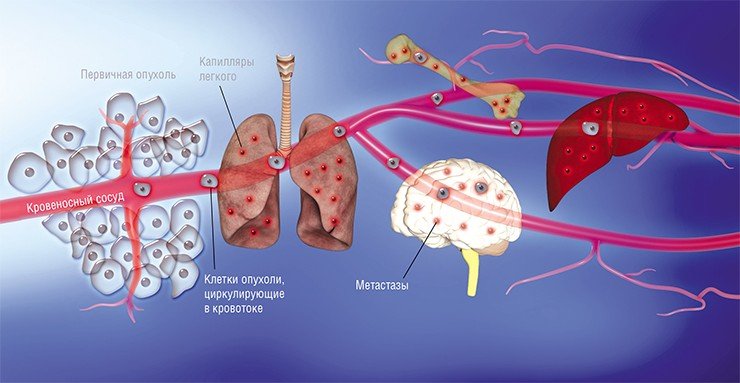
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
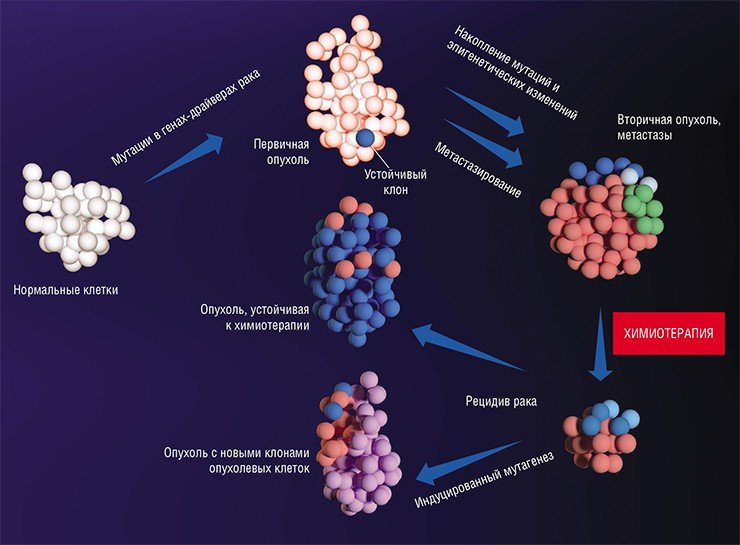
Поведение любой клетки генетически обусловлено. Злокачественная трансформация нормальных клеток в раковые связана с мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Эти выгодные для опухолевых клеток мутации сопровождаются мутациями в других генах, которые изначально не влияют на рост опухоли, – генах-пассажирах. С каждым поколением клеток, каждым новым клоном эти генетические изменения накапливаются. Некоторые клеточные клоны преуспевают больше остальных, что позволяет говорить об «эволюционных» изменениях внутри опухоли.
Метастазы можно сравнить с прорастанием семян: и те и другие выживают лишь на подходящей «почве». Отличие метастазов в том, что подходящие условия для их формирования создает сама первичная опухольСогласно одной из гипотез, некоторые клетки опухоли приобретают способность к метастазированию в результате аналогичного накопления мутаций в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения этому нет: сегодня ученые сходятся во мнении, что метастазировать способно большинство клеток первичной опухоли. Так, генетическое исследование клеток рака поджелудочной железы, рассеивающихся в лимфоузлы, печень и легкие, выявило, что клетки-основатели метастазов обладают тем же «профилем» мутаций-драйверов, что и первичная опухоль: их генетическое сходство даже выше, чем у случайно взятых клеток нормальной ткани (Alderton, 2017).
Но что происходит позже с геномами метастазных клеток? При сравнении клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов было установлено, что в новых очагах геномы раковых клеток продолжают эволюционировать независимо от первичной опухоли (Yates et al., 2017). При этом «профиль» мутаций в метастазных очагах в одном органе оказывается схожим, но различным в разных органах. Это означает, что раковые клетки адаптируются к новому микроокружению в зависимости от занятой ими ниши. Следовательно, хотя изначально клетки метастазов и первичной опухоли имели схожие мутации, процесс адаптации к новой среде инициировал появление новых генетических изменений. И эти мутации в основном связаны уже не с генами-драйверами, а с генами-пассажирами.
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких летДо сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
Оказалось, что в клетках метастазов «эпигенетический код» значительно отличается от «кода» первичной опухоли. Так, в случае рака поджелудочной железы в метастазах наблюдается значительное ослабление метилирования гистонов и ДНК. В результате участки неактивного хроматина (вещества хромосом) переходят в активное состояние, доступное для транскрипционных факторов, контролирующих считывание информации с ДНК на матричную РНК. Такой механизм приводит к усилению экспрессии генов онкогенеза в клетках метастазов (Alderton, 2017).
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Как готовится «почва» для метастаза
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
В 2005 г. в экспериментах группы Д. Лидена было впервые показано, что первичная опухоль стимулирует формирование так называемых преметастазных ниш в различных органах. Это происходит, во‑первых, за счет стимуляции рецептора фактора роста эндотелия сосудов (VEGFR‑1) на миелоидных клетках-предшественниках форменных элементов крови (эритроцитов, гранулоцитов, моноцитов и тромбоцитов) в костном мозге, что стимулирует их миграцию в очаги развития метастазов. Во-вторых, находящиеся в этих очагах фибробласты (клетки соединительной ткани) начинают усиленно производить фибронектин – один из компонентов внеклеточного матрикса. Миелоидные клетки-предшественники имеют рецепторы клеточной адгезии к этому белку, поэтому в буквальном смысле «попадают на удочку» и заселяют преметастазные ниши, где начинают секретировать воспалительные цитокины, факторы роста и проангиогенные факторы, стимулирующие формирование сосудов. Все это способствует модификации стромы органа и колонизации ее метастазами.
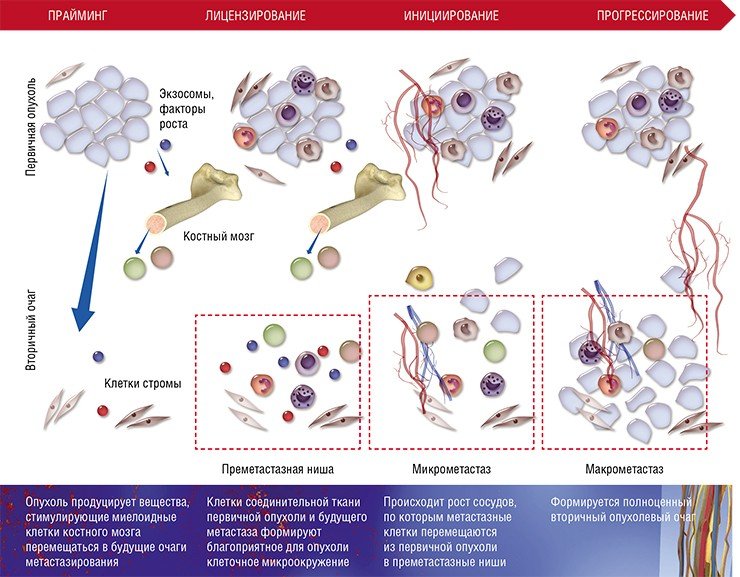
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Метастазы в костях – одни из самых коварных, и их преметастазная ниша имеет выраженные особенности. Например, при раке молочной железы в кости метастазируют только те раковые клетки, которые не имеют рецепторов к гормону эстрогену. Такие клетки первичной опухоли активно выделяют фермент лизилоксидазу. В костях этот фермент стимулирует формирование остеокластов – гигантских клеток-макрофагов, которые «съедают» костную ткань (Cox et al., 2015). Позднее эти полости, остающиеся в кости в результате разрушительной работы остеокластов, занимают метастазы.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
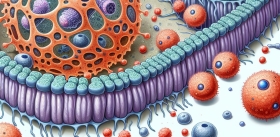
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропного метастазирования. Но на каком основании раковые клети, которые в принципе могут метастазировать в разные органы, выбирают один из них? Ключевой механизм, известный на данный момент, заключается в «обучении» будущих очагов с помощью специфичных экзосом – микроскопических внеклеточных пузырьков, секретируемых клетками. На липидной мембране экзосом располагаются рецепторы, а во внутренней полости – РНК и белки.
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
За счет чего это происходит? Экзосомы разных типов рака несут на своей поверхности рецепторы к определенному белку внеклеточного матрикса, играя роль «межклеточной почты»: они адресно доставляются именно в тот орган, в строме которого содержится много такого специфического белка. Сливаясь с мембранами клеток стромы, экзосомы освобождаются от содержимого. В клетках запускается программа преметастазной подготовки: в фибробластах легких – через активацию одних генов группы S 100, в клетках Купфера в печени – других генов той же группы. В результате стимулируются клеточные каскады передачи сигнала и воспалительные реакции, благодаря которым происходит «обучение» преметастазной ниши (Hoshino et al., 2015).
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Сегодня мы также знаем, что под действием цитостатиков субклоны раковых клеток увеличивают секрецию факторов роста и запускают клеточные сигнальные каскады, препятствующие гибели клеток. Кроме того, их выживанию помогает поддержка клеток стромы, под действием химиопрепаратов меняющих свое поведение на «оборонительное». В результате после химиотерапии зачастую выживают субклоны раковых клеток с мутациями, которые оказались полезны в новой среде, т. е. с устойчивостью к использованным лекарственным средствам.
Обнаружение преметастазных ниш и понимание их устройства позволили по-новому взглянуть на проблемы терапии онкозаболеваний. Ведь если бы были найдены способы воспрепятствовать такой подготовке «почвы» для метастазирования, это позволило бы намного увеличить вероятность наступления ремиссии.
Литература
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
Публикация подготовлена на основе статьи, которая участвовала в научно-популярном конкурсе «био/мол/текст»-2017 портала «Биомолекула» (biomolecula.ru)