Как возбудители опасных инфекций научились путешествовать в клетках иммунной системы
Развитие устойчивости (резистентности) бактерий к антибиотикам – неизбежное следствие процессов эволюции, естественного отбора. Постепенно в популяции оказывается все больше и больше бактерий, имеющих особенности, позволяющие игнорировать негативное влияние лекарств. Противомикробные средства, направленные не непосредственно на уничтожение бактерий, а на молекулярные мишени в клетках человека, участвующих во взаимодействии с «захватчиком», могут быть в этом смысле более интересными: в таком варианте развитие резистентности менее вероятно.
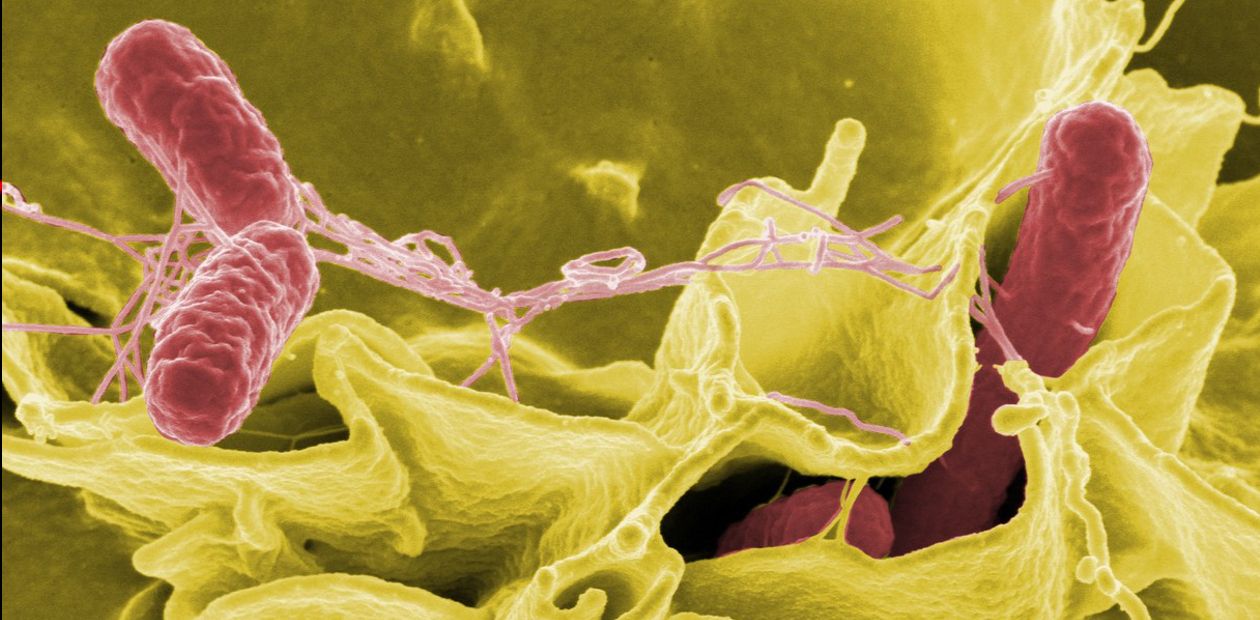
Основным объектом исследований ученых из Университета Северной Каролины была Francisella tularensis (F. tularensis), возбудитель туляремии, достаточно тяжелой и потенциально летальной инфекции, которую даже использовали для создания бактериологического оружия. Хотя от человека к человеку F. tularensis не передается, она поражает сотни видов животных и переносится клещами и комарами. Попадание в организм всего десятка микробов может в течение нескольких часов вызвать полномасштабную картину заболевания.
Бактерии F. tularensis ведут себя подобно солдатам армии, вторгающейся в средневековый замок – они прячутся в рядах защищающих замок рыцарей. В качестве рыцарей в данном случае выступают макрофаги – клетки иммунной системы, способные при атаке чужеродных микроорганизмов фагоцитировать их – распознать, захватить и переварить. Но так происходит не всегда, некоторые бактерии, и к их числу относится F. tularensis, могут выживать внутри макрофагов и даже оптимизировать для себя «условия проживания».
Одна из реакций организма на инфекцию – запуск в зараженной клетке механизмов клеточной гибели, вследствие чего она должна умереть вместе с инфекционным агентом во имя выживания организма в целом. Это относится как к «обычным» клеткам, так и к сильно зараженным фагоцитирующим клеткам, если они не справляются с уничтожением патогенов. Инфекционные агенты могут вмешиваться в эти процессы, результатом чего может быть, например, достаточно долгое время жизни клетки-хозяина, чтобы бактерия могла в ней размножаться, или, как это делает F. tularensis в отношении макрофагов, использовать как «транспортное средство» и распространяться по организму.
Самым интересным оказалось то, что F. tularensis перемещается ранее неизвестным способом, используя малоизученный процесс, имеющий отношение к функционированию иммунной системы, под названием трогоцитоз. В процессе трогоцитоза клетки как бы соударяются друг с другом и обмениваются компонентами мембраны, после чего расходятся. Именно во время этих коротких взаимодействий F. tularensis переходит из одной клетки в другую. Более того, F. tularensis не только пользуются этим процессом, но и каким-то образом активизируют его, так, что эпизоды трогоцитоза происходят чаще, чем в норме, тем самым ускоряя темпы распространения патогена.
После подтверждения роли трогоцитоза в распространении в организме F. tularensis, исследователи повторили эксперименты на бактерии Salmonella enterica (S. enterica), вызывающей острую кишечную инфекцию сальмонеллез. Оказалось, что S. enterica также использует трогоцитоз, только процесс идет медленнее. Возможно, и другие бактерии или вирусы могут идти этим путем.
Таким образом, если трогоцитоз имеет решающее значение для обеспечения способности патогена вызывать болезнь, это может быть потенциальной мишенью для разработки стратегии борьбы с инфекцией. А так как в лице F. tularensis ученые получили действующую модель агента, способного активировать трогоцитоз, есть надежда, что удастся достаточно быстро разобраться в механизмах его регуляции и научиться, наоборот, его останавливать, блокируя микроорганизмам возможность распространяться.
По: http://phys.org
Фото: https://www.flickr.com Credit: National Institute of Allergy and Infectious Diseases, National Institutes of Health
Подготовила Мария Перепечаева