Генно-инженерные бактериофаги – антибактериальное оружие будущего
Уже сегодня около 700 тыс. человек в мире ежегодно умирают от инфекций, устойчивых к антибиотикам, а к 2050 г. это число может увеличиться более чем на порядок. Один из альтернативных подходов – использование бактериофагов, вирусов, поражающих только бактерий. Ученые пытаются расширить возможности фаготерапии, увеличив антибактериальную активность бактериофагов методами генной инженерии
У прогресса, достигнутого медициной в лечении бактериальных инфекций, есть и «темная сторона» – появление патогенных штаммов с устойчивостью к антибиотикам, зачастую множественной. Бактериофаги, естественные враги бактерий, не обладают широким спектром действия, характерным для антибиотиков, воздействуя прицельно на конкретные виды и штаммы этих микроорганизмов. В этом сила и слабость современной фаготерапии.
Дело в том, что каждый фаг эффективен против одного, максимум нескольких штаммов бактерий, тогда как, к примеру, ангина со схожими симптомами у разных пациентов может быть вызвана разными штаммами стрептококка. В идеале терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины: перед лечением нужно выделять культуру патогена и тестировать ее на чувствительность к конкретным фагам. Современное здравоохранение к такому практически не готово.
 Да и сам поиск и выделение нового природного фага, определение его специфичности, которая зависит как от его рецепторов, так и защитных систем бактерии, − это кропотливый, трудоемкий процесс. Причем даже у штаммов бактерий, которые «в пробирке» чувствительны к бактериофагу, может сформироваться устойчивость во время лечения. Чтобы повысить эффективность фаготерапии, можно использовать коктейли из нескольких штаммов фагов или комбинировать фаги с антибиотиками, но и это не всегда приводит к нужному результату.
Да и сам поиск и выделение нового природного фага, определение его специфичности, которая зависит как от его рецепторов, так и защитных систем бактерии, − это кропотливый, трудоемкий процесс. Причем даже у штаммов бактерий, которые «в пробирке» чувствительны к бактериофагу, может сформироваться устойчивость во время лечения. Чтобы повысить эффективность фаготерапии, можно использовать коктейли из нескольких штаммов фагов или комбинировать фаги с антибиотиками, но и это не всегда приводит к нужному результату.
Но выход есть: методы современной синтетической биологии позволяют создать биоинженерные фаги с расширенным спектром антибактериальной активности. Варианты разные: можно нацелить такие фаги на бактериальные гены устойчивости к антибиотикам или к тем же фагам, придать им способность обходить бактериальные системы защиты, такие как CRISPR, и т.п.
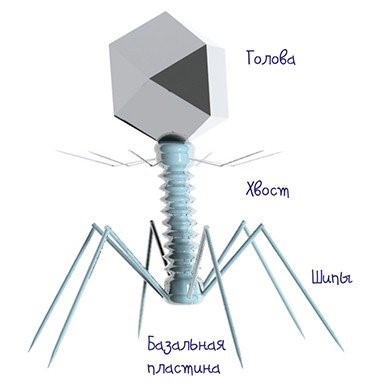
Как известно, бактериофаг, как и все вирусы, больше всего напоминает молекулярную машину. Устроен он достаточно просто и может размножаться лишь в живой клетке, куда попадает лишь генетический материал захватчика. Затем в клетке происходит синтез белков и нуклеиновых компонентов фагов и сборка новых фаговых частиц, которые освобождаются после гибели бактерии. Чтобы получить генно-инженерный фаг, нужно сначала сконструировать последовательность ДНК (РНК) с нужными генами, внедрить ее в фаговый геном и убедиться, что такой бактериофаг может размножаться («самособираться») в бактериальной клетке.
Ученые из Северо-Западного университета (США) занимаются созданием фагов, нацеленных на клинически значимые штаммы синегнойной палочки (Pseudomonas aeruginosa), вызывающие у человека тяжелые инфекции. Недавно им удалось «собрать» генно-инженерные геномы нескольких штаммов фагов против этих бактерий, используя клетки пекарских дрожжей (Saccharomyces cerevisiae).
Почему они использовали дрожжи? Ведь хотя дрожжи и являются одноклеточными, но относятся вовсе не к бактериям (прокариотам), а к эукариотам (ядерным организмам), как все животные и растения? Однако ранние попытки конструировать фаги и производить фаговые частицы в бактериях кишечной палочки (Escherichia coli), популярном и удобном объекте генных инженеров, закончились неудачей, предположительно, из-за фаговых белков, токсичных для бактерий. При этом в клетках дрожжей гены, кодирующие эти белки, активируются редко, и они остаются жизнеспособными.
Но дрожжи не способны стать «инкубаторами» для новых фаговых частиц, поэтому исследователи выделили из них фаговую ДНК и ввели ее путем электропорации в два разных штамма синегнойной палочки. ДНК фагов смогла обойти защитные механизмы бактерии и запустить сборку полноценных фаговых частиц. При этом разные штаммы фагов делали это с разной эффективностью, и ученым удалось установить, какие защитные системы бактерий мешали процессу сборки.
Конечно, пока такой подход далек от практического применения, однако важный шаг на пути к этому уже сделан, по крайней мере, в случае синегнойной палочки, которую ВОЗ в 2017 г. внесла в приоритетную группу особо опасных бактерий, для борьбы с которыми требуется создание новых антибиотиков. В перспективе же речь идет о массовом использовании фаготерапии для борьбы с лекарственно-устойчивыми инфекциями.
Публикации по теме:
Бактериофаги: 100 лет на службе человечеству
Бактериофаги – враги наших врагов
Вирусы и бактерии – великое противостояние
Фото: https://www.needpix.com, https://commons.m.wikimedia.org