Бор-нейтронoзахватная терапия рака: на финишной прямой
Несмотря на достигнутый за последние годы огромный успех в лечении онкозаболеваний, они до сих остаются одной из ведущих причин смертности в развитых странах, где растет продолжительность жизни. Многие злокачественные опухоли мозга, такие как глиобластомы, до сих пор считаются неизлечимыми: только в России от них ежегодно умирает около 4 тыс. человек. Идея облучать опухолевые клетки, насыщенные изотопом бора-10, потоком нейтронов определенного энергетического диапазона родилась много десятилетий назад. Но несмотря на свою кажущуюся простоту, эта методика «клеточного ядерного взрыва» оказалась настолько сложной в реализации, что в мире до сих пор нет ни одного специализированного комплекса для лечения рака с помощью бор-нейтронозахватной терапии. Благодаря работам новосибирского Института ядерной физики СО РАН, где был создан компактный ускорительный источник нейронов нового типа, у нашей страны есть все шансы стать мировым лидером в этой перспективной области терапии наиболее агрессивных раковых опухолей
Первый пучок нейтронов на нашей установке для бор-нейтронозахватной терапии рака (БНЗТ, BNCT) был получен в 2008 г. Главное достижение последних лет в том, что мы не только привели установку в рабочее состояние, но и поняли процессы, которые в ней происходят, и внесли соответствующие изменения в конструкцию. Это важно, потому что мы имеем дело с абсолютно новым типом ускорителя заряженных частиц.
На сегодня в мире используется десяток разных типов ускорителей, но ни на одном из них прежде не удавалось получить протонный пучок большого тока, необходимый для бомбардировки «мишени» – источника нейтронов с конкретными энергетическими характеристиками. При создании нашей установки мы не пошли проторенными путями и, похоже, это оказалось правильным решением. Конечно, в этой области было много гораздо более опытных специалистов, чем мы, но здесь сработал «эффект дилетанта»: появились совершенно новые, нестандартные идеи, которые помогли разрешить ряд казавшихся неразрешимыми проблем в создании компактных медицинских установок для БНЗТ.
Из России – с идеей
Все наши открытия и разработки запатентованы – российских патентов у нас более десятка. Пример наших разработок – нейтроногенерирующая мишень. Когда мы только начали заниматься созданием нашей установки, в одной научной статье уважаемых специалистов было сказано, что лучшей является литиевая мишень, но сделать ее не представляется возможным. У нас такая мишень прекрасно работает уже почти десять лет.
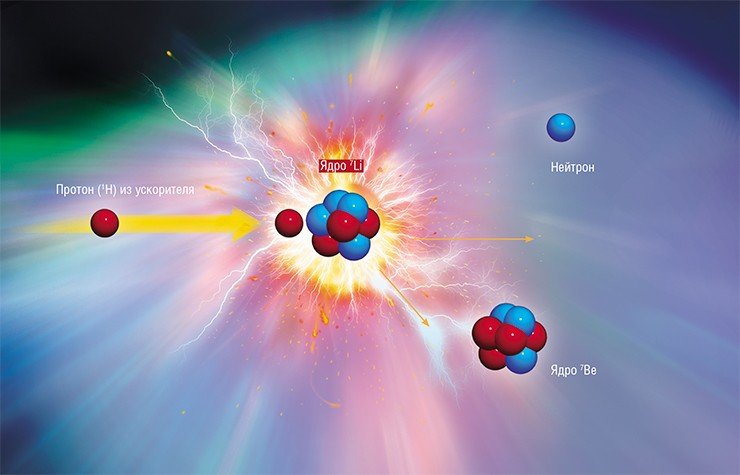
Недавно произошел примечательный казус, когда меня пригласили в Институт науки и технологий Окинавы – японский аналог нашего Сколково, в который были вложены безумные средства. Одна из задач лаборатории, которую возглавил бывший директор КЕКа (знаменитого японского ускорительного комплекса), – создание нейтроногенерирующей мишени. Изучив этот вопрос, японский руководитель также пришел к мысли, что такую мишень сделать невозможно, но мои друзья и его коллеги из КЕКа убедили его, что еще как можно! И я на их лабораторном семинаре рассказал, что есть совсем простая альтернативная идея, как ее сделать. До сих пор помню потрясенное выражение их лиц… Сейчас подобные мишени делаются во всем мире: в первой статье обычно ссылаются на наши работы, потом забывают. Это нормально: чтобы защитить свои идеи, надо не топтаться на месте, а придумывать что-то новое.
В октябре 2016 г. в г. Колумбия американского штата Миссури состоялся Конгресс по нейтрон-захватной терапии, который проводится раз в два года. Там собираются все – химики, биологи и физики, всего около 200 человек. В этот раз от России было два представителя – я и В. И. Брегадзе из Института элементоорганических соединений им. А. Н. Несмеянова РАН (Москва), который занимается созданием соединений адресной доставки бора. Это показывает, какие отечественные команды достигли реальных успехов в этой области.
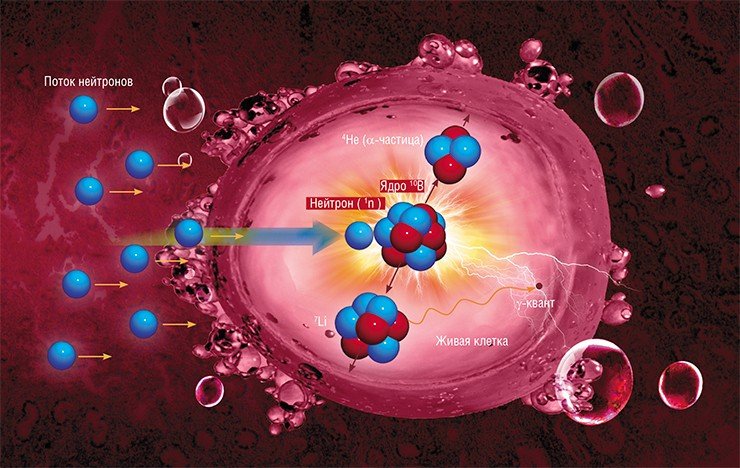
ВЗРЫВ В КЛЕТКЕ Идея бор-нейтронозахватной терапии была впервые предложена еще в 1936 г. – спустя 4 года после открытия нейтрона. Суть ее в том, что раковые клетки, насыщенные стабильным изотопом бора-10, облучают потоком тепловых нейтронов. Ядро бора-10 способно очень эффективно захватывать такой нейтрон, даже когда он «пролетает» мимо на расстоянии в десятки и сотни раз большем размера самого ядра. При поглощении нейтрона происходит образование двух массивных частиц. Благодаря быстрому торможению продуктов распада бора около 80 % энергии этой ядерной реакции выделяется внутри раковой клетки, что приводит к ее необратимому разрушению. Поток нейтронов должен иметь достаточную плотность, а максимум их поглощения должен приходиться на глубину, где расположена опухоль. Лучше всего этим требованиям соответствуют так называемые эпитепловые («промежуточные») нейтроны с энергией от 0,5 эВ до 10 кэВ. При этом распределение по энергии должно быть предельно узким, чтобы вклад сопутствующих потоков медленных и быстрых нейтронов, а также гамма-лучей был минимальнымЯ знаю в мире еще лишь две группы, которые, как говорят, получили пучок с нужными параметрами на ускорителях другого типа, одна бельгийско-японская, другая американская, но только наши результаты на сегодняшний день опубликованы. На том же конгрессе от российской стороны было представлено 7 докладов, три из которых докладывали японцы. И на первом же выступлении прозвучал вопрос: зачем они вообще поехали в Сибирь? Ответ был прост: там единственный источник нейтронов, который реально работает.
Из российских специалистов я бы хотел отметить еще В. Н. Митина, руководителя ветеринарной клиники при Российском онкологическом научном центре им. Н. Н. Блохина, который с помощью БНЗТ довольно успешно лечил собак на учебном ядерном реакторе соседнего МИФИ. После его смерти 11 лет тому назад эти работы прекратились.
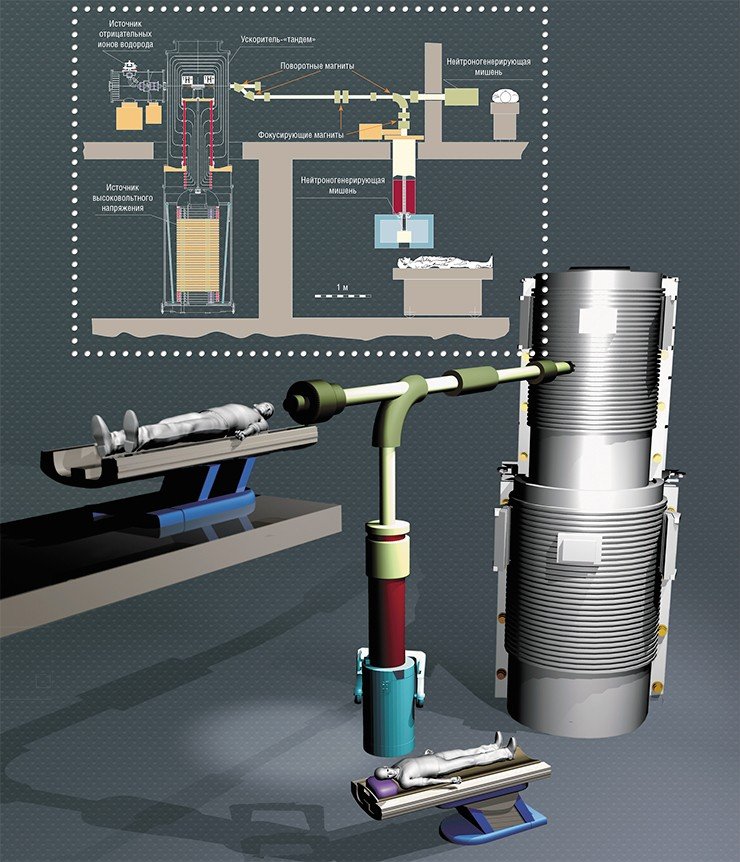
В новом ускорителе-тандеме вместо стандартной ускорительной трубки используется конструкция в виде «кочана капусты», где на «кочерыжке»-изоляторе в вакууме висят «листы»-электроды. Пучок отрицательно заряженных протонов проходит через центр «кочана» под углом 90 ° к «кочерыжке». Так как электроды в этом случае не разделены изоляторами, их можно расположить ближе друг к другу, что обеспечивает больший темп ускорения частиц
Кстати сказать, подобное лечение очень недешевое: стоимость препаратов адресной доставки бора довольно высока, так как при достаточно сложном производстве спрос невелик. Сегодня доза препарата, необходимая для лечения одного больного, обойдется в случае борфенилаланина примерно в 0,25 млн рублей, боркаптата – раза в 4 больше. Но 15 лет назад эти препараты стоили еще на порядок дороже, а сейчас на каждой конференции по БНЗТ предлагаются и обсуждаются сотни новых препаратов адресной доставки бора. Правда, каждый раз новые… В России таких соединений вообще не выпускают, мы используем препараты, произведенные чешской компанией Katchem.

Если же перейти к глобальным вещам, то, по моему мнению, физики свою работу сделали. Сейчас мы проводим модернизацию нашей машины, чтобы к лету 2017 г., независимо от финансирования, получить нейтронный пучок, который пригоден для терапии пациентов, с большей глубиной проникновения и т. п. И этот пучок будет идеальным в моем понимании – я не вижу принципиальных идей, которые позволят сделать его лучше. Недаром я добавляю к английскому названию нашего проекта BNCT букву i от слова «идеальный» – iBNCT. Возможно, технически что-то еще можно сделать лучше, но улучшить качество нейтронного пучка на сегодняшнем уровне развития укорительной техники невозможно. Хватит улучшать – пора внедрять!
Физики свое дело сделали
Когда мы еще только планировали свой ускоритель, мы поставили задачу достичь тока протонного пучка 10 мA, а получили поначалу в 100 раз меньше. Такая же история год назад приключилась с нашими японскими коллегами из Университета Цукубы, которым компания Mitsubishi делает подобную машину, но на другом типе ускорителя: при той же плановой цифре они вообще получили 0,1 % от желаемого.
Главная моя мечта тогда была – достичь хотя бы 3 мA, чтобы можно было начать лечить людей. И вот к началу 2015 г. мы получили сразу 5 мA, в 50 раз увеличив ток! Фактически сегодня уже не конструкция ускорителя лимитирует возможность дальнейшего увеличения тока. К тому же, по моему мнению, этих характеристик более чем достаточно для медицинских целей. Тем не менее в следующем году мы планируем достичь заявленной цифры – это уже дело принципа.

Еще одна ахиллесова пята литиевой мишени – сопутствующее паразитное гамма-излучение. Эффективная генерация эпитепловых нейтронов происходит только в очень узком поверхностном слое лития, поэтому по мере продвижения протонов вглубь нейтроны перестают генерироваться, а гамма-кванты по-прежнему излучаются. Оказалось, что уровень гамма-радиации существенно уменьшается, если дальнейшее торможение протонов происходит не в литии, а в более тяжелом металле. Для этого тонкий (50—100 мкм) слой металлического лития наносят на подложку.
Однако протоны, «проскочившие» литиевый слой, при торможении почти не рассеиваются и «застревают» практически на одной глубине, где со временем накапливается водород. При росте давления газа поверхность мишени начинает вспучиваться. В ходе экспериментов исследователям удалось подобрать максимально устойчивый материал подложки – при клиническом использовании такую мишень достаточно менять раз в неделю
Следующей мечтой стало доказать пригодность нашей машины с точки зрения не только физики, но и потребителя. Для этого нужно было поработать с клеточными культурами и лабораторными животными. Чтобы решить первую задачу, мы завели дружбу с японским Университетом Цукуба, при котором есть известная медицинская клиника. О ней могу лишь сказать, что протонная терапия рака, которая в прошлом году заработала в подмосковном наукограде Протвино, о чем было гордо доложено В. В. Путину, в прайсе этой клиники появилась еще в 1983 г., т. е. 33 года назад! А в 2001 г. японцы заменили протонную установку на более современную.
И вот в июне 2015 г. я встретился с директором клиники Акиро Мацумура, который в числе прочего рассказал, что Mitsubishi никак не может запустить ускоритель для БНЗТ. Так мы договорились о совместной работе. Это сотрудничество – взаимовыгодное. У нас – установка, у японцев – большой опыт проведения подобных исследований и, более того, лечения людей методом БНЗТ на реакторе JRR-4 (Токай), который впоследствии закрыли.

Сегодня для БНЗТ обычно используется боркаптат (борный сульфгидрил) и борфенилаланин на основе ароматической аминокислоты. В последние годы в мире активно ведется поиск и синтез новых потенциальных боросодержащих препаратов. В качестве носителей бора тестируются самые разные вещества, как низкомолекулярные (производные аминокислот, предшественника и аналога нуклеиновых кислот, дипептиды, производные сахаров и др.), так и высокомолекулярные, такие как антитела и их фрагменты. Основной задачей по-прежнему остается решение проблемы селективной доставки бора в клетки опухоли и накопление его там в необходимых количествах (около 109 атомов бора на клетку). Для доставки бора в опухоль можно использовать также наночастицы в виде липосом – замкнутых пузырьков с водным содержимым и липидными стенками. Борсодержащие препараты могут включаться как во внутреннюю полость липосом, так и в их оболочку (Шмалько и др., 2013). Недавно ИЯФ СО РАН запатентовал способ доставки борсодержащих препаратов для БНЗТ внутрь опухолевой клетки с помощью модифицированных липосом, в липидную часть которых введен люминесцентный краситель одного цвета, а в водную часть – другого. Контроль доставки препарата производится сопоставлением изображений, полученных в разном цвете (Таскаев и др., 2016)
Для наших исследований были приобретены в Институте цитологии РАН (Санкт-Петербург) четыре клеточные культуры, включая две стандартные контрольные и две – «опухолевые» – глиом и глиобластом человека. С помощью японских коллег и специалистов Института молекулярной и клеточной биологии СО РАН (Новосибирск) были проведены серии экспериментов по облучению этих клеточных культур. Чтобы точно знать концентрацию бора в тканях и клетках – с прицелом на возможную будущую терапию – мы экипировались дорогим (стоимостью около 10 млн рублей) масс-спектрометром японского производства для измерения концентрации растворенных веществ. Купили его на средства гранта РНФ, которые и тратятся преимущественно на приобретение необходимого оборудования.

В конце концов мы получили практически идеальный результат, когда при определенной, достаточно большой дозе облучения выживаемость здоровых клеток падала всего на 5 %, а раковых, в которых накапливался бор, – на 98 %! Этот результат свидетельствует о высоком качестве нейтронного пучка, основную часть которого составляют «правильные» эпитепловые нейтроны, которые захватываются преимущественно атомами бора.
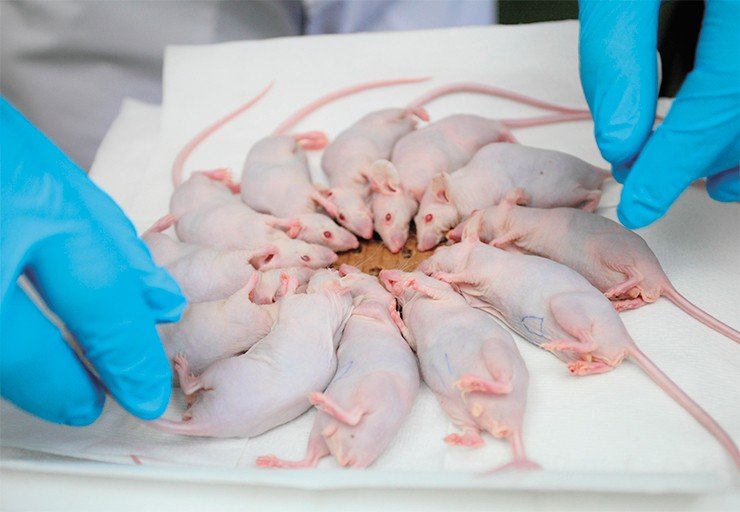
Параллельно со специалистами из Института цитологии и генетики СО РАН (Новосибирск) были проведены эксперименты уже на животных – иммунодефицитных лабораторных мышах, которым в мозг была привита «человеческая» опухоль – глиобластома. Обычно примерно через пять недель такие мыши погибали. Мы решили облучить их (правда, без особой надежды) за 5 дней до дня предполагаемой смерти. Для экспериментов были сделаны специальные контейнеры, с подогревом, куда помещались усыпленные животные.

В исследованиях на клеточных культурах используются различные линии как здоровых, так и опухолевых клеток, которые представлены преимущественно опухолями головного мозга. Клетки инкубируют в среде, обогащенной изотопом бор-10, а после этого облучают на ускорителе. После облучения проводят клоногенный анализ: проверяется жизнеспособность клеток, в частности, их способность делиться и образовывать новые колонии.
На основе экспериментов по облучению животных уже дана оценка последствий воздействия бор-нейтронозахватной терапии в зависимости от дозы облучения. Задача измерения дозы, которую получает пациент при проведении БНЗТ, является одной из самых сложных, поскольку суммарная доза состоит из нескольких компонент, измерение каждой из которых затруднено: от сопутствующих гамма-квантов из литиевой мишени и ускорителя, от быстрых нейтронов, от тепловых нейтронов и от захвата нейтрона бором. Каждая из этих компонент зависит от текущей геометрии литиевой мишени, а также от параметров протонного пучка. Плюс к этому доза от захвата нейтрона бором также зависит еще и от типа, формы и расположения опухоли, а также от распределения бора в ней и в окружающих тканях.
Расчет всех четырех дозовых компонент и предсказание воздействия на здоровые и опухолевые ткани при проведении БНЗТ являются значительно более сложными задачами, чем определение доз в традиционной лучевой терапии, которое обычно опирается на полуэмпирические алгоритмы и измерения в водном фантоме. Одним из вариантов создания эмпирического алгоритма планирования терапии являются эксперименты на лабораторных животных, для которых хорошо известны кривые доза–эффект. То есть по биологическим последствиям облучения в тканях животных можно более точно определять полученную дозу, чем с помощью расчетов.
Все животные без опухоли после облучения остались живы, признаков патологического воздействия на здоровые ткани не обнаружено. Сейчас более углубленно изучается влияние облучения на клеточном уровне, включая процессы кроветворения, состояние тканей жизненно-важных органов и воздействия борсодержащих препаратов на организм животного, чтобы подобрать оптимальную дозу.
После окончательной отработки технологии на животных планируется перейти к клиническим испытаниям, т. е. терапии на пациентах, больных раком.
В самом удачном испытании у трех из пяти животных опухоль рассосалась полностью, что было подтверждено результатами томографии, и животные стали здоровыми – они прожили в виварии еще два месяца и были усыплены просто потому, что результат эксперимента был достигнут. Это поистине фантастический результат. Ведь борфенилаланин, который мы вкалываем, накапливается не только в опухоли, но и в печени и почках. При этом мышь – животное маленькое, поэтому, в отличие от человека, ее облучают целиком, из-за чего больше страдают здоровые ткани. Нужно еще учитывать, что на поздних стадиях развития опухоли в результате гибели раковых клеток может возникнуть масштабный некроз. Но даже при всех этих отягчающих обстоятельствах мы вылечили животных!
Пора внедрять!
БНЗТ на сегодня является новой для нашей страны, перспективной и, главное, проверенной методикой лечения раковых опухолей, так что со стороны государства и крупного бизнеса будет большой глупостью ее не поддержать. Та же Япония сейчас развивает пять вполне успешных проектов по БНЗТ на разных типах ускорителей в рамках сотрудничества государства и таких индустриальных гигантов, как Mitsubishi и Toshiba. Фактически, все это государственные вложения.

Самый короткий и простой для нас путь обеспечить финансирование строительства терапевтической установки БНЗТ – получить грант в рамках прорывного научного проекта на базе программы САЕ (стратегических академических единиц) Новосибирского государственного университета. Согласно проекту, в течение очень небольшого срока (государственное софинансирование рассчитано на 4 года) мы должны будем построить установку непосредственно для медицинского использования и пролечить не менее 10 пациентов. Это достаточно амбициозный план, который будет непросто выполнить, но нам не привыкать ставить перед собой цели, на первый взгляд кажущиеся невыполнимыми. Фактически подготовительная работа по реализации этого проекта уже началась.
Из лекции д.х.н., профессора В. И. Брегадзе (Институт элементоорганических соединений им. А. Н. Несмеянова РАН, Москва):Нам нужно смотреть в будущее и искать соединения, которые будут более селективно накапливаться в опухоли. Основной принцип их получения – создавать молекулярные конъюгаты из борсодержащего компонента и части, отвечающей за адресную доставку в клетки опухоли. При этом особую важность имеет расстояние между ними, так как активная часть коньюгата может негативно отражаться на свойствах «транспортера».
На роль транспортной молекулы в первую очередь претендуют аминокислоты, а также другие низкомолекулярные соединения (порфирины, нуклеотиды и нуклеозиды, липопротеины и т. п.). Все эти соединения востребованы опухолевыми клетками, имеют к ним сродство и, соответственно, в них накапливаются.
Мы уже получили конъюгаты производных полиэдрических соединений бора с различными порфиринами, конкретно с хлорином Е6. Все синтезированные нами соединения мы отдаем на тестирование в Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова (Москва), чтобы оценить их накопление в опухолях и здоровых тканях. Исследования показали, что интенсивность накопления борсодержащего конъюгата в клетках карциномы легкого действительно выше в случае большего расстояния между борной частью и молекулой хлорина Е6.
Максимальное соотношение концентраций препарата в опухолевой и здоровой ткани, которого нам удалось добиться на сегодня, равно 5 : 1. Это лучше, чем для использующегося сегодня борфенилаланина (3 : 1),но надо стремиться к большему
В рамках проекта также планируется разработка улучшенного препарата адресной доставки бора – российского аналога борфенилаланина. Этим будет заниматься Институт органической химии СО РАН (Новосибирск), у которого есть свое опытное производство, совместно с Институтом элементоорганических соединений им. А. Н. Несмеянова РАН (Москва).
Как известно, НГУ планирует подать заявку на вторую очередь строительства, которая будет включать создание клиники, где будет практиковаться и БНЗТ. Но это – дело туманного будущего, поэтому в заявке по прорывному проекту университета изложен и другой сценарий. Согласно «запасному» варианту ИЯФ модернизирует одно из своих зданий, где будет размещен ускоритель, а также помещения для приема и лечения больных. Пропускная способность такой установки будет достаточно большой, так как сама процедура БНЗТ длится час, а делается обычно однократно.
Пока мы занимались созданием своей установки – искали идеальные решения, нам «попутно» пришлось решить много проблем, далеко выходящих за рамки ускорительной физики. Вместе с нейрохирургом Владимиром Каныгиным из Дорожной клинической больницы на ст. Новосибирск-Главный ОАО «РЖД» мы разработали и запатентовали систему формирования правильного пучка нейтронов, позволяющую менять его направление. Простое техническое решение, которое удалось найти, не только позволило облучать пациента с любой стороны, но и улучшило качество пучка.
В беседах с нашими японскими коллегами родилась абсолютно новая идея дозиметрии для БНЗТ, на которую уже тоже получен патент. А однажды на лыжне мы разговорились с коллегой по институту Андреем Соколовым, в результате чего появился патент на генерацию монохроматических нейтронов для поиска темной материи. Сейчас вместе с Александром Шмаковым из Института катализа СО РАН и Сергеем Громиловым из Института неорганической химии СО РАН обсуждаем возможность приспособить нашу машину для нейтронной дифрактометрии, которая позволит определять структуру легких элементов вещества.
Все эти идеи, которые мы патентуем, по большому счету очень тривиальны, но почему-то они приходят в голову лишь тому, кто не обогащен грузом опыта, т. е. дилетанту. Как я уже упоминал, именно так была создана наша установка, и я, будучи изначально специалистом по плазме, а не ускорительщиком, честно говоря, до сих пор удивляюсь, как у нас все это получилось.
За последние пять лет мы из специалистов, потенциально привлекательных в области БНЗТ, превратились в реальных игроков на этом поле деятельности. Последний же год мы фактически работали на потребителя. И это очень важно, ведь физики часто думают: вот, мы сделали что-то очень хорошее, почему же пользователи не бегут и не отхватывают это с руками? С таким подходом ничего не получится: надо самому прикладывать много усилий, чтобы работа по внедрению в практику твоих идей и разработок принесла конкретные плоды.

На сегодня в мире с помощью БНЗТ пролечено около двух тыс. человек, для чего использовались уже существующие исследовательские и учебные ядерные реакторы, многие из которых уже не работают. Важность же подобной терапии не нужно объяснять: с ее помощью можно лечить такие практически неизлечимые на сегодня опухоли, как глиобластомы и раковые метастазы. Но до сих пор эта методика остается, по сути, экспериментальной, и специалисты должны приложить еще немало усилий по разработке адекватных стратегий и методик лечения.
Наша установка на сегодня является единственным в мире работающим компактным источником пучка нейтронов, пригодного для БНЗТ. Мы готовы создать действующий медицинский ускоритель, на котором можно будет лечить пациентов уже в ближайшие годы. Но оба наших гранта – от Минобрнауки России на усовершенствование установки и от РНФ для проведения биологических исследований – заканчиваются в декабре этого года. Что будет завтра?
Литература
Neutron Capture Therapy: Principles and Applications. Eds.: W. Sauerwein, A. Wittig, R. Moss, Y. Nakagawa. Springer, 2012. 533 p.
Таскаев С. Ю., Каныгин В. В. Бор-нейтронозахватная терапия. Новосибирск: Изд-во СО РАН, 2016. 216 с.
В публикации использованы фото Александра Макарова