«Точная» онкология против «слабых мест» опухоли
Человечество значительно продвинулось в лечении онкологических заболеваний, разработаны и применяются так называемые «таргетные препараты», прицельно повреждающие только клетки, несущие определенные генетические маркеры. Чтобы правильно применять подобные лекарства, нужно проводить молекулярную диагностику генетических изменений в опухоли. В такой диагностике особенно нуждаются не больные с первичной опухолью, а пациенты с метастазами и рецидивами: опухоль со временем «эволюционирует», приобретая устойчивость или чувствительность к тому или иному виду терапии. В России биомедицинским холдингом «Атлас» недавно был создан тест Solo для оценки молекулярного профиля опухоли в рамках «точной онкологии», позволяющий оценить потенциальную эффективность более 50 противораковых препаратов
За последние десятилетия медицина значительно продвинулась в лечении онкологических заболеваний. Еще не так давно они были смертельны, но теперь, особенно при своевременной постановке диагноза и проведении терапии, многие пациенты не просто выживают, но живут долгой и полноценной жизнью. Уже созданы «таргетные препараты», прицельно повреждающие только клетки, несущие определенные генетические маркеры – мутации. Да и побочные эффекты от применения этих средств доставляют больным гораздо меньше неприятностей, чем «стандартная» химиотерапия.
Однако не все так просто. Генетических маркеров и «привязанных» к ним таргетных терапевтических схем настолько много, что врачам приходится нелегко: ведь лечение нужно назначить быстро, и для «перебора» маркеров просто нет времени.
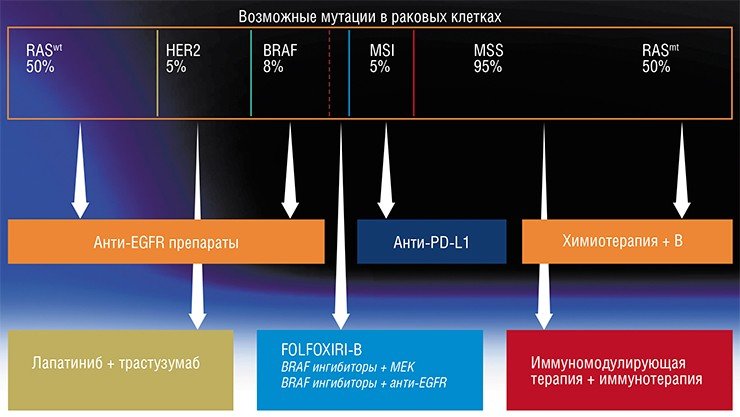
К примеру, клетки достаточно хорошо изученного колоректального рака могут нести любой из шести основных генетических маркеров или их комбинацию. Можно назначить лечение в зависимости от результатов исследования опухоли. А можно обойтись без него и назначить химиотерапию, которая поможет большинству пациентов. Это, безусловно, быстрее. Но если больной попадет в группу, не отвечающую на стандартный препарат, экономия времени обернется его потерей.
Мониторинг опухоли может продлить жизнь
Иногда бывают ситуации и посложнее. Например, считается, что, если есть мутация в гене BRAF (а она может быть в опухолях самого разного происхождения), надо применять соответствующие ингибиторы BRAF, и все будет хорошо. Но некоторым больным с этой мутацией данное весьма дорогое лечение все равно не помогает, но зато они хорошо отвечают на другие препараты. Узнать о том, какой препарат оптимален, поможет лишь комплексное исследование опухоли, а вовсе не единичный тест на один биомаркер.
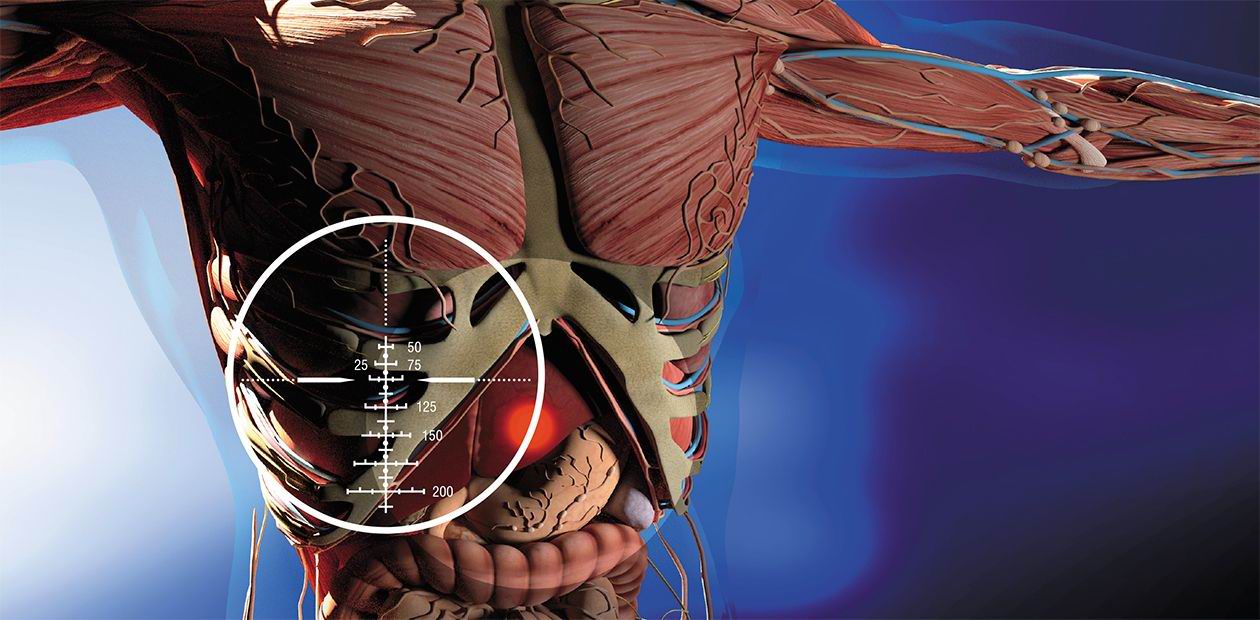
Мы привыкли думать о диагностике опухолей как о чем-то, что связано с моментом первой встречи пациента с врачом-онкологом в соответствии с хорошо известным утверждением: «Ранняя диагностика опухоли – залог успеха в лечении». Казалось бы, если у больного имеются отдаленные метастазы, тут уж не до диагностики, и так все ясно. Однако все с точностью до наоборот: именно рак с метастазами и рецидивами наиболее нуждается в молекулярной диагностике генетических изменений, накопленных опухолью. В результате эволюции опухолевых клонов отдаленные метастазы могут заметно отличаться от первичной опухоли, приобретя чувствительность к той или иной разновидности терапии. В таких случаях лечение таргетным препаратом не приведет к излечению (ведь первичный опухолевый клон не погибнет), но может привести к снижению опухолевой нагрузки, временному прекращению дальнейшего распространения заболевания и/или улучшению качества жизни больного.
Для примера рассмотрим случай 52-летней больной метастатическим немелкоклеточным раком легкого, течение болезни которой недавно было описано в одном из лучших медицинских журналов мира – New England Joural of Medicine. После начального осмотра и молекулярного исследования опухоли этой больной был назначен «таргетный» препарат кризотиниб. Через полтора года лечения в клетках опухоли появилась новая мутация, и клетки стали устойчивыми к препарату. Из-за этого кризотиниб пришлось отменить – это весьма дорогое лечение перестало быть целесообразным. Но врачи не сдались. Они попробовали сначала экспериментальный препарат, увеличивающий клеточный стресс, – безрезультатно. Затем перешли к «классической» химиотерапии, которая заставила опухоль отступить еще на шесть месяцев, но вновь случился рецидив. В отчаянии врачи снова ненадолго назначили кризотиниб – никакого ответа. И тут подвернулись клинические испытания лорлатениба, на которые больная согласилась. И болезнь снова ушла еще на полгода! Следующий рецидив был настолько тяжел, что больная оказалась в отделении интенсивной терапии с почти утраченной функцией печени. К счастью, врачи догадались повторить молекулярное исследование «свежего» опухолевого материала. Оказалось, что в злокачественных клетках возникла новая мутация, восстановившая чувствительность к кризотинибу! Препарат был назначен теперь уже в третий раз. Функция печени быстро восстановилась, метастазы сократились в объеме, и больная прожила еще полгода в состоянии относительного комфорта.
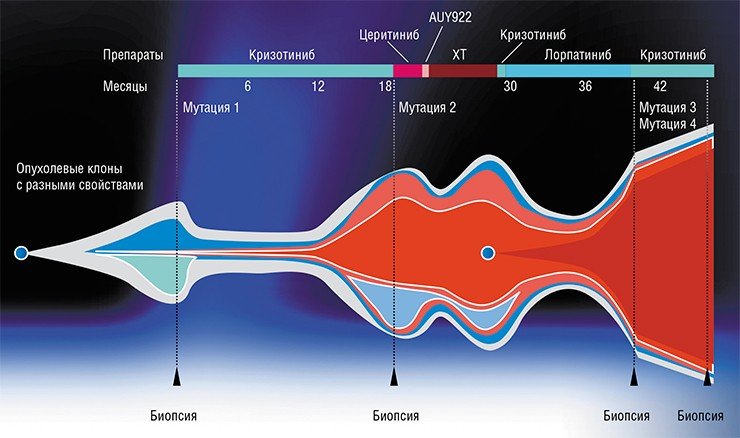
Какие выводы мы можем сделать из этой истории? Их два. Во-первых, молекулярное исследование опухоли стоит проводить после каждого рецидива, какой бы «запущенной» ни казалась болезнь. Во-вторых, опора на многократную молекулярную диагностику способна значительно продлить жизнь больного путем многократного, научно обоснованного «перевода» с одного препарата на другой, так, чтобы лечение все время оставалось оптимизированным. Описанная выше больная прожила четыре года после установки диагноза, в то время как средняя выживаемость при метастатическом немелкоклеточном раке легкого составляет всего восемь месяцев.
Сторонники и противники
Казалось бы, на фоне таких побед онкология должна стать практически точной наукой. Но пока этого не случилось. Во-первых, потому что мир таргетной терапии развивается настолько быстро, что повседневная клиническая практика просто не поспевает за постоянно усложняющимися терапевтическими схемами и сопутствующими им молекулярными исследованиями опухолей. А во‑вторых, в руках врачей и молекулярных генетиков находятся жизни людей: в области онкологии цена как ошибки, так и упущенного времени чрезвычайно велика.
Именно поэтому в лучших научных и медицинских журналах мира ведутся полемические битвы о том, какие результаты исследований стоит как можно скорее внедрить в клиническую практику, а какие – пока отложить. Результаты, полученные в некоторых исследованиях, противоречат друг другу. Например, одна группа ученых убедительно показывает, что для большинства больных с отдаленными метастазами правильный подбор таргетной терапии помогает затормозить развитие болезни, а другая – что в выигрыше оказываются лишь отдельные пациенты, а для большинства переход на эти продвинутые препараты, к сожалению, не приводит к увеличению выживаемости. Такие противоречия, зачастую объяснимые разницей в общем состоянии больных или особенностями их опухолей, всем «сбивают настройки». Именно поэтому с единым взглядом на перспективы «точной» онкологии не могут определиться даже авторы престижнейшего Nature.
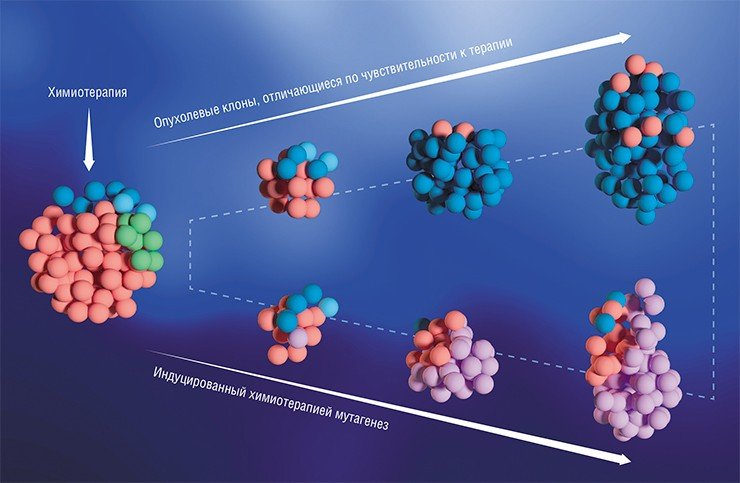
Итак, противники «точной» онкологии утверждают, что использование таргетных препаратов в лучшем случае лишь ненамного увеличивает продолжительность жизни онкологического больного, но при этом такие лекарства весьма дороги. Встает вопрос: стоит ли тогда тратить время, деньги и человеческие ресурсы?
Сторонники таргетной терапии рассуждают иначе. Ведь даже в случаях, когда таргетные препараты не смогли продлить жизнь больного, они улучшили ее качество. Как правило, таргетный препарат – это таблетка, которую можно принимать в домашних условиях, а общая химиотерапия – это внутривенные вливания в дневном стационаре или онкологической клинике, где больному и стены ежесекундно напоминают о его ужасной проблеме. Да и масштаб побочных эффектов у таргетных препаратов и у лекарственных средств «общего действия», просто несопоставим, так как обычная химиотерапия бьет без разбору все быстро делящиеся клетки организма, включая кроветворные, клетки слизистых и т. п. И трудно не согласиться с тем, что качество последнего года или двух жизни больного – это очень важно.
Как выиграть время?
Что же конкретно предлагает современная «точная» онкология? Для пациента и его семьи диагноз «опухоль» всегда неожиданность, часто требующая быстрых действий, при которых на «пошаговую» диагностику просто нет времени. «Точная» онкология позволяет получить полное описание всех молекулярных особенностей опухоли у конкретного больного и, тем самым, заменить неизбежный вопрос «Доктор, насколько страшна моя опухоль?» на «Доктор, а какова моя опухоль?». Это позволит лечить не абстрактный среднестатистический, к примеру, «рак молочной железы», а конкретную опухоль, возникшую у конкретной пациентки, с учетом как ее собственного генома, определяющего уровень токсичности каждого противоопухолевого препарата именно для нее, так и «слабых мест» размножающихся в ее теле злокачественных клеток.
 Максимальное облегчение работы врача по выбору оптимального режима терапии достигается путем диагностики молекулярных особенностей опухоли, основанной на сочетании методов высокопроизводительного секвенирования, флуоресцентной гибридизации in situ (FISH), микросателлитного анализа и хорошо знакомой онкологам иммуногистохимии. Секвенирование позволяет «поймать» мутации, даже если они присутствуют не во всех клетках опухоли, а лишь в некоторых – именно тех, которые способны дать рецидив. FISH выявляет хромосомные перестройки, микросателлитный анализ – степень нарушения системы репарации ДНК, а иммуногистохимия – белковые биомаркеры, расположенные на поверхности, в цитоплазме и ядрах опухолевых клеток.
Максимальное облегчение работы врача по выбору оптимального режима терапии достигается путем диагностики молекулярных особенностей опухоли, основанной на сочетании методов высокопроизводительного секвенирования, флуоресцентной гибридизации in situ (FISH), микросателлитного анализа и хорошо знакомой онкологам иммуногистохимии. Секвенирование позволяет «поймать» мутации, даже если они присутствуют не во всех клетках опухоли, а лишь в некоторых – именно тех, которые способны дать рецидив. FISH выявляет хромосомные перестройки, микросателлитный анализ – степень нарушения системы репарации ДНК, а иммуногистохимия – белковые биомаркеры, расположенные на поверхности, в цитоплазме и ядрах опухолевых клеток.
В области «точной» онкологии работают немало зарубежных компаний, наиболее известной из которых является Caris со своим продуктом Molecular Intelligence. Конечно, для российских врачей и для онкобольных, находящихся под давлением необходимости быстрого принятия терапевтического решения, работа с иностранной компанией, в том числе пересылка биологического материала, полученного при биопсии, нередко является непосильной задачей. К счастью, в России недавно был создан отечественный тест для оценки молекулярного профиля опухоли в рамках «точной» онкологии, ни в чем не уступающий зарубежному, а по скорости исполнения – даже значительно его превосходящий. И это не удивительно, так как послеоперационный тканевый блок не нужно пересылать за границу.
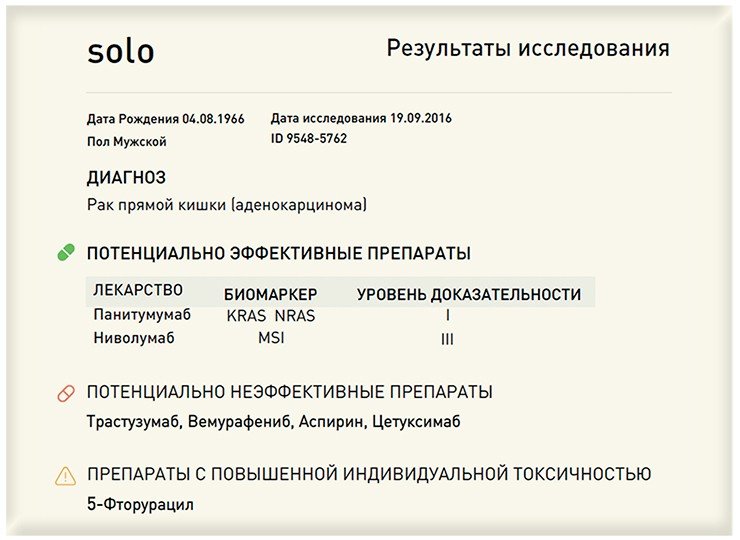
Биомедицинский холдинг «Атлас» предлагает тест Solo, позволяющий быстро выявить индивидуальные молекулярные особенности как первичных, так и метастазирующих опухолей, узнав о которых, лечащий врач сможет применить тот или иной препарат таргетной терапии, а значит, персонализировать лечение. Более того, такое молекулярное исследование позволит заранее оценить потенциальную эффективность более 50 препаратов до начала лечения, что поможет выиграть ценнейший ресурс в борьбе против рака – время.
Важно отметить, что для некоторых пациентов тест Solo не может быть рекомендован. Если после стандартного анализа об опухоли уже известно, какая именно терапия наиболее эффективна, и врач не стоит перед трудной проблемой выбора, то делать полное молекулярное исследование смысла нет. Однако тому же самому пациенту с «простой» опухолью исследование Solo может понадобиться позже, в случае рецидива. В «Атласе» полный цикл исследования, от получения послеоперационных заформалиненных тканевых блоков до выдачи результатов, занимает не больше трех недель. Врач и пациент получают подтверждение начального диагноза, описание набора мутаций, которые присутствуют в генах, определяющих опухолевую прогрессию, а также других биомаркеров потенциальной эффективности или, наоборот, неуспешности различных таргетных и традиционных химиотерапевтических средств с подробным обоснованием выводов и результатами всех проведенных анализов.
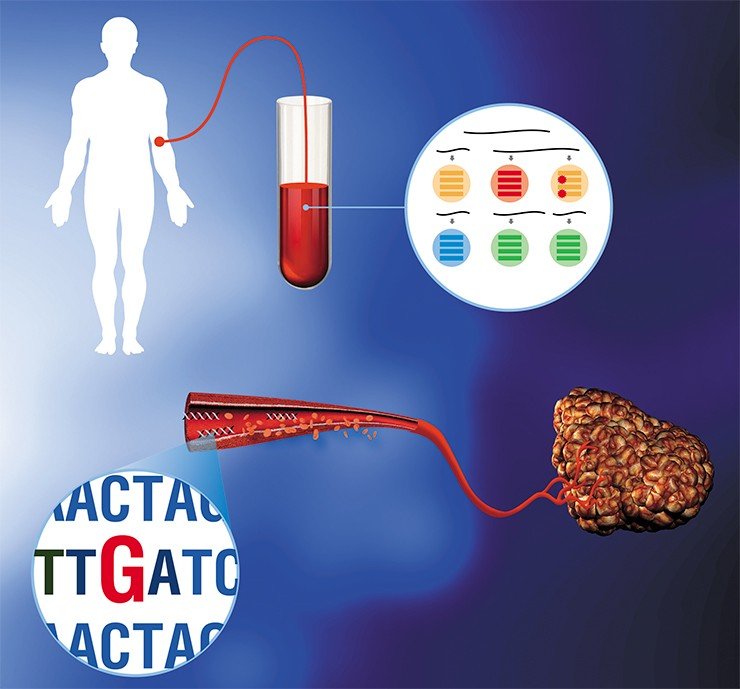
Но есть и еще более хорошие новости. В настоящее время команда «Атласа» полным ходом ведет работы по переводу той части теста Solo, что выявляет мутации в опухолевых клетках, с послеоперационных тканевых блоков на так называемую «жидкостную биопсию», представляющую собой простой забор крови из вены. Дело в том, что в крови человека имеется достаточно свободной, внеклеточной ДНК, попадающей туда из всех тканей нашего организма. При наличии опухоли внеклеточная ДНК содержит и фрагменты нуклеиновых кислот, секретируемых злокачественными клетками. При секвенировании внеклеточной ДНК эти ДНК-фрагменты «бросаются в глаза» именно потому, что содержат мутации, нехарактерные для нормальных клеток. Именно эти мутации и нужны молекулярным онкологам, чтобы определиться с выбором таргетного препарата.
Итак, в скором будущем больным для сбора биопсийного материала уже не надо будет обращаться к хирургу – достаточно будет простого визита к медсестре для сдачи крови.
Будем надеяться, что «точная» онкология получит широкое распространение и поможет если не победить рак, то хотя бы значительно облегчить жизнь больных, а также их родных и близких.
Литература
Ivanov M., Laktionov K., Breder V. et al. Towards standardization of next-generation sequencing of FFPE samples for clinical oncology: intrinsic obstacles and possible solutions // J Transl Med. 2017. V. 15. N. 1. P. 22.
Ivanov M., Baranova A., Butler T. et al. Non-random fragmentation patterns in circulating cell-free DNA reflect epigenetic regulation // BMC Genomics. 2015. V. 16 (Suppl. 13). S 1. P. 1—12.
Messerschmidt J. L., Bhattacharya P., Messerschmidt G. L. Cancer Clonal Theory, Immune Escape, and Their Evolving Roles in Cancer Multi-Agent Therapeutics // Curr Oncol Rep. 2017. V. 19. N. 10. P. 66.
Schallenberg S., Merkelbach-Bruse S., Buettner R. Lung cancer as a paradigm for precision oncology in solid tumours // Virchows Arch. 2017. [Epub ahead of print].
Amirouchene-Angelozzi N., Swanton C., Bardelli A. Tumor Evolution as a Therapeutic Target // Cancer Discov. 2017. [Epub ahead of print].
Sharma P.S., Sharma R., Tyagi T. Receptor tyrosine kinase inhibitors as potent weapons in war against cancers // Curr Pharm Des. 2009. V. 15. N. 7. P. 758–776.