ДНК на замке
ДНК – одно из главных богатств живой клетки, обеспечивающее ее бесперебойное функционирование. «Ремонтом» (репарацией) постоянно возникающих повреждений молекул ДНК занимаются специальные внутриклеточные системы репарации, в которых «работают» ансамбли особых белков-ферментов. Тем не менее, в каждый момент времени в клетках имеются десятки тысяч разнообразных повреждений ДНК, одного из которых зачастую достаточно для клеточной гибели.
Однако в случае злокачественных опухолей успешная работа систем репарации по исправлению повреждений ДНК, вызванных противораковой терапией, может свести на нет усилия врачей. Сибирские исследователи разработали новый метод детекции Ku-антигена – ключевого белка системы «ремонта» двухцепочечных разрывов ДНК, вызываемых в раковых клетках опухолей радиотерапией. Подобные исследования механизмов репарации ДНК имеют не только фундаментальное, но и большое практическое значение
На ДНК – основное хранилище генетической информации живых организмов – постоянно воздействуют разнообразные факторы химической и физической природы, такие как свободные радикалы, ультрафиолетовое излучение и т. п. В результате ДНК повреждается: происходит потеря и окисление азотистых оснований, сшивки внутри цепей ДНК и даже их разрывы.
Наиболее опасными повреждениями являются двухцепочечные разрывы. Поскольку ДНК представляет собой спираль, состоящую из двух комплементарных цепочек нуклеотидов, разрывы, возникающие в одной из цепей, как правило, не приводят к катастрофическим последствиям для клетки: вторая цепь содержит всю необходимую информацию для полного восстановления повреждения. Однако даже одиночный двухцепочечный разрыв может привести к гибели клетки, а неправильный «ремонт» такого повреждения – вызвать мутацию или потерю генетической информации. Когда же несколько таких повреждений возникает одновременно на небольшом расстоянии друг от друга, ДНК в прямом смысле разваливается на куски.
Опасными для жизни клеток могут оказаться и другие повреждения ДНК, в том случае, если они будут расположены по соседству. Это обусловлено тем, что процесс репарации большинства повреждений обязательно включает стадию разрыва цепи.
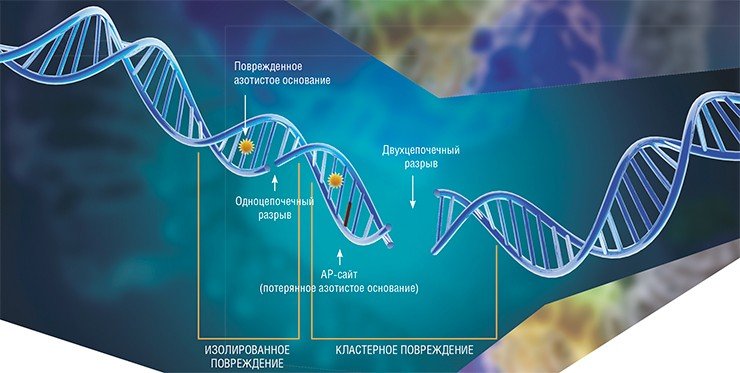
Формирование таких сгруппированных (кластерных) повреждений характерно для действия ионизирующего излучения – именно поэтому его применяют для уничтожения раковых клеток. Разные виды радиотерапии различаются по степени вызываемых ими нарушений структуры ДНК и спектрам образующихся повреждений, при этом наиболее чувствительными к действию ионизирующего излучения являются опухолевые клетки, которые делятся более активно, чем здоровые.
Однако такая противораковая терапия далеко не всегда оказывается эффективной, что зачастую объясняется высокой активностью клеточных белков, «ремонтирующих» двухцепочечные разрывы. И в этом смысле большой практический интерес представляют методы, с помощью которых можно было бы снижать активность клеточных «репаративных машин» и таким образом способствовать уничтожению клеток злокачественных опухолей.
Но для эффективного управления работой систем репарации («ремонта» ДНК) необходимо располагать точной информацией обо всех белках, участвующих в «ремонте» ДНК, в том числе об их количественном соотношении в клетке, а также их работе «по совместительству», т. е. участии в других клеточных процессах. Последнее крайне важно, поскольку можно нанести непоправимый вред организму в целом, подавляя клеточные системы репарации ДНК.
Вышесказанное в полной мере относится к «герою» нашего рассказа – Ku-антигену, белку с множеством талантов и сложной судьбой.
Ремонтируем ДНК
Чтобы понять функции и роль Ku-антигена, для начала нужно ознакомиться с двумя основными механизмами репарации двухцепочечных разрывов ДНК: гомологичной рекомбинацией и негомологичным соединением концов.
Первым способом «ремонтируются» в основном двухцепочечные разрывы, возникающие в активно делящейся клетке на тех фазах клеточного цикла, когда в ней уже синтезированы копии молекулы ДНК. Эти копии и используются в качестве матрицы для повторного синтеза ДНК в месте повреждения. Этот процесс, осуществляемый специальным ансамблем белков, происходит без потери или искажения генетической информации благодаря наличию неповрежденных молекул ДНК, идентичных исходным.
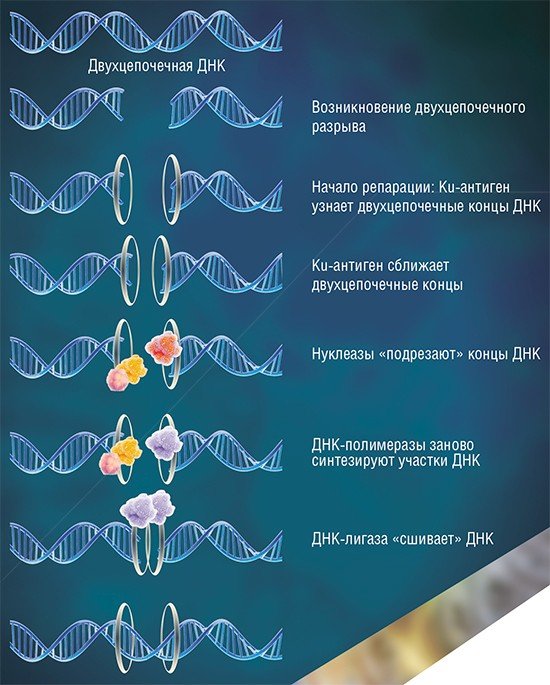
На других фазах клеточного цикла репарация ДНК идет путем негомологичного соединения концов при участии ансамбля белков, «первую скрипку» в котором и играет белок Ku-антиген (Davis et al., 2013). Такой путь репарации менее точен, но, как это ни парадоксально, именно он преобладает в клетках высших эукариотических организмов, к которым относится и человек.
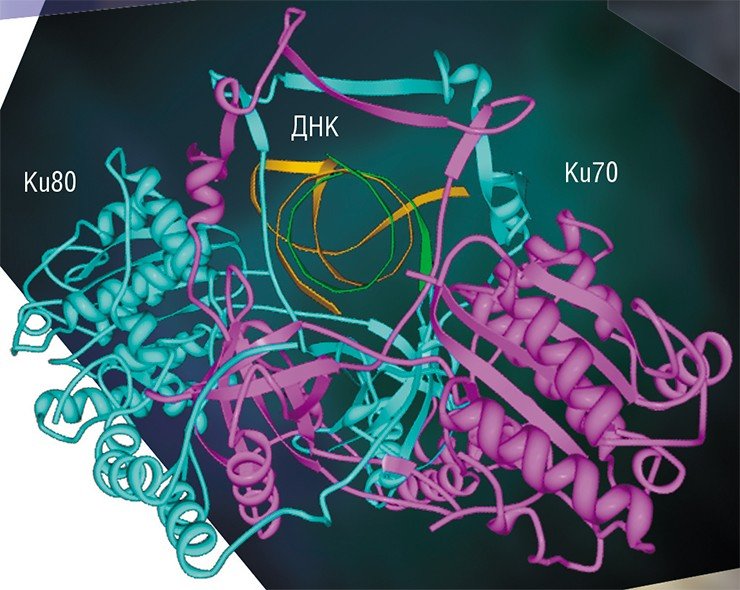
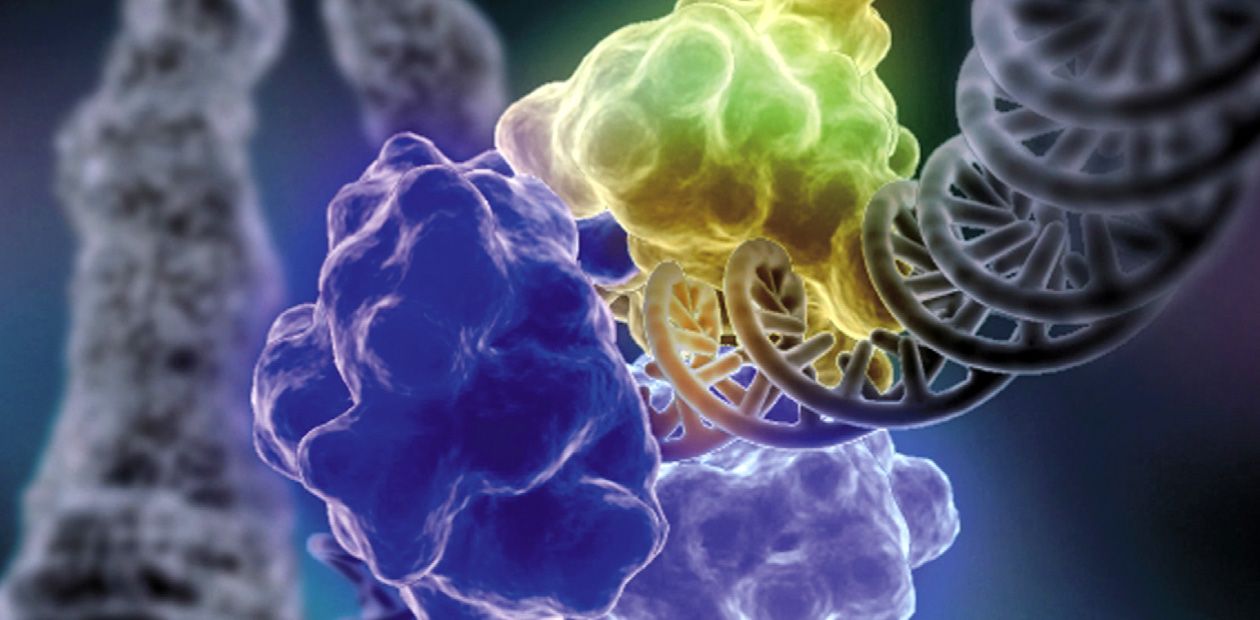
Ku-антиген участвует в первой стадии процесса репарации: он «узнает» концы двухцепочечных разрывов, сближает их и удерживает до восстановления исходной структуры ДНК. Структура самого Ku-антигена как нельзя лучше приспособлена для такой деятельности: она напоминает «висячий» замок с массивным телом и тонкой дужкой или плетеную корзинку с ручкой (Walker et al., 2001). Две молекулы Ku-антигена, «надетые» на концы молекулы ДНК, взаимодействуют друг с другом подобно двум половинкам магнитной застежки, надежно удерживающей на шее нитку бус.
Способ связывания Ku-антигена с ДНК по типу «бусина на нитке» позволяет белку беспрепятственно скользить по ДНК, что необходимо при функционировании белкового комплекса репарации. Напоминающая корзинку укладка субъединиц Ku-антигена открывает относительно свободный доступ других белков репарации к ДНК в области «ручки»; «тело» же корзинки служит платформой, на которой происходит сборка белков репарации вокруг повреждения.
Универсальный подход
Однако значение Ku-антигена для организма далеко не ограничивается его участием в процессе репарации ДНК. Поэтому неудивительно, что и открывали этот белок несколько раз при изучении разных процессов.
Впервые Ku-антиген был обнаружен у пациентов с аутоиммунными заболеваниями (полимиозитом, склеродермой, системной красной волчанкой) как белок-антиген, вызывающий выработку антител. Он был назван по первым буквам фамилии больного, у которого впервые были найдены такие антитела. Впоследствии антитела к Ku-антигену были найдены и у больных другими аутоиммунными заболеваниями, в частности, ревматоидным артритом.
Сначала было установлено, что Ku-антиген находится преимущественно в ядрах клеток, затем была обнаружена его способность взаимодействовать с ДНК. Потребовалось еще несколько лет, чтобы установить тот факт, что этот белок участвует в процессе репарации двухцепочечных разрывов ДНК. После этого открытия информация о роли Ku-антигена в различных клеточных процессах посыпалась как из рога изобилия.
Нужно отметить, что в некоторых случаях эта роль напрямую определяется его участием в процессе репарации ДНК. Речь идет об уникальном физиологическом процессе, происходящем на ранних этапах развития клеток иммунной системы и обеспечивающем организму так называемый врожденный клеточный иммунитет.
Дело в том, что участок гена, который кодирует вариабельную часть антител (или рецепторов), ответственную за узнавание антигена, в предшественниках клеток иммунной системы состоит из нескольких повторяющихся сегментов ДНК, принадлежащих к трем классам – V, D и J. Во время дифференцировки иммунных клеток благодаря процессу V(D)J-рекомбинации образуется популяция клеток, содержащих различные сочетания V-, D- и J-сегментов (по одному из каждого класса), что обеспечивает способность этих клеток распознавать различные антигены. Эти события, формирующие первичное разнообразие антител (рецепторов), происходят задолго до того, как организм «познакомится» с бактериями, вирусами и другими реальными патогенами. Так как рекомбинация подразумевает образование двухцепочечных разрывов в ДНК, Ku-антиген обеспечивает их репарацию. Соответственно, нарушение работы этого белка приводит к тяжелому комбинированному иммунодефициту.
Вот так, используя одну и ту же «машину», мудрая природа решает, казалось бы, совсем не связанные задачи.
Работник по совместительству
Помимо деятельности, непосредственно связанной с репарацией двухцепочечных разрывов ДНК, Ku-антиген также участвует в клеточных процессах, так или иначе связанных с поддержанием структуры ДНК.
Например, снижение его количества в клетке отрицательно влияет на процесс репликации, т. е. синтез дочерней молекулы ДНК; этот белок также способствует укладке хроматина в ядре в виде петель. Интересно, что хотя в этих двух случаях не происходит двухцепочечных разрывов ДНК, однако для них характерно легкое «плавление» (образование неспаренных участков) двойной спирали.
Ku-антиген участвует и в поддержании целостности теломер – концевых участков хромосом, имеющих особую структуру из повторяющихся последовательностей и защищенных специальными белками. С одной стороны, теломеры предотвращают «узнавание» концов хромосомы как двухцепочечного разрыва, подлежащего репарации. С другой стороны, в нормальных клетках при каждом делении теломеры укорачиваются. В этом смысле они служат своеобразными часами, отмеряя время жизни, отпущенное клетке. Однако в раковых клетках длина теломер остается постоянной, и эти клетки не утрачивают способность к делению.
Приведенные примеры демонстрируют роль Ku-антигена в сохранении и реализации генетической информации, но этим способности удивительного белка не исчерпываются. Так, совершенно неожиданно обнаружилось, что Ku-антиген может присутствовать не только в ядре, но и в цитоплазме клетки, где он функционирует независимо от ДНК.
Как известно, Ku-антиген состоит из двух отдельных субъединиц. Находящаяся в цитоплазме субъединица Ku70 участвует в ответе клетки на токсические воздействия, точнее – в регуляции апоптоза, генетически запрограммированной смерти клетки, наступающей в случае ее повреждения.
Действовать в этом случае Ku70 может двояко. С одной стороны, он может связывать цитоплазматический белок Bax, который участвует в митохондриальном апоптотическом пути. «Спусковым крючком» для запуска процесса самоуничтожения клетки в данном случае является перемещение Bax в митохондрии, и Ku70, блокируя этот белок, предотвращает апоптоз.
С другой стороны, Ku70 способен удалять с Bax присоединенные к нему молекулы убиквитина, небольшого клеточного белка, служащего для белковой молекулы своеобразной «меткой смерти». Таким образом, Ku70 продляет жизнь «приговоренной» молекулы Bax, способствуя запуску апоптоза.
Нужно заметить, что многие раковые клетки обладают способностью «ускользать» от выполнения программы самоуничтожения, что говорит о необходимости уделять пристальное внимание деятельности Ku-антигена в опухолевых клетках.
Но и на этом все сюрпризы нашего белка не заканчиваются. Оказалось, что Ku-антиген может присутствовать и на внешней поверхности клетки, где он связывается с ее цитоплазматической мембраной. Как это ни удивительно, но там он исполняет роль «пятой колонны», помогая некоторым бактериям и вирусам проникать в клетку (Martinez et al., 2005, Munakata et al., 2005).
Кроме того, Ku-антиген отвечает за «прилипание» клеток друг к другу и межклеточному матриксу, сово-купности внеклеточных белков, поддерживающей структуру биологической ткани (Muller et al., 2005). Ku-антиген, расположенный на внешней стороне мембраны, участвует также в миграции клеток, помогая специальной протеазе (ферменту, разрушающему белки) «прогрызать» для клетки путь, частично разрушая межклеточный матрикс (Muller et al., 2005). И вот этот «талант» Ku-антигена может сослужить недобрую службу организму в случае онкозаболевания, способствуя распространению метастазов.
Все хорошо в меру
Учитывая все разнообразие функций Ku-антигена, можно утверждать, что и повышенное, и пониженное содержание этого белка может быть значимым фактором, влияющим на функционирование раковых клеток.
Например, клетки одного из видов опухолей – множественной миеломы, вместо нормальной субъединицы Ku80 содержат в высокой концентрации укороченный вариант – Ku80v. Такой полипептид способен нормально взаимодействовать со второй субъединицей (Ku70), а образовавшийся димер – с двухцепочечными концами ДНК. Однако такая «ущербная» форма Ku-антигена не может связывать каталитическую субъединицу ДНК-зависимой протеинкиназы, что приводит к блокированию начальных стадий репарации двухцепочечных разрывов ДНК.
Напротив, в клетках другой опухоли – В-клеточной хронической лимфоидной лейкемии, содержание нормальной формы Ku-антигена повышено, что приводит к усилению процессов репарации ДНК. В результате устойчивость этих раковых клеток к ионизирующему излучению и другим генотоксическим агентам повышается, и противоопухолевая терапия становится неэффективной.
Эти примеры убедительно показывают необходимость точного определения статуса Ku-антигена в клетках. Для этого на сегодня имеется несколько подходов.
Как известно, для определения уровня экспрессии, т. е. преобразования наследственной информации какого-либо гена в функциональный продукт – РНК или белок, в клинической практике и научных лабораториях чаще всего используют полимеразную цепную реакцию (ПЦР) в реальном времени. Ее идея заключается в выделении из клеток матричной РНК, в которой «записана» инструкция по синтезу конкретного белка. Последнюю затем используют в качестве матрицы для «обратного» синтеза соответствующей последовательности ДНК. Получившуюся этим способом ДНК можно затем многократно копировать.
Ученые придумали и реализовали несколько хитроумных вариантов такого «размножения» ДНК, однако даже самый изощренный способ позволяет лишь судить о наличии или отсутствии искомой последовательности ДНК (а следовательно, и соответствующего белка) в анализируемом материале. Оценить количество активного белка в клетке таким способом достаточно затруднительно. Кроме того, с помощью ПЦР невозможно установить факт наличия укороченной формы Ku80v, так как она первоначально синтезируется по той же матрице РНК, что и обычная, и лишь затем от нее отщепляется «лишний» фрагмент.
Помимо ПЦР для определения уровня белков широко применяются разновидности иммуноферментного анализа, который основан на использовании антител, специфически взаимодействующих с определенным участком целевого белка. Для этого требуются два вида антител: первичные и вторичные.
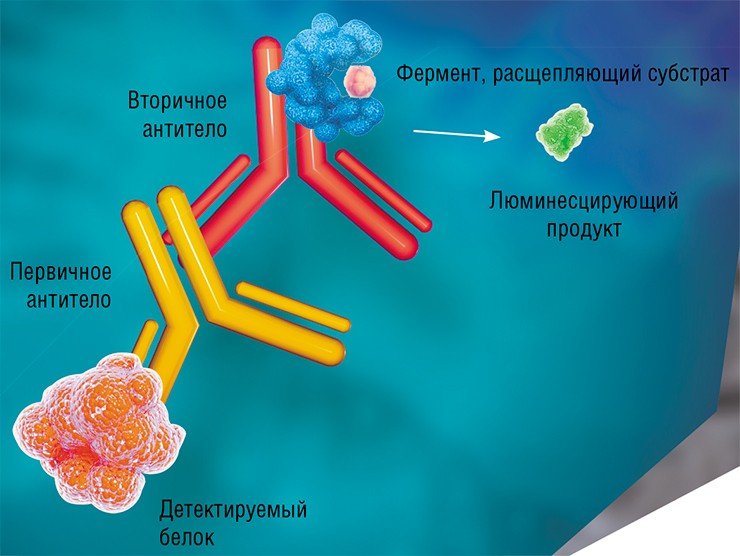
Для получения первичных антител используются лабораторные животные (чаще всего кролики или мыши), которые и нарабатывают на введенный им чужеродный белок соответствующие антитела. С использованием другого вида животных получают вторичные антитела, задача которых – узнавать первичные. К таким вторичным антителам присоединяют фермент, который способен расщеплять определенный субстрат с выделением люминесцирующего продукта.
При иммуноферментном анализе «в пробирке» происходит цепочка взаимодействий «целевой белок – первичное антитело – вторичное антитело». Результатом ее служит люминесценция, по наличию которой и детектируется белок.
Поскольку антитела взаимодействуют с одним конкретным участком белка, такой метод позволяет различить разные по длине субъединицы Ku80. Для этого нужно использовать два вида первичных антител, один из которых будет связываться с участком, имеющимся в обоих вариантах полипептида, а другой – только в полноразмерном.
На рабочем месте
Все вышеупомянутые методы позволяют детектировать Ku-антиген либо косвенно (в случае ПЦР), либо в отрыве от его клеточных функций. Поэтому в лаборатории биоорганической химии ферментов Института химической биологии и фундаментальной медицины СО РАН (Новосибирск) был разработан принципиально иной способ детекции Ku-антигена прямо на его «рабочем месте» – на молекуле ДНК (Ilina et al., 2010).
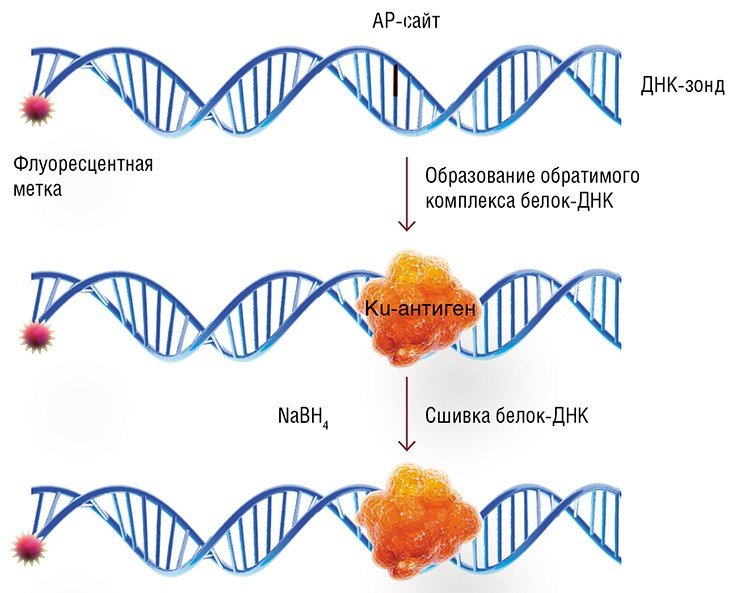
Метод основан на способности Ku-антигена взаимодействовать с AP-сайтами, т. е. участками ДНК, где были потеряны азотистые основания. Эти «пробелы» в «тексте» ДНК являются одними из наиболее распространенных ее повреждений. Ku-антиген может связываться с ДНК, содержащей AP-сайты, предохраняя эти участки от расщепления (Ilina et al., 2008). Если же на небольшом расстоянии от AP-сайтов находится двухцепочечный разрыв, то Ku-антиген расщепляет их, тем самым участвуя в «зачистке» концов разрыва и подготовке его к «ремонту» (Roberts et al., 2010).
Разработанный новосибирскими исследователями метод определения Ku-антигена предусматривает использование ДНК-зонда, содержащего AP-сайт и снабженного радиоактивной или флуоресцентной меткой. Связываясь с такой ДНК, Ku-антиген образует с ней нестабильный ковалентный комплекс. После специальной обработки такого комплекса Ku-антиген необратимо «сшивается» с ДНК, которая в данном случае играет роль «этикетки». Благодаря метке на ДНК-зонде можно надежно и с высокой чувствительностью регистрировать получившиеся продукты и даже определять их количество.
Главное преимущество этого подхода состоит в том, что с его помощью определяются все активные формы Ku-антигена, способные связываться с ДНК, в том числе и его укороченный вариант. К тому же новый метод проще и дешевле по сравнению с обычным иммуноферментным анализом.
Кu-антиген является ключевым белком для обеспечения активности системы репарации двухцепочечных разрывов ДНК, которые в значительных количествах возникают при радиотерапии опухолей: в этом смысле его уровень можно рассматривать как важный прогностический фактор при определении эффективности и целесообразности этого метода лечения.
Новый метод детекции Ku-антигена, предложенный новосибирскими исследователями, позволяет оценить уровень активного белка в раковых клетках и может быть использован в прогностических целях наряду с широко используемым в настоящее время методом ПЦР.
Работа по изучению свойств Ku-антигена продолжается, и связана она с изучением способности этого белка взаимодействовать уже не с одиночными, а со сложными кластерными повреждениями (Kosova et al., 2014). Есть надежда, что в недалеком будущем мы сможем не только узнать много нового о функциях этого удивительного белка, но и использовать это знание в прикладных целях.
Литература
Ходырева С. Н., Лаврик О. И. Как клетка ремонтирует ДНК // Наука из первых рук. 2007. № 3. С. 82—89.
Davis A. J., Chen D. J. DNA double strand break repair via non-homologous end-joining // Transl. Cancer Res. 2013. V. 2. P. 130–143.
Ilina E. S., Lavrik O. I., Khodyreva S. N. Ku antigen interacts with abasic sites // Biochem. Biophys. Acta. 2008. V. 1784. P. 1777–1785.
Ilina E. S., Khodyreva S. N., Berezhnoy A.E. et al. Tracking Ku antigen levels in cell extracts with DNA containing abasic sites // Mutat. Res. 2010. V. 685. P. 90–96.
Walker J. R., Corpina R. A., Goldberg J. Structure of the Ku heterodimer bound to DNA and its implications for double-strand break repair // Nature. 2001. V. 412. P. 607–614.
Работа выполнена при поддержке РФФИ (проект № 13-04-01426) и программы РАН «Молекулярная и клеточная биология»