Член-корреспондент РАН Ольга Лаврик:
«…надеюсь, что теперь эта важнейшая область исследований будет замечена в России»
Об истории и перспективах исследований механизмов репарации ДНК – основного наследственного материала живой клетки – направления, отмеченного Нобелевской премией по химии в 2015 г., о работах нобелевских лауреатов, проблемах и достижениях отечественных ученых рассказала в своем интервью журналу «НАУКА из первых рук» Ольга Ивановна Лаврик, член-корреспондент РАН, доктор химических наук, профессор Новосибирского государственного университета, заведующая лабораторией биоорганической химии ферментов Института химической биологии и фундаментальной медицины СО РАН (Новосибирск)
В этом году Нобелевская премия по химии была присуждена за открытие ключевых механизмов репарации, благодаря которым сохраняется стабильность нашей генетической программы, по которой развивается любая клетка и весь организм в целом. Это очень радостное и долгожданное событие для всех нас, кто работает в этой области. Решению о присуждении премии предшествовало тревожное ожидание из-за серьезной конкуренции – это я знаю наверняка, так как знакома с лауреатами и некоторыми другими претендовавшими на премию кандидатами, т. е. – претендентов на награду было гораздо больше, чем мест. Однако следует признать, что премию получили достойные ученые, которые действительно открыли основные механизмы репарации ДНК, и, как часто это бывает с присуждением премий, эти открытия сделаны уже давно.
Один из лауреатов – английский ученый Томас Линдал, совершенно выдающийся человек и ученый – он первым отметил химическую нестабильность структуры дезоксирибонуклеиновой кислоты (ДНК), хотя раньше нестабильной считалась рибонуклеиновая кислота (РНК), но не ДНК. Кстати, о том, так ли стабильна ДНК, как это принято считать, Линдал задумался, прочитав книгу российских ученых Э. И. Будовского и Н. К. Кочеткова, вышедшую в 1970-х гг. и переведенную на английский язык (это было время, когда у нас издавались прекрасные учебники и книги по химии нуклеиновых кислот). И, размышляя об этом, он понял, что, конечно, в ДНК могут разрушаться химические связи между азотистым основанием и сахарофосфатным остовом благодаря воздействию кислородных радикалов, формирующихся в результате постоянно идущего в организме оксидативного стресса. Так, еще в 1970-е гг. Линдал совершил чисто теоретическое открытие, и эта догадка привела к тому, что он стал искать ферменты, которые могут исправлять повреждения в ДНК. И действительно, такие ферменты, которые могли бы удалять поврежденные азотистые основания и выполнять необходимый «ремонт», были в итоге найдены.
Второй лауреат – американский ученый Пол Модрич, сейчас работающий в Университете Дьюка (США). Модрич открыл очень важный механизм репарации, исправляющий ошибки, образующиеся в процессе репликации (удвоения) ДНК. Этот процесс осуществляется ферментами ДНК-полимеразами, которые достраивают комплементарные цепочки нуклеотидов на основе имеющейся в клетке ДНК. При этом они совершают множество ошибок, включая в ДНК не те «буквы» генетического кода. Но, как выяснилось, существует механизм, который удаляет из ДНК ошибочно введенные азотистые основания, это явление называется мисматч-репарация (от англ. mismatch).
Отремонтировать такие ошибочные азотистые основания гораздо сложнее, чем большие повреждения ДНК, потому что в этом случае сама «буква» является природным основанием, но в силу ее ошибочной позиции нарушается характер комплементарных связей в двойной спирали ДНК. Поиск ошибочно введенных азотистых оснований ведут определенные белки, которые открыл и описал Модрич. Кстати, их число в организме оказалось невелико, что свидетельствует о том, что эти ошибки в ДНК, может быть, не обязательно интенсивно исправлять. Это как две стороны одной медали: с одной стороны, появление и закрепление в ДНК таких точечных мутаций может приводить к болезням, а с другой – эти генетические «ошибки» являются движущей силой эволюции!
Третий нобелевский лауреат – Азиз Санджар, американский ученый турецкого происхождения, но давно работающий в США, открыл систему репарации, которая удаляет объемные повреждения в ДНК, индуцируемые ультрафиолетовым облучением. Правда он сделал это открытие для бактерий, однако позже аналогичные системы были открыты и у человека (за эти открытия Нобелевскую премию, к сожалению, не вручили, хотя в числе претендентов был наш коллега Фил Ханавальд из Университета Стэнфорда, за которого я «болела»).
Но нужно отдать должное Санджару – премию он получил заслуженно. Это человек, который всю жизнь занимался только наукой – сам, своими руками делал значительную часть экспериментов при открытии этих механизмов, и я думаю, что он до сих пор работает «у лабораторного стола». Он практически не появлялся на научных конференциях, считая, что они отнимают слишком много времени. Никогда не руководил большими коллективами – не любил вещи, отвлекающие от самого научного исследования. Я к такой позиции отношусь с огромной симпатией, хотя судя по рассказам его бывших сотрудников, работать с таким требовательным человеком было очень непросто.
Системы удаления объемных повреждений ДНК очень важны: есть люди, которые очень чувствительны к солнечному свету: при повреждении генов белков системы репарации под действием ультрафиолета развивается болезнь, которая называется xeroderma pigmentosum (пигментная ксеродерма). Кроме того, объемные повреждения могут возникать под действием мутагенов окружающей среды, таких как, например, бензпирен, который попадает в легкие при курении или вдыхании выхлопных газов. Фактически эта система репарации работает с повреждениями, возникающими из-за плохой экологии.
В арсенал медицины
В этом году премия по химии была вручена за фундаментальные открытия в области исследований механизмов репарации ДНК. Но могу предсказать, что в будущем Нобелевскую премию по медицине получат исследования систем репарации ДНК у человека, посвященные прикладным аспектам применения этих фундаментальных работ.
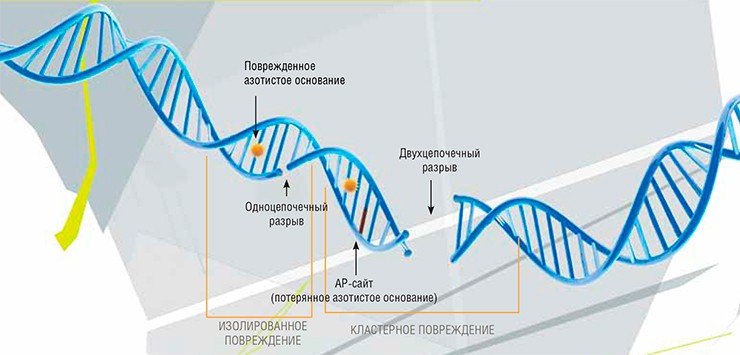
Я всегда говорю о том, что нельзя предсказать заранее, какой фундаментальный результат на следующем этапе станет лидером прикладных исследований. Поэтому так не люблю разговоры о том, что нужно сразу моделировать лекарство, без всяких экспериментов. Это абсолютно неправильный подход, и я с этим борюсь, рассказываю студентам на лекциях и в лаборатории, что это просто пиар, который создается вокруг науки.
Если люди не хотят заниматься фундаментальными исследованиями, они могут стать шарлатанами, а это страшно опасно. Опасны лозунги, которые мы слышим даже от Министерства науки, что нужно финансировать именно прикладные исследования. Но как можно получить результат, перескакивая через этап фундаментальных работ? Это означает, что мы будем покупать технологии за рубежом. Ведь даже в такой прикладной области, как биотехнология, очень много и фундаментальных задач, которые необходимо решить, прежде чем вы получите эффективную «таблетку».
Такое неправильное понимание, к сожалению, встречается и у руководителей науки. Это особенно опасно сейчас, в период реформы, когда чиновники оттеснили Академию наук от разработки программ финансирования науки. Ведь людям, которые распределяют деньги, хочется быстрого, немедленного результата. Но такого в науке не бывает. Зато может появится много людей, которые, чтобы получить финансирование, будут выдавать желаемое за действительное, а это очень опасно.
И я это уже наблюдаю, особенно в университетах. Речь не идет о таких выдающихся образовательных учреждениях, как МГУ, НГУ, СПбГУ или других, с традиционно сильной наукой, которая сдерживает пиарные устремления. Но есть и другие примеры – университеты, где наука находится на стадии развития и которым выдают деньги просто под пиар-акции. Фактически там нет ученых, которые могут правильно воспользоваться этими средствами. Думаю, что такое финансирование будет приводить лишь к перераспределению и потере средств и, в итоге к отставанию российской науки.
Это очень опасная тенденция, просто катастрофа, и, вероятно, о подобных вещах надо больше писать в СМИ. Мне очень жалко молодых людей, которые могут быть, привлечены в науку пиар-акциями. И я опасаюсь, что сегодня для нашей страны это типичная ситуация.
К сожалению, идущая сейчас реформа науки погубит очень многое. Вижу, как некоторые директора институтов меняют ориентиры. Им приходится считаться с ФАНО и даже говорить, задыхаясь под кучей бумаг из ФАНО, что там сидят «такие разумные люди»… Но я не понимаю, откуда возьмется этот «разум», если эти чиновники никогда в науке не работали и не знают эту область. Я много езжу, сотрудничаю с зарубежными лабораториями, но такой бюрократии, как теперь у нас, не видела нигде.
Сегодня за рубежом наука фактически организована таким образом, что лидерами в науке являются ученые-заведующие лабораториями. Когда начинали реформу то был лозунг все организовать как в западных лабораториях, а на деле мы движемся к чиновничьей централизации. Сейчас над каждым директором института стоит всевластный чиновничий орган. Нигде в мире такой системы нет, и вряд ли это тот путь, который будет способствовать развитию науки в России.
Исследования механизмов репарации имеют прямое отношение к медицине. Так, сегодня мы знаем, что мутации в генах белков репарации приводят к нейродегенеративным заболеваниям. Предполагают, что и в возникновение болезни Альцгеймера тоже вовлечены повреждения ДНК и нарушения работы систем репарации. Выше мы уже говорили о пигментной ксеродерме, развивающейся при повреждении генов белков репарации, отвечающих за удаление повреждений, возникающих под действием ультрафиолета.
И, конечно, «поломки» систем репарации имеют совершенно прямое отношение к бичу человечества – онкологическим заболеваниям. Доказано, что мутации в генах, кодирующих белки мисматч-репарации, ответственны за рак прямой кишки; многие мутации ферментов репарации ДНК-гликозилаз ответственны за рак легкого.
Кроме того, при лечении рака стремятся разрушить структуру ДНК опухолевых клеток с помощью химиотерапии или ионизирующей радиации, создающей разрывы в ДНК. Но системы репарации активно сопротивляются этим повреждениям и исправляют их. Поэтому необходимо в ходе терапии использовать еще и ингибиторы систем репарации. И такие препараты сейчас уже существуют (например, олапариб).
Надо сказать, что существуют разные идеи о том, какими должны быть ингибиторы систем репарации. Сначала думали, что нужно подавить «универсальный» белок-регулятор, действующий одновременно на несколько систем, но в последние годы ученые склоняются к тому, что нужно выбирать уникальные мишени для препаратов, т. е. понимать, что именно сломалось, и бить по этой специфической мишени.
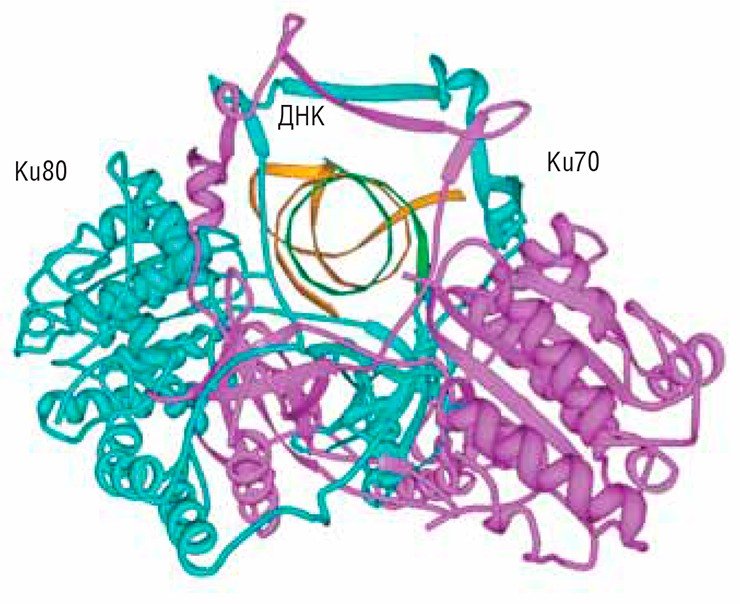
Сложность состоит в том, что даже при одинаковой форме рака у разных пациентов лечение может отличаться. Этот факт хорошо демонстрирует следующий пример одного из наших исследований на опухолевых клетках, взятых от больных меланомой. Нас интересовала в этих клетках экспрессия белка Ku-антигена – центрального звена системы репарации двойных разрывов в ДНК. Выяснилось, что если экспрессия Ku-антигена в клетках опухоли высока, то повреждения ДНК, вызванные в них радиотерапией, будут восстанавливаться, и необходимо увеличивать дозы. Но увеличение дозы будет приводить к гибели и здоровых клеток – это колоссальная проблема: таким больным даже рекомендуется менять стратегию лечения и применять не радио-, а химиотерапию. Были у нас и клетки больных, которые хорошо реагировали на радиотерапию, и оказалось, что в клетках этих больных структура Ku-антигена повреждена. Это может быть нехорошо для здорового организма, но при лечении рака такое повреждение Кu-антигена играет позитивную роль. Кроме того, выяснилось, что система репарации, которая удаляет объемные повреждения, вызванные химиотерапией, очень активно работает в метастазирующих раковых клетках, поэтому так трудно лечить метастазы.
Сибирский подход
В России исследования систем репарации ДНК сейчас сосредоточены у нас, в Институте химической биологии и фундаментальной медицины СО РАН. И когда пришло известие о присуждении Нобелевской премии в этой области, все центральные информационные агентства, по рекомендации московских ученых, звонили именно нам. Это стало своеобразным признанием того, что главный отечественный центр исследований систем репарации находится в Сибири.
В нашем институте этой тематикой помимо нашей лаборатории занимаются еще лаборатории под руководством д. б. н. Д. О. Жаркова, д. х. н. О. С. Федоровой. Мы активно сотрудничаем, а свои усилия распределили по разным объектам исследования. Например, лаборатория Жаркова занимается этапом узнавания повреждений ДНК ферментами ДНК-гликозилазами, а лаборатория профессора Федоровой – тонкими кинетическими аспектами этого динамического процесса (в прошлом году за эти работы молодой сотрудник лаборатории к. х. н. Н. А. Кузнецов получил Премию Президента РФ).
Моя лаборатория занимается исследованием «процессинга» – процесса исправления повреждений ДНК вплоть до полного восстановления ее структуры. Кроме того, мы изучаем репарацию объемных повреждений, возникающих под действием ультрафиолета и химических мутагенов, а также разрабатываем ингибиторы систем репарации для лечения рака. В Сибири для этого есть все условия – мы сотрудничаем с нашей alma mater, Новосибирским институтом органической химии СО РАН, на базе которого в свое время и был организован наш институт.
Конкретно мы работаем с отделом медицинской химии, возглавляемым д. х. н., профессором Н. Ф. Салахутдиновым. У них самая крупная в России «библиотека» различных природных соединений, которые они могут модифицировать; мы же, со своей стороны, проводим испытания этих соединений. Сейчас стадию доклинических испытаний проходят ингибиторы ферментов репарации, чья эффективность превышает мировые аналоги.
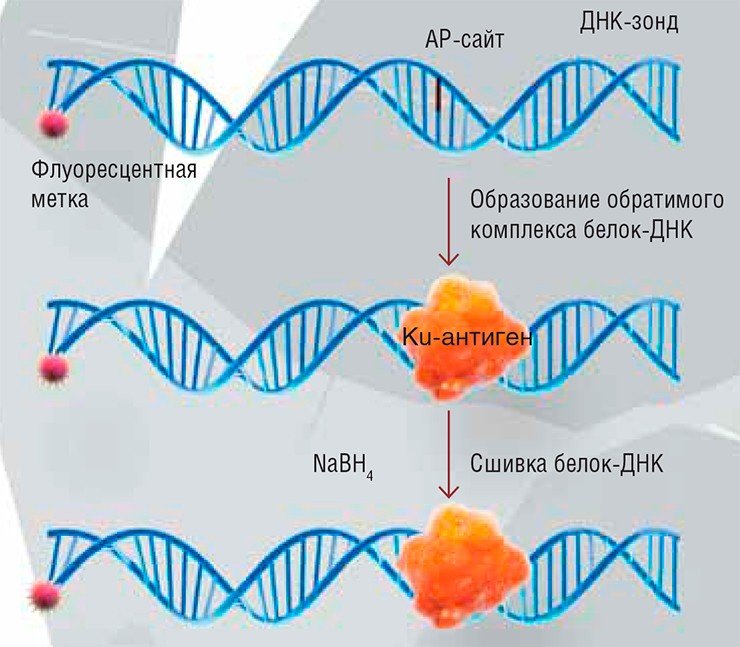
Начинали мы эту работу в рамках интеграционных проектов Сибирского отделения РАН. Мультидисциплинарные исследования вообще характерны для нашей области. Например, сейчас мы сотрудничаем с лабораторией чл.-кор. РАН О. А. Донцовой из МГУ и лабораторией из Новой Зеландии, где занимаются компьютерным моделированием. В лаборатории Донцовой занимаются еще одной важнейшей системой обеспечения стабильности клеточного генома – ферментом теломеразой, которая, фактически, определяет время жизни клетки. Теломеры – это концевые участки хромосом, которые укорачиваются при каждом делении клетки; чем короче теломеры, тем ближе клетка подходит к так называемому пределу Хейфлика, когда она теряет способность делиться. У раковых клеток теломераза «пришивает» новые нуклеотиды к концевым участкам молекул ДНК и, соответственно, удлиняет теломеры, делая раковые клетки фактически бессмертными.
Мы хотим посмотреть, как взаимодействуют системы репарации и система теломеразы, потому что субстрат для теломеразы фактически является и субстратом для системы репарации, хотя в клетке существуют механизмы, которые делают так, чтобы системы репарации на него не претендовали. Эти две системы, безусловно, определенным образом сопряжены, и уже известны общие для них регуляторы.
В лаборатории Донцовой развиты разнообразные физические методы, такие как иммунофлюоресцентная микроскопия (они исследуют компоненты системы теломераз на уровне клетки), мы этими методами владеем в меньшей степени. Я думаю, что такое исследование – на стыке двух серьезных механизмов регуляции стабильности клеточного генома – очень перспективно, и мы надеемся, что эта программа, которая поддерживается грантом РФФИ, продолжится. Здесь может быть и практическое применение, потому что разработка ингибиторов теломеразы тоже актуальна для онкологии.
Исследование механизмов репарации ДНК – это современная, бурно развивающаяся область молекулярной биологии, где многое уже открыто, однако установить какой-то конкретный механизм репарации – это не значит описать полностью работу всей системы в клетке, которая очень сложна и таит еще немало загадок.
Мы очень надеемся, что в связи с тем, что весь мир обратил внимание на механизмы репарации ДНК, что-то положительное произойдет и в России. Мы много раз пытались показать, насколько важными являются наши исследования для лечения серьезных заболеваний человека и говорили о необходимости создания в СО РАН отдельной программы для исследования систем репарации. Конечно, пока есть гранты РНФ, но хотелось бы иметь отдельную, хорошо финансируемую программу. Остается надеяться, что теперь нашей мечте суждено осуществиться. Поскольку область исследования репарации ДНК тесно связана с медициной, хотелось бы, чтобы фундаментальные исследования поддерживались и соответствующими медицинскими программами.
Литература
Жарков Д. О. Часовые генома // НАУКА из первых рук. 2009. № 4 (28). С. 160—169.
Косова А. А., Лаврик О. И., Ходырева С. Н. «ДНК на замке» // НАУКА из первых рук. 2014 № 5/6 (53/54). С. 14—21.
Лаврик О. И. Как клетка ремонтирует ДНК // НАУКА из первых рук. 2007. № 3 (15). С. 82—89.