Лекарства от старения, и Где они обитают
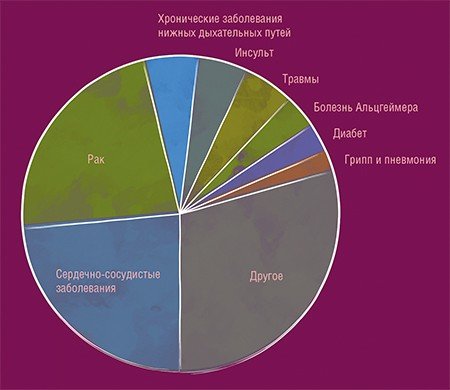
Время напрямую людей не убивает, старение – это биологический процесс. Есть группа заболеваний, которые называют возраст-ассоциированными, или старческими. Основным фактором риска их развития является возраст, и они составляют значительную долю среди причин смертности. Это инсульты, инфаркты, онкологические заболевания, болезнь Альцгеймера, диабет 2-го типа... Именно эти болезни убивают нас. Ученые, работающие в области биологии старения, ищут, что их объединяет, единый механизм, если, конечно, он существует
Я хотел бы поговорить о том, существуют ли на самом деле какие-то успехи в деле «героической» борьбы со старением. СМИ нам время от времени сообщают, что ученые открыли ген старения, но таблеток от старости в аптеках все еще нет. Хотелось бы знать, как обстоят дела на самом деле. Для этого надо определиться, что мы считаем успехом в борьбе со старением. Чтобы люди жили до ста лет? Или до ста пятидесяти? Тогда можно будет говорить об успехе или еще нет?
Надо понимать, что биология старения – тема очень ажиотажная, и это обоюдоострое лезвие, потому что любые разговоры на эту тему легко продать как в буквальном, так и в переносном смысле. Эта тематика требует от ученых, с одной стороны, корректности и сдержанного оптимизма, а с другой – способности не бросаться в крайности в своих представлениях. Существуют две противоположные точки зрения. Одна состоит в том, что со старением вообще ничего нельзя сделать: как на роду (в генах) написано, так оно и будет. Другая подразумевает, что бессмертие должно наступить буквально на днях. Последним пользуются некоторые фармакологические компании, которые начинают продавать баночки с «лекарством от старости». Но если бы где-то в секретных лабораториях стояла баночка с таким лекарством, то мы бы уже жили в другом мире.
Где ищут «лекарства от старости»?
Одно из очевидных направлений поисков средств борьбы со старением – заменять органы, которые в процессе старения приходят в упадок, на новые, специально выращенные. Сейчас уже более-менее понятно, в каком направлении двигаться, чтобы этого достичь. Существуют методики, позволяющие перепрограммировать специализированные, терминально дифференцированные клетки в индуцированные плюрипотентные стволовые клетки (ИПСК), которые затем можно направленно превращать почти во все типы клеток. Можно взять у пожилого пациента его же собственные клетки, превратить их в ИПСК, в ходе чего они помимо прочих теряют черты, свойственные старческим клеткам (иногда употребляют термин «омолаживаются», но его рекомендуют избегать). Далее можно из них вырастить «молодой» орган или, по крайней мере, «молодую» ткань и пересадить ее пациенту.
Одна из проблем метода в том, что это тактическое отступление, имеющее смысл только до тех пор, пока речь не заходит о мозге: ведь его так просто не заменить. Вторая проблема в том, что клетки, имеющие свойства молодых, оказавшись в окружении старческих клеток, сами приобретают фенотип (молекулярные маркеры) старческих клеток (Acosta et al., 2013). Таким образом, выращенный и пересаженный молодой орган недолго пробудет молодым.
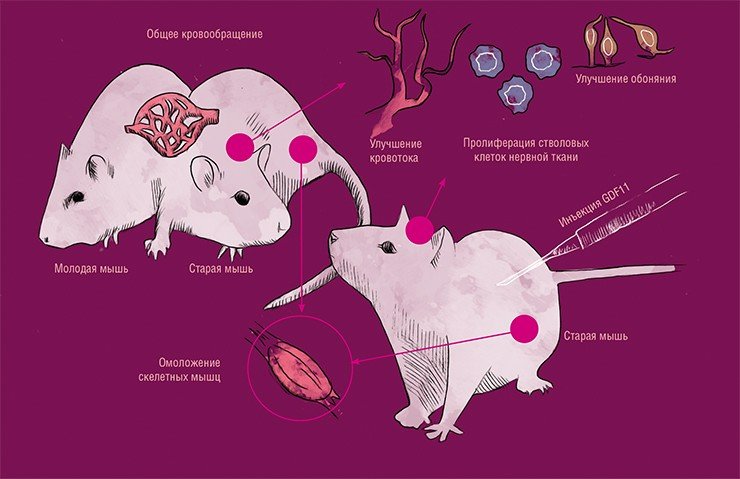
Уже довольно давно существуют методики, позволяющие перепрограммировать специализированные, терминально дифференцированные клетки в индуцированные плюрипотентные стволовые клетки, которые могут дифференцироваться почти во все типы клеток. Для этого в них с помощью вирусных векторов вводят гены, кодирующие регуляторные молекулы, характерные для плюрипотентных клеток. Но подсадка человеку таких клеток связана с высоким риском развития злокачественной опухоли, а использование вирусных векторов в клинической практике не одобрено в связи с тяжелыми осложнениями, развившимися в клинических испытаниях этой методикиОднако этот эффект работает и в обратную сторону: старые клетки, оказавшись среди молодых, приобретают уже их свойства! Чтобы понять, как это происходит, и, возможно, воспроизвести этот эффект, нужно найти молекулярный субстрат «узнавания» клетками «молодого» или «старого» клеточного окружения. Этим субстратом, вероятно, являются какие-то сигнальные молекулы. Результаты экспериментов с использованием парабиоза, искусственного соединения мышей через кровеносную систему, в результате чего мышечные и нервные ткани старых мышей «омолодились», выявили и предполагаемого кандидата на место посредника этого эффекта. Им оказался белок GDF11 (фактор роста и дифференцировки 11), выделенный из крови молодых мышей (Sinha et al., 2014). Правда, эти работы впоследствии подверглись критике, которая состояла в том, что GDF11 – сопутствующая находка, и поэтому исследования до сих пор продолжаются (Reardon, 2015). Но я полагаю, что обнаружить истинного посредника или посредников – только вопрос времени.
 Другое стратегическое направление борьбы со старением – попытки влиять непосредственно на его механизмы, изменяя регуляцию обмена питательных веществ и энергии. В качестве субстратов влияния можно назвать гормон роста, который управляет ростом ткани, а также инсулиноподобный фактор роста – молекулу, похожую на гормон инсулин, необходимый для регуляции обмена глюкозы, но имеющую широкий спектр действия на процессы роста и развития клеток.
Другое стратегическое направление борьбы со старением – попытки влиять непосредственно на его механизмы, изменяя регуляцию обмена питательных веществ и энергии. В качестве субстратов влияния можно назвать гормон роста, который управляет ростом ткани, а также инсулиноподобный фактор роста – молекулу, похожую на гормон инсулин, необходимый для регуляции обмена глюкозы, но имеющую широкий спектр действия на процессы роста и развития клеток.
Молекулярные системы, о которых идет речь, «принимают решения» о том, насколько активно клетки должны расти, делиться, использовать энергию. И, хотя это кажется неочевидным, в ходе старения такие системы начинают работать не слабее, а сильнее, но при этом неэффективно (Blagosklonny, 2010). В результате большинство потенциальных средств, изменяющих работу этих систем, направлены на их подавление. Например, к ним относится антибиотик и иммунодепрессант рапамицин, ингибирующий так называемый сигнальный путь киназы mTOR, участвующей в синтетических процессах в клетке и активируемой аминокислотами. Рапамицин имеет серьезные побочные эффекты и не пригоден к использованию для продления жизни человека, но, возможно, в дальнейшем будут найдены более подходящие вещества. Одним из них может оказаться противодиабетический препарат метформин, если будет доказано, что его безопасно применять в профилактических целях.
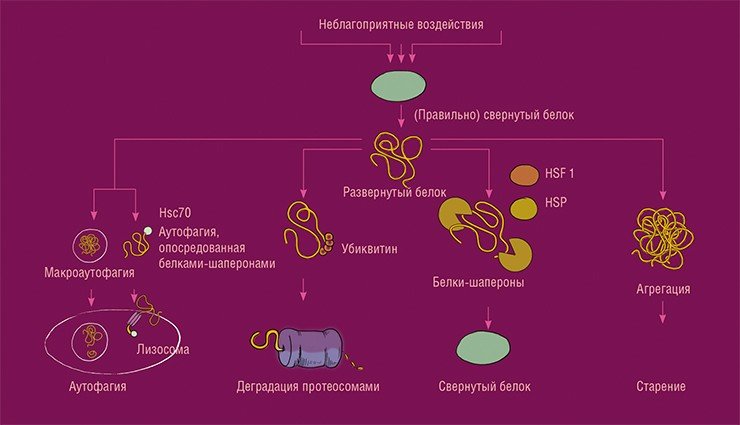
 Надо заметить, что процесс старения довольно долгое время протекает очень медленно, а потом ускоряется. Дело в том, что в организме существуют «системы контроля качества», которые заняты «починкой сломанного», а то, что уже не починить, отправляют в переработку. Это, к примеру, система протеостаза, которая отвечает за правильное свертывание молекул белков; и процесс аутофагии, являющийся в числе прочего важным звеном для отправки на переработку поврежденных клеточных органелл; и апоптоз (клеточное «самоубийство»). Наконец, сама иммунная система, которая борется не только с инфекциями, но и с опухолевыми клетками. Со временем все эти системы начинают работать хуже, но если вернуть им былую активность, возможно, удастся повернуть ряд старческих изменений вспять, и одним из направлений работ является как раз поиск веществ, которые бы увеличивали активность «систем контроля качества».
Надо заметить, что процесс старения довольно долгое время протекает очень медленно, а потом ускоряется. Дело в том, что в организме существуют «системы контроля качества», которые заняты «починкой сломанного», а то, что уже не починить, отправляют в переработку. Это, к примеру, система протеостаза, которая отвечает за правильное свертывание молекул белков; и процесс аутофагии, являющийся в числе прочего важным звеном для отправки на переработку поврежденных клеточных органелл; и апоптоз (клеточное «самоубийство»). Наконец, сама иммунная система, которая борется не только с инфекциями, но и с опухолевыми клетками. Со временем все эти системы начинают работать хуже, но если вернуть им былую активность, возможно, удастся повернуть ряд старческих изменений вспять, и одним из направлений работ является как раз поиск веществ, которые бы увеличивали активность «систем контроля качества».
Еще одно направление связано с тем, что в ходе старения в тканях организма развивается состояние слабого, вялотекущего, неспособного завершиться воспаления – так называемое тлеющее воспаление (Salminen, Kaarniranta, Kauppinen, 2012). Вообще воспаление характеризуется пятью признаками: покраснением, отеком, болью, повышением температуры и нарушением функции. И, возможно, если мы будем бороться с воспалением или с тем, что его вызывает в ходе старения, мы сможем вернуть тканям утраченную функциональность.
 Потенциальных мишеней так много... Не наводит ли это на мысль, что одну, универсальную таблетку против старения сделать не удастся?
Потенциальных мишеней так много... Не наводит ли это на мысль, что одну, универсальную таблетку против старения сделать не удастся?
 Конечно, хочется найти простой ответ, скорее всего, вмешательство будет сложным, комплексным и разнонаправленным. Сколько в нем будет элементов, я не могу сказать
Конечно, хочется найти простой ответ, скорее всего, вмешательство будет сложным, комплексным и разнонаправленным. Сколько в нем будет элементов, я не могу сказать
Довольно давно известно (хотя потребовалось много времени для подтверждения этого феномена), что ограничение калорийности питания ведет к замедлению развития старческих изменений и увеличению продолжительности жизни (Colman et al., 2009). На крысах таким способом удалось добиться увеличения продолжительности жизни до 40 %. Эти эксперименты доказывают, что искусственное увеличение максимальной продолжительности жизни в принципе возможно. Ограничение калорийности действует и на системы контроля качества, и снижает тлеющее воспаление, т. е., по-видимому, «бьет» очень близко к предмету поисков – общему механизму старения.
Проблемы и способы их решения
Я описал направления биологии старения, по которым активно идут исследования, но любой такой список будет заведомо неполон. Уже известны многие процессы, течение которых нарушается в ходе старения, и, что важно, известны сотни веществ-кандидатов в потенциальные «лекарства от старения» – геропротекторы. Обилие потенциальных мишеней и методик, с одной стороны, радует, потому что говорит о том, что стадия, на которой шли поиски хоть каких-нибудь мишеней, пройдена. Но возникла другая проблема: сейчас потенциальных мишеней много больше, чем научное сообщество может «переварить». Возможно, среди нескольких сотен потенциальных геропротекторов есть наиболее действенный, но как его определить? Ограничивающим фактором становится количество лабораторий и специалистов.
 Что может сделать обычный человек, который не занимается научными исследованиями, чтобы продлить собственную жизнь и молодость? И как именно нужно ограничивать калорийность питания?
Что может сделать обычный человек, который не занимается научными исследованиями, чтобы продлить собственную жизнь и молодость? И как именно нужно ограничивать калорийность питания?
 Вопрос актуальный и правильный, я сам им задаюсь. Ограничение калорийности действительно работает, цифры разные по разным данным: примерно на 10—30 %. И, к сожалению, я не могу выписать рецепт «молодости». Обычный человек должен вести здоровый образ жизни, как бы это ни звучало скучно и разочаровывающе. Физические нагрузки, периодический острый стресс (например, сходить в горы), не переедать. Конечно, изменить образ жизни захотят далеко не все, обычно люди хотят «таблетку». И мы работаем над этим
Вопрос актуальный и правильный, я сам им задаюсь. Ограничение калорийности действительно работает, цифры разные по разным данным: примерно на 10—30 %. И, к сожалению, я не могу выписать рецепт «молодости». Обычный человек должен вести здоровый образ жизни, как бы это ни звучало скучно и разочаровывающе. Физические нагрузки, периодический острый стресс (например, сходить в горы), не переедать. Конечно, изменить образ жизни захотят далеко не все, обычно люди хотят «таблетку». И мы работаем над этим
Каким может быть выход из этой ситуации? Можно привлечь к работе неспециалистов по аналогии с тем, как поступают орнитологи: они принимают данные наблюдений людей, состоящих в сообществах наблюдателей за птицами (такой подход называется «гражданская наука»). Специалисты по старению предлагают привлекать к своей деятельности владельцев собак (Kaeberlein, 2016). Собака – это один из очень немногих видов животных, объем накопленных медицинских данных о котором сравним с данными «человеческой» медицины. Владельцы собак, получая для своих питомцев экспериментальное лечение, могли бы собирать данные (простые, измеряемые на дому показатели) и отправлять отчеты о результатах.
Можно упомянуть еще об одном возможном варианте активации сбора данных, хотя он и является дискуссионным. Согласно недавно введенному во многих штатах США закону, неизлечимо больной человек имеет право получить экспериментальные методы лечения, если они существуют, не дожидаясь окончания процедуры их одобрения. Некоторые такие пациенты считают, что им нечего терять, и делают это на свой страх и риск. Хотя это весьма специфический случай, и даже он остается «ареной» горячих дебатов, поэтому активно призывать людей к применению глубоко экспериментальных методик нельзя.
МЕНЬШЕ ЕСТЬ – ДОЛЬШЕ ЖИТЬ? Первые экспериментальные данные о влиянии ограничения питания на продолжительность жизни были представлены еще в начале 1900-х гг. в экспериментах на крысах: ограничение приема пищи тормозило рост животных, но увеличивало продолжительность жизни. Наиболее известными стали исследования 1935 г., когда было показано, что ограничение калорийности пищи на 40 % у крыс, начиная с возраста, когда они переходили на обычную пищу с материнского молока, продляло их жизнь вдвое. На сегодняшний день эффект ограничения калорийности на продолжительность жизни и здоровье продемонстрирован на совершенно разных организмах: круглых червях, мушках-дрозофилах, мышах и крысах, собаках и коровах и некоторых обезьянах.За это время высказывалось множество гипотез о механизмах действия ограничения калорийности пищи на долголетие. Сначала предполагали, что эффект как-то связан с замедлением обмена веществ. Высказывалось мнение и о том, что это артефакт, что лабораторные животные просто переедают по сравнению с дикими видами, а возвращение к природной норме идет им на пользу. Эти ранние гипотезы были в итоге отброшены. Затем возникла идея, что омолаживающий эффект ограничения калорийности связан с уменьшением производства активных форм кислорода, которые атакуют макромолекулы в клетках, т. е. с уменьшением уровня окислительного стресса. Когда в научную жизнь прочно вошла молекулярная биология, искать объяснение стали в области регуляции молекулярных сигналов. Сейчас большинство геронтологов соглашаются с тем, что эффекты ограничения калорийности на продолжительность жизни связаны с питательными веществами, запускающими в клетках ряд сигнальных каскадов.
Один из возможных механизмов действия ограничения калорий на продолжительность жизни опосредован снижением активности взаимосвязанных между собой сигнальных путей mTOR-киназы (активируется аминокислотами), инсулиноподобного фактора роста и инсулинового рецептора (активируется углеводами). Результатом их деятельности является активация ряда белков, участвующих в процессах деления клеток, апоптоза, ответа на стрессовые факторы. Ослабление активности этих сигнальных путей в итоге приводит к позитивным последствиям: например, инактивация mTOR-киназы способствует усилению процессов аутофагии – деградации поврежденных белков и внутриклеточных органелл.
Другими возможными посредниками эффекта ограничения калорийности могут быть повышение активности сигнального пути аденозинмонофосфат-активируемой протеинкиназы (АМФК) и активности белков под названием сиртуины. АМФК активируется в условиях ограничения энергии, регулирует энергетический баланс в клетке и участвует в регуляции обмена углеводов и жиров. Сиртуины, с одной стороны, участвуют в выключении генов, продукты которых клетке сейчас не нужны, а с другой – в репарации ДНК.
Но всю жизнь с детства питаться в режиме ограничения калорий – задача трудно реализуемая. Поэтому геронтологи и биологи пытаются разработать лекарства, имитирующие благоприятные эффекты ограничения калорийности.
Согласно результатам ряда работ, одним из таких препаратов может быть антиоксидант ресвератрол, содержащийся, в частности, в кожуре винограда и красном вине. Действию ресвератрола длительное время приписывали так называемый французский парадокс: относительно низкий уровень сердечно-сосудистых и онкологических заболеваний у жителей Франции на фоне высококалорийного питания. Правда, позже было показано, что содержание ресвератрола в вине слишком мало, чтобы вызвать нужный эффект, и вообще результаты исследований по теме влияния ресвератрола на здоровье и долголетие достаточно противоречивы.
Сигнальный путь mTOR-киназы могут ингибировать лекарственные средства рапамицин и метформин. Но рапамицин, антибиотик и иммуносупрессор, имеет серьезные побочные эффекты, и, конечно, не может идти речи об его использовании для продления жизни человека. Можно ли применять на здоровых людях препарат для лечения сахарного диабета 2-го типа метформин, который, помимо влияния на mTOR-киназу, активирует сигнальный путь АМФК, тоже пока под вопросом.
На самом деле, механизмы действия ограничения калорийности пищи на продолжительность жизни до сих пор до конца не понятны. Относительно всех гипотез существуют как подтверждающие их данные, так и опровергающие. Видимо, это связано с тем, что ограничение калорийности сопровождается сложными системными изменениями в организме. Сигнальные пути, которые задействованы в этих процессах, тесно и гибко взаимодействуют между собой и не всегда выдают в итоге одинаковый результат. Таким образом, несмотря на серьезные подвижки в понимании механизмов процесса старения, «таблетки от старения», по крайней мере надежной и гарантированно безвредной, пока не существует. Зато каждый свободен в реализации «сложного» пути – следить за своей диетой и, если и не дожить до ста лет, как минимум лучше себя чувствовать. По: (Lee, Min, 2013; Martin et al., 2016)
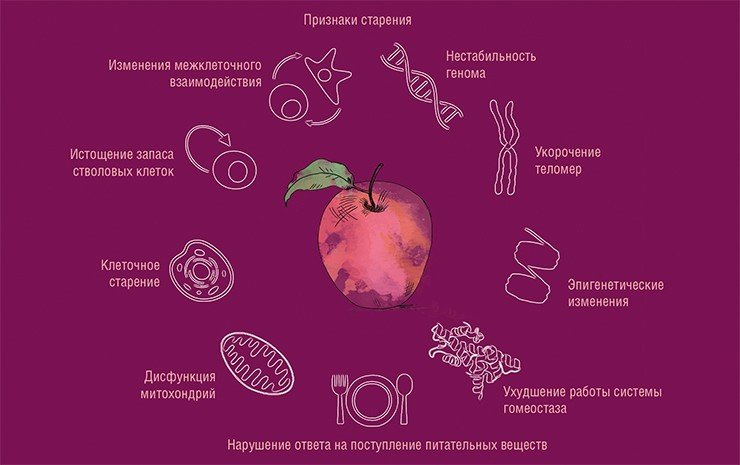
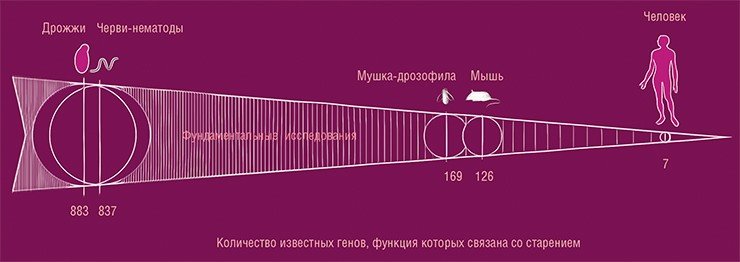
Исследовать процесс старения на людях очень трудно. Человек стареет долго, это неудобно с методологической точки зрения. Нельзя забывать и об этических аспектах. Поэтому старение исследуют в основном на червях-нематодах, дрожжах, мухах, мышах – на недолго живущих организмах. Исследования на модельных организмах – хороший подход, но человек не мышь и не муха, и далеко не все, что справедливо для моделей, будет также справедливо для человека (de Magalhães, Stevens, Thornton, 2017). Известно несколько сотен генов дрожжей и нематод, функция которых связана со старением, но у человека эти гены в основном функционируют не так или отсутствуют вовсе.
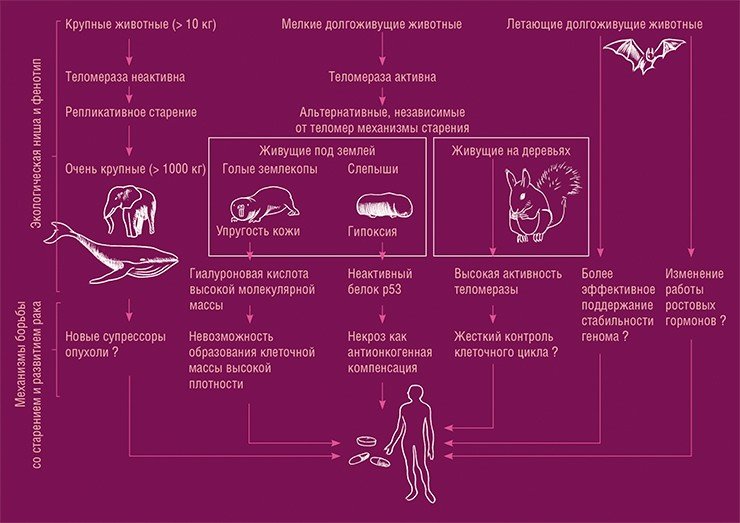
Один из вариантов, как обойти эту проблему, – «подгонять решение под ответ». Существуют животные, которые преодолели проблему старения и живут долго: продолжительность жизни хорошо коррелирует с размером организма, но некоторые животные выбиваются из этой закономерности. К ним относятся грызуны – голые землекопы и слепыши, некоторые летучие мыши, птицы, очень крупные млекопитающие. Можно изучить, чем они отличаются от не долгоживущих организмов, и пытаться имитировать фармакологическими агентами действие генных вариантов, отвечающих за долгую жизнь (Gorbunova et al., 2014).
Эксперименты, которые «провелись сами собой», могут быть найдены и в человеческих популяциях. Сегодня ведутся исследования геномов людей, которые прожили более 100 лет (Puca et al., 2017), с тем соображением, что эти люди «выиграли в генетическую лотерею». И выявление связанных с их долгожительством вариантов генов (аллелей) может указать нам, какие вещества способны воспроизвести этот эффект в общей популяции.
 Если старение является «сборником симптомов», таких как диабет 2-го типа, инсульты, инфаркты, почему бы не оставить попытки объять необъятное и не попытаться лечить только эти заболевания? Ведь уже пытались сделать универсальное лекарство, например, связанное с увеличением теломер, и не получилось?
Если старение является «сборником симптомов», таких как диабет 2-го типа, инсульты, инфаркты, почему бы не оставить попытки объять необъятное и не попытаться лечить только эти заболевания? Ведь уже пытались сделать универсальное лекарство, например, связанное с увеличением теломер, и не получилось?
 Лечение симптомов не всегда оправдывает себя, если проводить аналогии с медициной как таковой. Мы предполагаем, что старческие заболевания являются различными гранями единого процесса. Несомненно, исследования старческих заболеваний – это важное направление биологии старения, но мы, анализируя разные аспекты, хотим увидеть в них общее.
Лечение симптомов не всегда оправдывает себя, если проводить аналогии с медициной как таковой. Мы предполагаем, что старческие заболевания являются различными гранями единого процесса. Несомненно, исследования старческих заболеваний – это важное направление биологии старения, но мы, анализируя разные аспекты, хотим увидеть в них общее.
Теломеры – это участки на концах хромосом, которые защищают их при копировании и с количеством делений клетки укорачиваются. Когда они совсем «изнашиваются», клетка гибнет. Действительно, еще несколько десятилетий назад выдвигалась идея, что для увеличения продолжительности жизни можно удлинять теломеры. Эксперименты на мышах показывают, что с увеличением активности теломеразы (фермента, способного наращивать теломеры) растет продолжительность жизни мышей, при этом не увеличивается частота опухолевых заболеваний (de Jesus et al., 2012). Но у мышей, как вообще у небольших животных, теломераза работает всегда, и в этих экспериментах ее активность только усиливается. На человека и другие крупные организмы это транслировать сложно. У человека теломераза работает только в эмбриональных и опухолевых клетках, и ее активация может вызвать онкологические заболевания. Считается, что укорочение теломер и последующая гибель клетки являются предохранительным механизмом от злокачественного перерождения. Для всего же остального нам нужна высокопроизводительная методика проверки гипотез: если мы каждую будем проверять десятки лет, ответы получим очень нескоро
Некоторые потенциальные геропротекторы являются давно применяющимися в медицине лекарствами (например, упоминавшийся выше метформин), и исследование течения старческих заболеваний у людей, принимающих их по сторонним показаниям, может помочь нам выявить наиболее перспективные вещества.
Многообещающим направлением является поиск биомаркеров старения – показателей, скорость изменения которых за сравнительно небольшой промежуток времени, например за год, достаточно достоверно отражает общую скорость этого процесса (Sprott, 2010). Использование биомаркеров позволит напрямую исследовать эффективность геропротекторов, не требуя наблюдения в течение всей жизни.
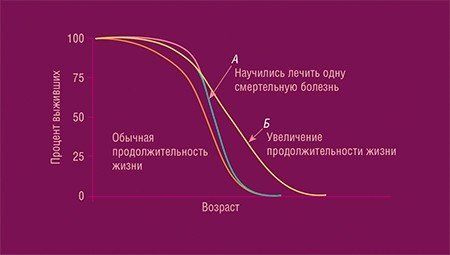
И о будущем борьбы со старением. Приведу сначала в пример статистику по выживаемости пациентов с онкологическими заболеваниями. Хотя нам до сих пор кажется, что рак – это приговор, по многим видам опухолей цифры выживаемости и наступления долгосрочной ремиссии выросли на десятки процентов, например, для рака простаты – с 30 до 70 %. Долгое время шли фундаментальные исследования, а сейчас мы видим плоды работы, которая начиналась в середине XX в. Вероятно, и результаты борьбы со старением будут такой же «тихой революцией». Мы не проснемся и не прочитаем в заголовках газет, что старение побеждено. Это будет постепенный процесс, которому предшествовало постепенное накопление новых данных. Сначала мы узнаем, что увеличение жизни в принципе возможно, затем обнаружим все большее число работающих геропротекторов, затем начнет расти продолжительность жизни… И когда-нибудь мы обернемся назад и увидим, что прогресс действительно есть.
Литература
Blagosklonny M. V. Calorie restriction: decelerating mTOR-driven aging from cells to organisms (including humans) // Cell Cycle. 2010. V. 9. N. 4. P. 683—688.
Colman R. J., Anderson R. M., Johnson S. C. et al. Caloric restriction delays disease onset and mortality in rhesus monkeys // Science. 2009. V. 325. N. 5937. P. 201—204.
de Magalhães J. P., Stevens M., Thornton D. The business of anti-aging science // Trends in biotechnology. 2017. V. 35. N. 11. P. 1062—1073.
Gorbunova V., Seluanov A., Zhang Z. et al. Comparative genetics of longevity and cancer: insights from long-lived rodents // Nat Rev Genet. 2014. V. 15. N. 8. P. 531—540.
Puca A. A., Spinelli C., Accardi G. et al. Centenarians as a model to discover genetic and epigenetic signatures of healthy ageing // Mechanisms of ageing and development. 2017. doi.org/10.1016/j.mad.2017.10.004.
Sinha M., Jang Y. C., Oh J. et al. Restoring systemic GDF11 levels reverses age-related dysfunction in mouse skeletal muscle // Science. 2014. V. 344. N. 6184. P. 649—652.
Sprott R. L. Biomarkers of aging and disease: introduction and definitions // Experimental gerontology. 2010. V. 45. N. 1. P. 2—4.