Вирус под микроскопом: от визуализации к манипуляции
Вирусы являются чрезвычайно малыми объектами, имеющими размер от нескольких десятков до нескольких сотен нанометров. Первым и на несколько десятилетий единственным методом их визуализации стала электронная микроскопия, позволившая не только подробно изучить строение самих вирусных частиц, называемых вирионами, но и исследовать процессы, происходящие в зараженной клетке – репликацию вируса. «Монополия» электронной микроскопии была нарушена появлением в начале 1980-х годов принципиально нового класса приборов – сканирующих зондовых микроскопов.
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В известной песне Владимира Высоцкого поется: «не поймаешь нейтрино за бороду и не посадишь в пробирку…». Конечно, вирус – это не нейтрино, не атом и даже не молекула, но все же объект настолько малый, что его невозможно увидеть не только глазом, но и в обычный световой микроскоп. Однако электронная микроскопия, в сотни тысяч раз увеличившая возможности нашего зрения, позволила не только увидеть эти удивительные объекты, но и рассмотреть их до мельчайших подробностей. А атомно-силовая микроскопия, в такой же степени обострившая наше осязание, позволила осуществить прямую механическую манипуляцию вирусными частицами
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Еще большее разнообразие было обнаружено для стратегии репликации (размножения) вирусов. Единственным фундаментальным свойством, общим для всех без исключения вирусов, оказался их статус облигатного внутриклеточного паразита. Это означает, что для размножения вируса его генетический материал должен в обязательном порядке проникнуть в живую клетку и «захватить» ее ферментативный аппарат, переключив последний на производство копий вируса.
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Спецификой электронной микроскопии является изучение фиксированных, т. е. подготовленных специальным образом, объектов – по сути, она работает только с «мертвой» материей *. Имея дело только с «застывшими мгновениями», исследователь может лишь строить гипотезы о динамике изучаемых процессов, поскольку не имеет возможности наблюдать их течение в реальном времени.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
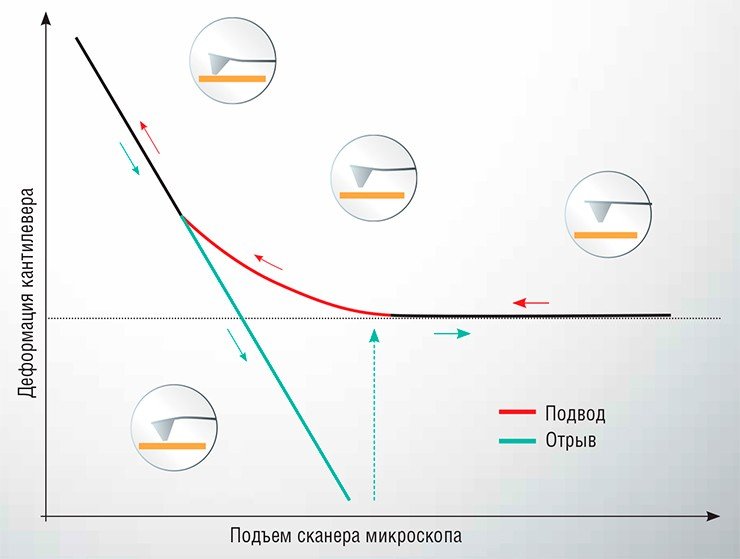
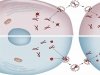
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Поистине захватывающие перспективы исследований в этом направлении открывает АСС. Зафиксировав одиночную вирусную частицу на острие зонда АСМ, можно осуществить измерение силы, возникающей при контакте вирусной частицы с поверхностью клетки, исследовать кинетические характеристики данного взаимодействия и даже «вдавить» вирион внутрь клетки, одновременно ведя наблюдение при помощи мощного светового микроскопа. В таком эксперименте исследователь из пассивного наблюдателя превращается в активного участника процесса, осуществляя механическую манипуляцию исследуемым наноразмерным объектом – такую возможность не может предоставить ни один из других видов микроскопии.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Главный вопрос, на который необходимо ответить при интерпретации любых результатов атомно-силовой спектроскопии, можно сформулировать следующим образом: «Силы между какими объектами были измерены?»
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Литература
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
В публикации использованы фото автора