Болезнь Альцгеймера – аутоиммунное заболевание?
Болезнью Альцгеймера – наиболее распространенной формой старческого слабоумия – в мире страдает более 50 млн человек, и ежегодно регистрируется 10 млн новых случаев. Новая гипотеза механизмов развития этого на сегодня неизлечимого заболевания объясняет многое ранее непонятное, в том числе многочисленные неудачи в разработке лекарств
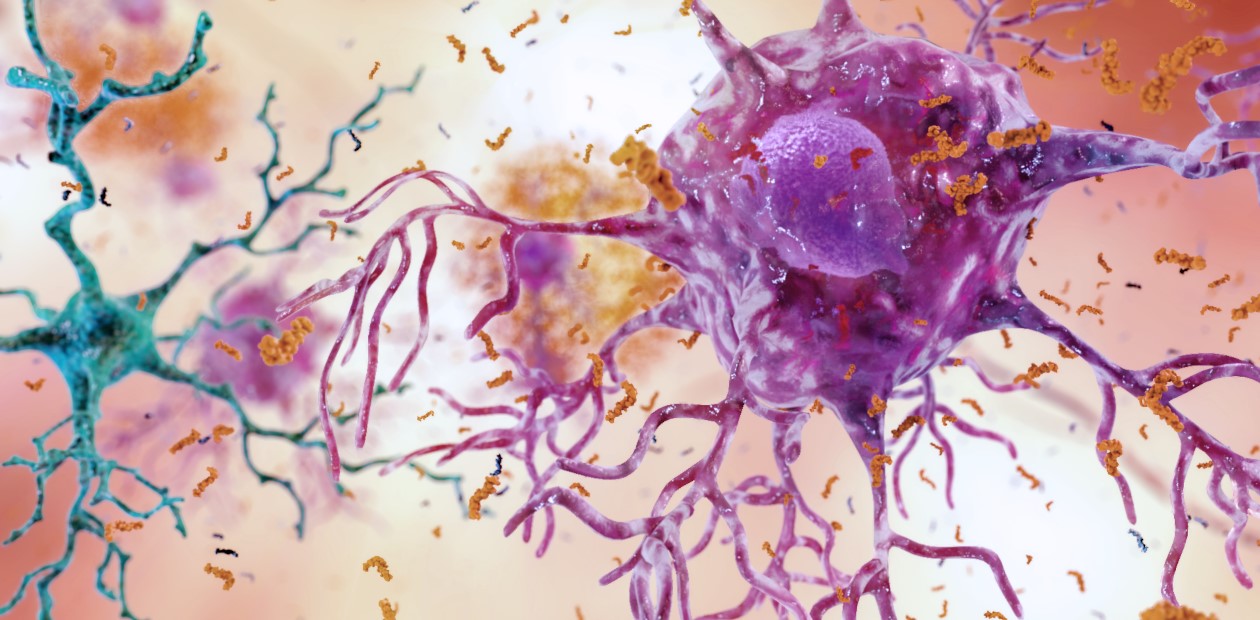
Ученые сейчас сходятся во мнении, что ключевую, или, как минимум, важную роль в патогенезе болезни Альцгеймера играет накопление в ткани мозга патологических, неправильно «свернутых» белков. В первую очередь это бета-амилоид, который откладывается в виде бляшек, а также гиперфосфорилированный тау-белок, образующий фибриллярные клубки. Именно на это звено патогенетического процесса и были нацелены основные работы по созданию лекарств от этой болезни, которые по итогу можно считать скорее неудачными, чем успешными.
Недавно ученые из Института мозга Крембиля (UHN, Канада) предложили новую гипотезу патогенеза болезни Альцгеймера, в которую вписываются и другие гипотезы, помимо «амилоидной». К примеру, такие, где в качестве ключевого звена патологического процесса рассматриваются нарушения работы митохондрий («клеточных электростанций»), синапсов (мест передачи сигнала между нейронами), клеточного баланса ионов металлов и др.
При этом исследователи не отрицают роль бета-амилоида, но вписывают ее в более масштабную картину событий, суть которой в том, что болезнь Альцгеймера является хроническим аутоиммунным заболеванием мозга.
Нужно сказать, что подобное предположение уже выдвигалось, но в рамках «классического» представления, подразумевающего выработку защитных белков-антител против собственных клеточных компонентов, т.е. речь шла о реакции адаптивного иммунитета. Однозначного подтверждения эта гипотеза не нашла. Сейчас же ученые разработали концепцию болезни Альцгеймера как заболевания врожденного иммунитета – системы эволюционно древних и неспецифичных механизмов «быстрого реагирования».
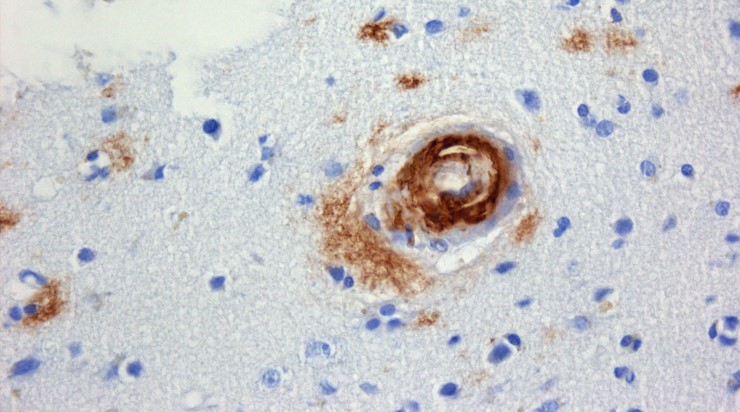
Согласно новой гипотезе, патологический белок бета-амилоид синтезируется и высвобождается в ответ на самые разные иммуностимулирующие события (инфекция, травма, недостаточность кровоснабжения и даже депрессия или ожирение). И начинает работать как активный физиологический агент – цитокиноподобный иммунопептид (для справки: цитокины – это небольшие гормоноподобные молекулы, обеспечивающие межклеточные взаимодействия).
В этом качестве бета-амилоид проявляет одновременно иммуномодулирующие и антимикробные свойства. Первое выражается в активации микроглии – клеток иммунной системы, расположенных в головном мозге, что сопровождается высвобождением молекул, провоцирующих воспаление и, в конечном итоге, гибелью нейронов в результате апоптоза (клеточного «самоубийства»).
Свою антимикробную функцию бета-амилоид также выполняет неадекватно: он «путает» нейроны с бактериальными клетками, в результате чего те атакуются антителами – развивается аутоиммунная реакция. Причина – в сходстве распределения анионного заряда на макромолекулах клеточных мембран нейронов и бактерий. Такая атака на нейроны вызывает их некротическую гибель, при которой все содержимое нервной клетки «вываливается» наружу. Диффундируя в соседние нейроны, эти клеточные «останки», в свою очередь, провоцируют высвобождение бета-амилоида – так формируется самовоспроизводящийся аутоиммунный цикл.
Такими свойствами бета-амилоида объясняется, к примеру, и «митохондриальная» гипотеза болезни Альцгеймера. Ведь предками митохондрий являются древние бактерии, когда-то ставшие клеточными симбионтами, поэтому они также чувствительны к антимикробным пептидам.
Переосмысление болезни Альцгеймера как аутоиммунного заболевания, и бета-амилоида – как иммунной молекулы, требует экспериментального подтверждения. И если новая гипотеза подтвердится, это откроет двери для принципиально новых подходов к диагностике и лечению заболевания.
К примеру, известно, что врожденный иммунитет регулируется метаболитами аминокислот L-триптофана и L-аргинина, и их уровни в крови или спинномозговой жидкости могут стать диагностическими биомаркерами. А для терапевтических целей можно будет использовать аналоги этих метаболитов или ингибиторы метаболических путей, а может быть, манипуляции с микробиомом – совокупностью кишечных микроорганизмов, представители которого способны менять доступность пищевого L-триптофана для организма человека.
На фоне новой аутоиммунной гипотезы становится понятна и неэффективность антиамилоидной терапии. Ведь лечение такой болезни требует комбинированного подхода – воздействия только на одно звено патологического процесса явно недостаточно.
Фото: https://www.flickr.com, https://commons.wikimedia.org