Вирус гриппа: подробности личной жизни
Возможность наблюдать и изучать множество самых разных микроорганизмов появилась благодаря изобретению микроскопа: это революционное событие неизмеримо расширило границы мира живых существ. Развитие технического прогресса и появление электронной микроскопии сделало доступным наблюдение и изучение «интимных» подробностей жизни самых мелких и поразительных организмов – вирусов. Наш сегодняшний «герой» – вирус гриппа, ежегодно убивающий на Земле до полумиллиона человек. Оказывается, его поразительная устойчивость к различным терапевтическим воздействиям связана с тем, что основные фазы цикла воспроизводства этого вируса проходят в самом защищенном месте зараженной клетки – ее ядре
Электронная микроскопия является единственным методом прямой визуализации вирусов – «наноорганизмов», размеры которых лежат в диапазоне от 20 до 250—300 нм. Очевидно, что столь малые размеры жестко ограничивают набор структурных компонентов организма: вирусы, по сути, представляют собой наследственный материал (ДНК или РНК), упакованный в белковый «чехол» разной степени сложности. Такая частица (вирион) в воде, воздухе или на поверхности предметов ведет себя как неживое образование, поэтому споры о том, являются ли вирусы «живыми», до сих пор не утихают.
Как только вирион встречается с подходящей клеткой, включается сложнейшая программа воспроизводства вируса, программа паразитизма на генетическом уровне. Проникнув в клетку, вирус «переключает» работу ее макромолекулярных систем на синтез вирусных молекул. Вирус эксплуатирует все без исключения клеточные структуры, которые обеспечивают не только синтез вирусных белков и нуклеиновых кислот, но и формирование вирусного потомства. Зараженная клетка помимо воспроизводства обеспечивает паразиту еще и надежную защиту.
Единственной возможностью остановить развитие инфекции в организме является уничтожение зараженных клеток, с чем может справиться сам организм, и что является чрезвычайно сложной задачей для разработчиков противовирусных препаратов. Решение этой задачи невозможно без изучения тонких деталей вирус-клеточного взаимодействия. В процессе своего воспроизводства вирусы используют разные структуры клетки и механизмы разной степени сложности. Так, аденовирусы формируются в ядре клетки путем самосборки, в результате которой образуются гексагональные частицы, а вирус кори «одевает» свою нуклеиновую кислоту и белки плазматической мембраной клетки.
Вирус гриппа, как и многие другие вирусы, проникает в клетку различными способами, механизмы которых до конца не изучены. И все же с помощью электронной микроскопии мы можем «воочию» увидеть многие «интимные» подробности жизни вируса в зараженной клетке.
«Анфас и в профиль»
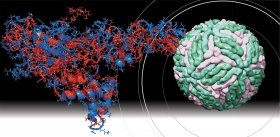
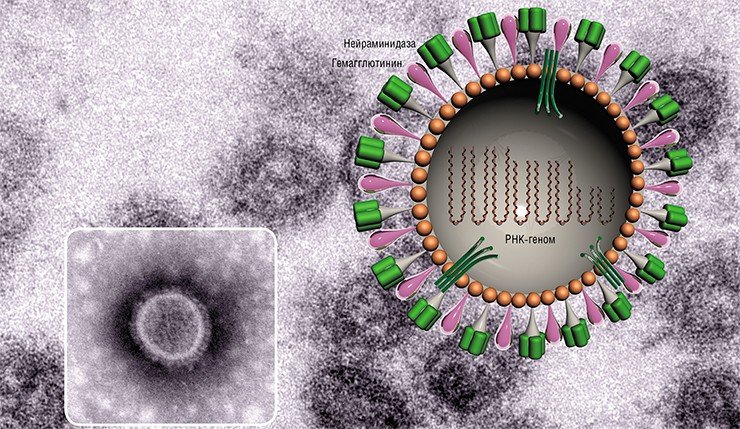
Внешне вирус гриппа выглядит как пузырек или вытянутая палочка. Под мембранной оболочкой скрывается необычный РНК-геном, состоящий из восьми отдельных частей. Поверхность щетинится шипиками, представляющими собой наружные части встроенных в мембрану белков – гемагглютинина и нейраминидазы. Именно молекулы этих двух гликопротеинов ответственны за связывание вирусной частицы с рецепторами клетки-хозяина.
В соответствии с «классическими» представлениями, верхняя часть молекулы вирусного гемагглютинина связывается с гликопротеинами и гликолипидами плазматической мембраны клетки, а именно – с остатками сиаловых кислот, находящихся обычно на концах боковых цепей этих молекул.
Интересно, что вирусы гриппа человека присоединяются к сиаловым кислотам, содержащим альфа-2,6-галактозную связь, тогда как вирусы гриппа птиц – к кислотам с альфа-2,3-галактозной связью (высокая специфичность связывания обусловлена наличием в определенном месте молекулы вирусного гемагглютинина аминокислот лейцина или глутамина). В клетках трахеи свиньи присутствуют сиаловые кислоты обоих типов, поэтому свиньи могут быть инфицированы как вирусами гриппа птиц, так и человека. Этот факт служит основанием считать свинью своего рода «сосудом Пандоры», где образуются новые, опасные для человека разновидности вируса гриппа.
Опасные связи
Итак, первый шаг сделан: вирус связался с клеточными рецепторами. В месте связывания образуется углубление плазматической мембраны, края которого затем смыкаются, и вирус оказывается в полости так называемого эндоцитозного пузырька. Вообще эндоцитоз является процессом, обычным для клеток высших организмов, которые с помощью этого механизма поглощают крупные молекулы. Вирус, таким образом, эксплуатирует транспортную систему клетки, причем делает это «на законных основаниях»: «билетом» служит сам факт связывания с клеточными рецепторами.
Первым сортировочным узлом эндоцитозного транспортного потока является эндосома – мембранный пузырь с выростами и мелкими пузырьками внутри. Несмотря на свою видимую простоту, эндосома осуществляет в клетке сложные логистические функции: она «опознает» и сортирует попавшие в нее макромолекулы, направляя их по тому или иному метаболическому пути. Однако вирусу это совершенно не нужно – он сам «знает», что делать дальше. Пользуясь тем, что внутри эндосомы среда кислая, вирусная оболочка плотно «прижимается» к мембране эндосомы и сливается с ней. В результате вирусная РНК попадает в цитоплазму – всего через полчаса после того, как вирус связался с поверхностью клетки. Кстати, препараты группы ремантадина воздействуют именно на стадию «раздевания» вируса гриппа, блокируя слияние вирусной оболочки с мембраной эндосом.
Добавим, что на стадии проникновения в клетку вирус гриппа использует еще и разные пути эндоцитоза, что повышает воздействие инфекции и позволяет с большей вероятностью избежать атаки иммунной системой.
Под надежной «крышей»
Вирусный геном проник в цитоплазму, теперь ему предстоит путь к месту его репликации (размножения) – прямиком в ядро клетки. Репликация в клеточном ядре – редкое явление среди вирусов с РНК-геномом. И хотя ядро – самое защищенное место в клетке, и каким-то образом вирус гриппа научился использовать самую надежную «крышу».
Попасть туда непросто: клеточное ядро надежно изолировано от окружающей цитоплазмы, и все транспортируемые молекулы проходят строгую «проверку документов» у входа в ядерные поры. В качестве «пропуска» вирусу служит закодированная в его геноме особая сигнальная последовательность нуклеотидов, идентичная клеточной.
И вот РНК вируса уже в ядре, под надежной защитой. Здесь следует отметить еще одну интересную особенность нашего «героя»: его РНК имеет так называемую негативную полярность и не способна сама по себе служить матрицей для синтеза дочерней вирусной РНК (будущего вирусного генома) и мРНК (матрицы для синтеза вирусных белков).
Поэтому в ядре зараженной клетки на матрице вирусной (–)РНК сначала образуются две формы с положительной полярностью (+)РНК. Первая – комплементарная вирусная (+)РНК, которая впоследствии служит шаблонном для синтеза дочерней (–)РНК. Вторая – информационная вирусная (+)РНК, которая после сложной цепи превращений с участием клеточных ферментов транспортируется в цитоплазму клетки для будущего синтеза вирусных белков. Разумеется, все эти перемещения также обеспечиваются транспортными системами клетки.
Вот теперь все основные детали для конвейера по производству миллионов вирусных клонов готовы.
Клеточная фабрика
В соответствии с законами клетки синтез мембранных белков будущих вирусов происходит на цепочках рибосом (клеточных белковых «фабрик»), закрепленных на шероховатой эндоплазматической сети – транспортной внутриклеточной системе, состоящей из полостей и канальцев. Вирусные белковые заготовки затем переносятся еще в одну клеточную органеллу – аппарат Гольджи – где они, как и собственные белки клетки, подвергаются гликозилированию – присоединению определенных углеводных остатков.
Готовые молекулы мембранных вирусных белков гемагглютинина и нейраминидазы объединяются и в таком виде транспортируются к внешней границе клетки специальными транспортными пузырьками, которые обеспечивают включение вирусных молекул в особые участки плазматической мембраны – липидные рафты (кавеолы).
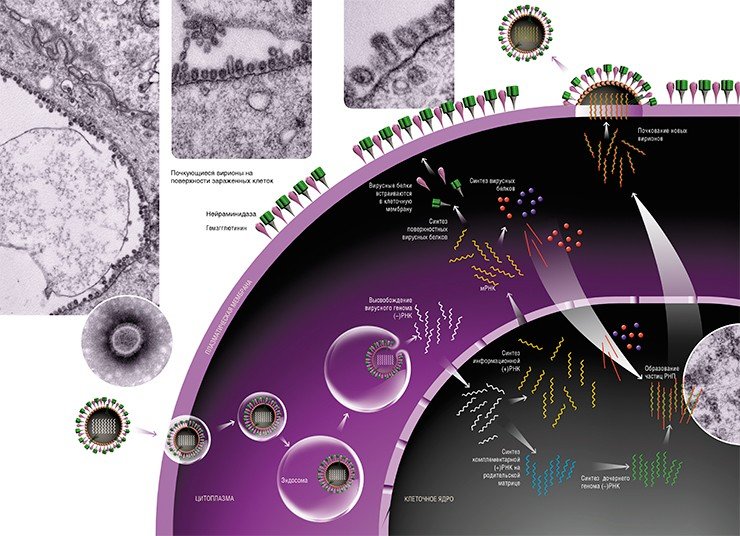
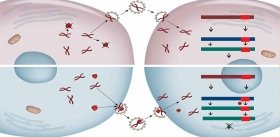
Остальные вирусные белки, предназначенные для формирования комплексов с наследственным материалом будущего вирусного потомства (–)РНК, синтезируются на свободных полирибосомах клетки, как и положено всем немембранным белкам. Нужно сказать, что в этом смысле вирус гриппа даже «терпит» некоторые неудобства – ведь белки накапливаются в цитоплазме, а сама (–)РНК – в ядре. Поэтому вирусные белки вновь прибегают к помощи клеточной транспортной системы и проникают в ядро, где объединяются с вирусной (–)РНК, формируя рибонуклеопротеиновые частицы (РНП). Последние можно увидеть с помощью электронного микроскопа: РНП представляют собой палочки с «петельками» на концах.
Таким образом, в ядре зараженной клетки образовалось множество копий вирусного генома; на мембране клетки «заготовлены» будущие шипики вирусных мембранных белков – осталось собрать вместе эти детали нашего конструктора. Следующий шаг – экспорт частиц РНП из ядра в цитоплазму и далее, к плазматической мембране клетки (механизмы этого процесса еще не изучены до конца).
На сборочном конвейере
Наступает финальный этап вирусной репродукции – формирование новых вирионов. Для того чтобы это произошло, необходимо, чтобы вирусный геном – все восемь частиц РНП, а также остальные вирусные белки, встретились в строго определенном месте.
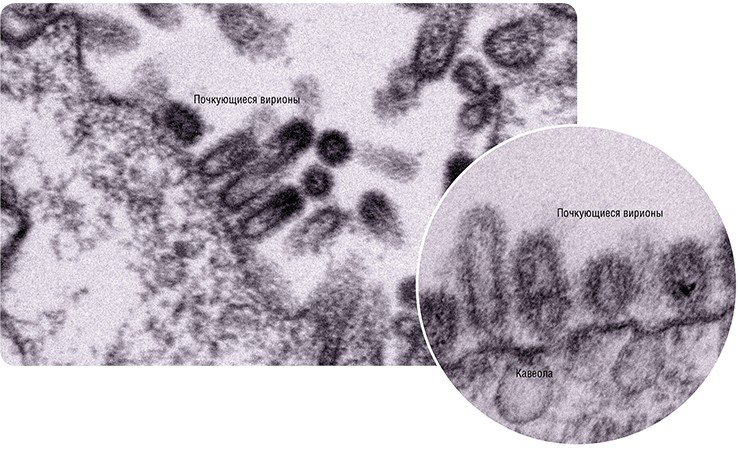
Место встречи уже «назначено» – это липидные рафты, участки мембраны, в которые включены молекулы гемагглютинина и нейраминидазы, и которые послужат для вируса платформами для сборки и почкования. Удивительно, как частицы РНП «находят» дорогу к месту почкования будущего вируса: в последние годы появляется все больше доказательств наличия у каждого сегмента вирусного генома специфичных «упаковочных сигналов».
Итак, частицы РНП – главный компонент новых вирионов – доставлены к плазматической мембране и готовы к упаковке. Благодаря действию комплекса факторов плазматическая мембрана в участке сборки вирусной частицы искривляется – начинается почкование вириона. На поверхности клетки появляются выпячивания, которые затем отделяются от клетки, и вот уже «свежеиспеченные» вирусные частицы выходят в межклеточное пространство. Чтобы они не связались вновь с «родительской» клеткой, предусмотрен специальный механизм – нейраминидаза нового вируса как метелкой отщепляет рецепторы с поверхности клетки. Действие препаратов тамифлю и реленза направлено на блокирование нейраминидазы: они подавляют отделение вирусного потомства от клетки и, соответственно, уменьшают число зараженных клеток.
Каждая зараженная клетка вырабатывает огромное число вирусных частиц, причем далеко не все из них жизнеспособны – на «сборочном конвейере» всегда возникают перебои, а производство «комплектующих» не сбалансировано. Да и сама клетка не всегда в состоянии обеспечить работу своих синтетических и транспортных систем на должном уровне. Именно поэтому вирус гриппа, как и все другие вирусы, наиболее эффективно размножается в «здоровых» клетках, что хорошо известно вирусологам, работающим с клеточными культурами.
В организме вирусное потомство оказывается в слое слизи, покрывающей внутреннюю поверхность носоглотки, и человек, чихая и кашляя, распространяет вирус с капельками слизи. Клетки, естественно, пытаются защититься от агрессора, включая механизмы интерференции и апоптоза, однако эта защита, как правило, запаздывает, и паразит успевает размножиться и заразить новые клетки. Поэтому так важно применять препараты интерферона в первые сутки (а лучше – в первые часы заболевания), чтобы предотвратить массовое заражение клеток и остановить развитие заболевания.
Дело в том, что при заражении любым вариантом вируса гриппа (или при введении вакцины) наша иммунная система всегда будет вырабатывать защитные антитела не конкретно к этому вирусу, а к тому, который встретился ей когда-то впервые. И если вновь встреченный вирус не будет тождествен «запечатленному», эти антитела не только не защитят организм от инфекции, но могут резко осложнить ее течение. Это ставит принципиальный вопрос о целесообразности вакцинации против гриппа
Познакомившись со сложным взаимодействием вируса гриппа с отдельной клеткой, поражаешься той виртуозности, с которой этот паразит эксплуатирует клеточные системы.
Если же перейти на уровень организма, то здесь взаимодействие вируса с хозяином определяется множеством дополнительных факторов, которые могут привести, а могут и не привести к заболеванию. Главный из этих факторов – реакция иммунной системы, и споры о том, надо ли стимулировать эту реакцию вакцинацией, не только не утихают, но становятся со временем все более острыми.
Сегодня о вирусе гриппа и его биологических свойствах известно много, однако грипп до сих пор остается болезнью, которая «проходит за неделю при лечении, и за 7 дней – без него». Такая устойчивость этого заболевания, очевидно, обусловлена почти полной невозможностью терапевтически «вмешаться» в цикл воспроизводства вируса гриппа, столь надежно укрытого в самом «сердце» зараженной клетки.
Литература
Compans R.W., Dimmock N.J. An electron microscopic study of single-cycle infection of chick embryo fibroblasts by influenza virus// Virology. 1969. V. 39. P. 499—515.
Harris A., Cardone G., Winkler D.C. et al. Influenza virus pleiomorphy characterized by cryoelectron tomography //PNAS. 2006. V. 103. P. 19123—19127.
Kim J.H., Skountzou I, Compans R, Jacob J. Original antigenic sin responses to influenza viruses// J. Immunol. 2009. V. 183. P. 294—301.
Leser G.P., Lamb R.A. Influenza virus assembly and budding in raft-derived microdomains: a quantitative analysis of the surface distribution of HA, NA and M2 proteins// Virology. 2005. V. 342. P. 215—227.
Matrosovich M., Matrosovich T., Uhlendorff J. et al. Avian-virus-like receptor specificity of the hemagglutinin impedes influenza virus replication in cultures of human airway epithelium// Virology. 2007. V. 361. P. 384—390.
Morris S.J., Nightingalea K., Smithb H. et al. Influenza A virus-induced apoptosis is a multifactorial process: Exploiting reverse genetics to elucidate the role of influenza A virus proteins in virus-induced apoptosis// Virology. 2005. V. 335. P. 198—211.
Noda T., Sagara H., Yen A. et al. Architecture of ribonucleoprotein complexes in influenza A virus particles// Nature. 2006. V. 439. P. 490—492.
В публикации использованы фотографии автора.
Автор выражает благодарность Ю. Спицыной и О. Таранову (ИХБФМ СО РАН) за помощь в обработке фотографий