Ионный щит вируса гриппа
Пожалуй, невозможно найти человека, который хотя бы один раз в жизни не болел гриппом. Большинство же из нас поневоле «общается» с этим инфекционным агентом многократно. Об этом свидетельствует и огромное число лекарств, призванных облегчить безобидный только на первый взгляд недуг. Увы, грипп относится к тому ряду болезней, о которых говорят, что ими болеют без лечения 7 дней, с лечением – неделю. Что же обеспечивает вирусам гриппа такую феноменальную стойкость к лекарственным средствам и атакам нашей иммунной системы? Ответ на этот вопрос, возможно, лежит в прямом смысле на поверхности - на поверхности самого гриппозного вириона…
Геном вируса гриппа, как известно, способен мутировать исключительно высокими темпами благодаря случайным «ошибкам» при тиражировании своей наследственной информации. Частота нуклеотидных замен в его наследственном материале в сотни тысяч раз выше, чем в геноме человека.
Именно эта особенность вируса лежит в основе эффективного механизма, защищающего его от иммунной системы человека, поскольку приводит к появлению таких штаммов, с которыми не могут связываться антитела, ранее наработанные в организме в ответ на инфекцию или вакцинацию. Мутантный штамм поэтому активно размножается до тех пор, пока в организме не будут выработаны новые специфичные антитела.
Молекулярные механизмы, обеспечивающие проникновение вируса внутрь клетки-мишени, до сих пор остаются предметом многих научных исследований. Главная цель последних – помочь в разработке лекарственных препаратов, способных предотвратить инфицирование клетки вирусом. Остановить болезнь на начальной стадии крайне важно – это означает не дать вирусной частице создать армию своих клонов, готовых к заражению других здоровых клеток.
В настоящее время в связи с возможностью новой пандемии гриппа, причиной которой может стать мутированный штамм так называемого птичьего гриппа, исследования вируса гриппа типа А (к нему относится большинство штаммов гриппа млекопитающих и птиц) приобрели еще большую актуальность. Создание новых эффективных средств профилактики и лечения этого заболевания требует глубокого понимания сложных механизмов межмолекулярных взаимодействий, процессов регуляции работы генов как вируса, так и организма хозяина.
Не только для широкого круга читателей, но и для многих специалистов необычным и малоизвестным подходом в этой области являются методы компьютерного моделирования, позволяющие реконструировать закономерности молекулярной эволюции и проводить своего рода виртуальные «эксперименты» как с отдельно взятыми молекулами, так и с молекулярно-генетическими системами. Благодаря этим методам можно выявить перспективные молекулярные мишени для создания лекарственных препаратов нового поколения против различных вирусных и бактериальных инфекций.
В лаборатории теоретической генетики ИЦиГ СО РАН компьютерные методы и подходы в эволюционной биологии и протеомики (науки о белках) активно развиваются в течение последних 15 лет. Одним из важнейших объектов исследований в настоящее время стал вирус гриппа А, точнее – гемагглютинин, один из его поверхностных белков.
Гемагглютинин – «абордажный крюк» вируса
Прежде чем перейти непосредственно к результатам компьютерного моделирования, необходимо ближе познакомиться со строением и «образом жизни» гриппозного вириона, особенно с его структурно-функциональными белковыми структурами.
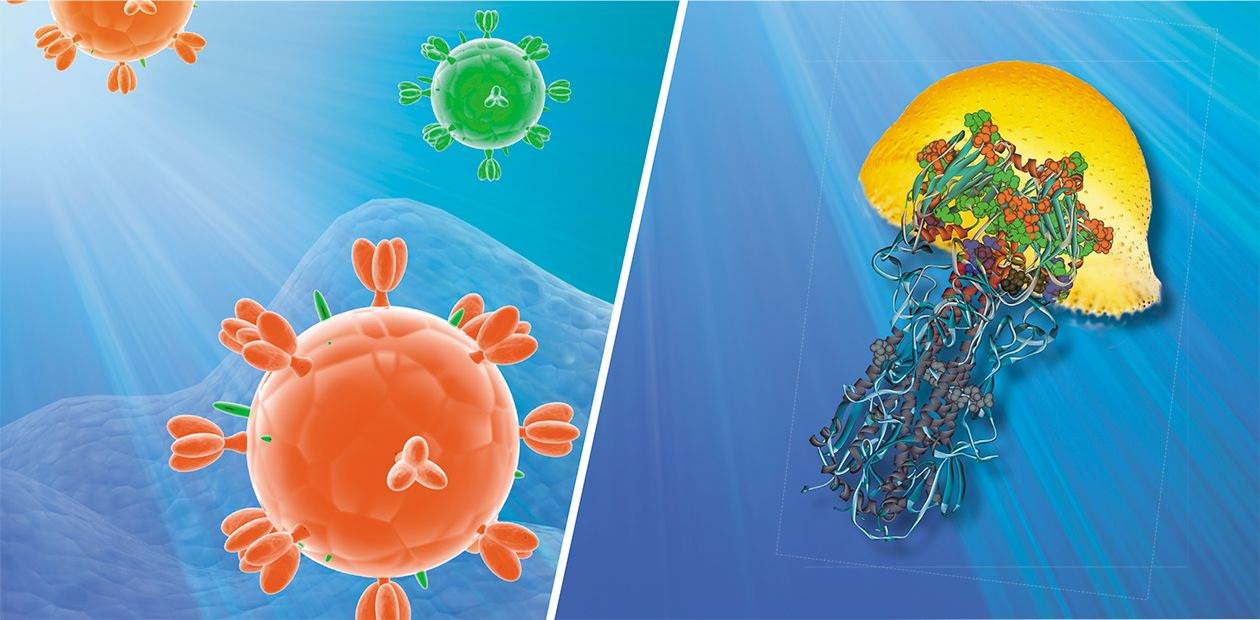
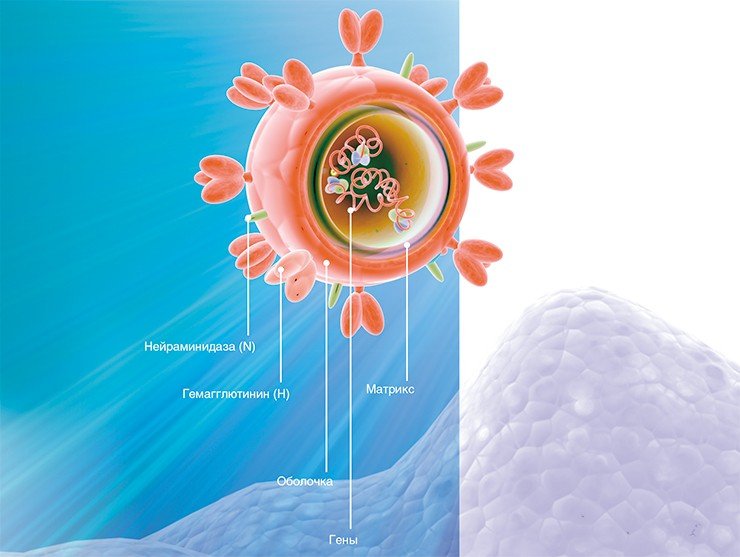
Генетический материал вируса защищен оболочкой из особого белка, вокруг которой располагается мембрана из липидов (жироподобных веществ). В ней удерживаются молекулы трех белков: гемагглютинина, нейраминидазы и белка М 2, формирующего особые ионные каналы. При помощи гемагглютинина вирус прикрепляется к клеточной мембране, а нейраминидаза ее разрушает, открывая вирусу путь внутрь клетки. Затем внутри вириона-захватчика благодаря ионным каналам изменяется кислотность среды (pH), чем создаются условия для освобождения генетического материала из вирусной капсулы.
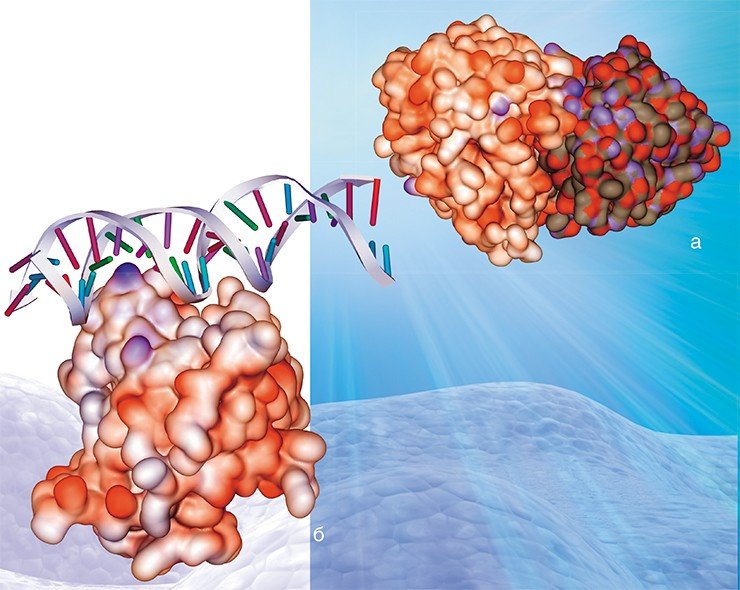
Таким образом, гемагглютинин играет одну из важнейших ролей при инфицировании вирусом клетки-мишени. На поверхности вирусной оболочки он присутствует в виде тримеров, т. е. комплексов из трех молекул. Каждая молекула, в свою очередь, состоит из двух субъединиц: одна обеспечивает первичный контакт с клеткой, вторая отвечает за слияние с клеточной мембраной. Процесс слияния также далеко не прост и сопровождается значительными перестройками самой молекулы гемагглютинина, в результате которых из внутренней части глобулы белка высвобождается «спрятанный» там особый пептид слияния.
Для инфицированного организма поверхностные белки вируса, включая гемагглютинин, представляют объект, требующий пристального внимания, поскольку являются антигенами – веществами, по которым иммунная система распознает инфекционного интервента. В вирусных белках можно выделить так называемые антигенные детерминанты – участки, с которыми предпочтительно связываются антитела, специфические защитные белки иммунной системы. Мутации, вызывающие структурные изменения в подобных местах, т. е. меняющие форму и расположение антигенных детерминант, как раз и приводят к образованию новых вирусных штаммов. Такие вирусы становятся практически «невидимыми» для антител, уже циркулирующих в крови зараженного организма, что делает его безоружным перед нашествием.
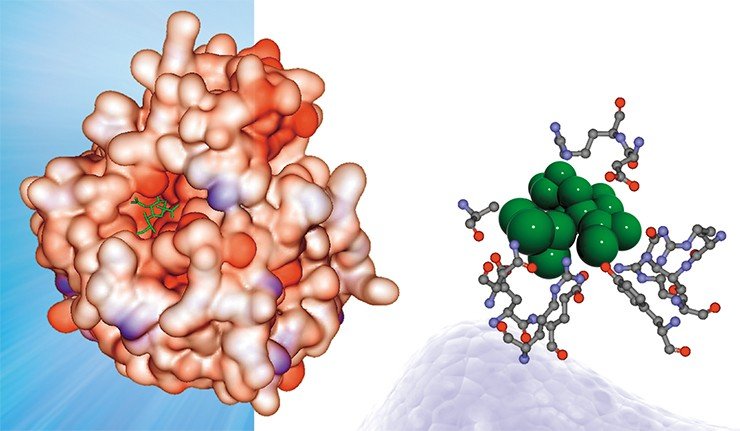
Мы предположили, что в ряду мутаций, защищающих вирусные белки от действия антител, помимо структурных могут существовать и другие. Речь идет о том, что в местах антигенных детерминант в результате мутаций появляются участки, с которыми могут связываться лиганды – молекулы или ионы, способные образовывать с белком комплексные соединения. В результате антитела инфицированного организма не могут взаимодействовать с подобными хорошо «защищенным» вирусными антигенами. Проверка этой гипотезы была осуществлена с применением разработанных в нашей лаборатории компьютерных методов молекулярного моделирования.
Что увидел компьютер
В принципе белковые молекулы могут взаимодействовать с другими молекулами самой разной природы: с макромолекулами, в числе которых могут быть белки или нуклеиновые кислоты, носители генетической информации; с низкомолекулярными соединениями; а также с различными ионами. И в этом смысле белки вирусов ничем не отличаются от белков других живых организмов, в том числе человека.
Подобные универсальные взаимодействия лежат в основе метаболических путей, транспортных молекулярных потоков, путей передачи сигналов... На поверхности белков находятся специальные места «посадки» молекул-лигандов – функциональные сайты, – которые своей уникальной структурой и обеспечивают специфическое связывание с этими молекулами.

А теперь давайте вернемся к нашему «герою» – гемагглютинину – и посмотрим результаты компьютерного анализа. Прежде всего отметим, что поверхность гемагглютинина в отличие от других белков в высокой степени обогащена местами посадки различных ионов. Более того — на ней присутствует большое число потенциальных мест такой посадки, которые могут превратиться в «действующие» сайты связывания уже в результате одиночной мутации, т. е. замены всего лишь одной пары нуклеотидов!
Возможно, именно эти свойства гемагглютинина позволяют вирусу гриппа с легкостью ускользать от нашей иммунной системы, обеспечивая его высокую эпидемичность. Аргументом в пользу этого соображения является тот факт, что выявленные участки связывания ионов практически перекрываются с участками расположения антигенных детерминант.
Как известно, антитела, выработанные в результате иммунного ответа на инфекцию, связываются с антигенными детерминантами, что приводит к нейтрализации вирусных частиц и их дальнейшему разрушению под действием иммунной системы. Очевидно, что связывание иона с антигенной детерминантой будет препятствовать образованию устойчивого комплекса антиген–антитело, в результате чего вирус будет «щитом» отгорожен от воздействия иммунной системы.
Подтверждением нашей гипотезы «ионного щита» вируса гриппа стала еще одна особенность, которую удалось обнаружить у гемагглютинина: предполагаемые сайты связывания ионов на его молекуле совпадают с уже известными участками, отвечающими за адаптивную молекулярную эволюцию этого белка.
Адаптивными обычно считаются такие мутации, которые повышают приспособленность несущего их организма. И действительно, мутации, повреждающие антигенные детерминанты, являются для вируса гриппа адаптивными. Одним из основных механизмов адаптивной эволюции поверхностного белка вируса гриппа, очевидно, как раз и является возникновение сайтов связывания ионов в этих важнейших для воспроизводства и выживания вируса участках. Результаты исследования недвусмысленно свидетельствуют, что новое поколение вакцин для нейтрализации вируса гриппа должно конструироваться с учетом возможного связывания ионов с поверхностным вирусным белком – крайне простого и эффективного механизма защиты вируса, основанного на результатах одиночных мутационных событий. Нельзя не учитывать и другие возможные последствия формирования «ионного щита»: например, заряженные частицы на поверхности вируса могут облегчать его слияние с клеточной мембраной и проникновение в клетку.
Высказанные нами предположения, позволившие сформировать новый взгляд на проблему механизмов защиты вирусов от атаки иммунной системы организма-хозяина, а также обнаружить новых молекулярных участников, задействованных в процессе проникновения вируса внутрь клетки, безусловно, требуют дальнейшего анализа и экспериментальной проверки.
Однако то, что ионы могут быть важными факторами, регулирующими жизненный цикл вируса гриппа, уже не вызывает сомнения. Как и то, что исследования подобных молекулярных механизмов будут содействовать открытию новых фармакологических мишеней и созданию эффективных вакцин и лекарственных препаратов.