Из личного дела описторхов
Долгое время возбудитель описторхоза – широко распространенного паразитического заболевания, вызванного потреблением инфицированной рыбы, изучался главным образом медиками и паразитологами. Однако современные молекулярно-генетические методы в сочетании с биоинформационными подходами позволяют получить принципиально новые данные о биологии и структурно-функциональной организации генома этого паразита, в том числе определить молекулярные основы его патогенной и канцерогенной активности. Это открывает широкие перспективы для разработки новых методов профилактики и лечения описторхоза
Описторхоз – это тяжелое паразитическое заболевание, с очаговым характером распространения, которое вызывается печеночными сосальщиками. Эти паразитические трематоды (иначе – плоские черви) принадлежат к семейству Opishtorchiidae. Интерес к описторхозу не случаен – он продиктован высокой социальной значимостью этого заболевания для нашей страны, особенно для Западной Сибири.
Здесь, в Обь-Иртышском речном бассейне, еще в 1929 г. был обнаружен крупнейший природный очаг описторхоза. И за прошедшие десятилетия эпидемиологическая ситуация ничуть не улучшилась: по данным Роспотребнадзора, в 2010 г. в нижнем течении Иртыша и среднем течении Оби было заражено до 90—95 % сельского населения, в том числе дети дошкольного возраста. Показатели заболеваемости в разных населенных пунктах этого очага превышают общероссийские в 3—28 раз (О санитарно-эпидемиологической обстановке…, 2008 г.).
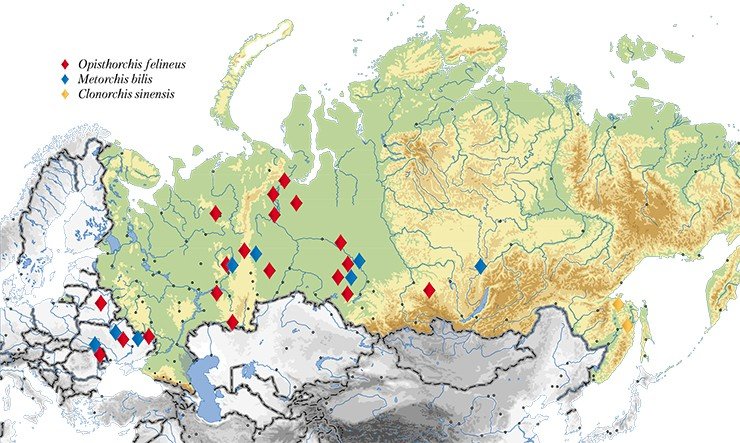
Кроме Обь-Иртышского бассейна среди неблагополучных по этому гельминтозу регионов числятся Казахстан, страны Восточной Европы и Юго-Восточной Азии. Кроме того, периодически описторхов обнаруживают на территориях, ранее полностью свободных от этого паразита: он расширяет свою область обитания, «захватывая» все новые районы.
Учитывая широкую географию распространения паразита, для специалистов представляет несомненный интерес выяснить, существуют ли генетические различия, характеризующие популяции из разобщенных зон его ареала. Эти, с первого взгляда, сугубо теоретические исследования имеют и выраженный прикладной аспект. Поскольку именно генетические отличия между паразитами могут обусловливать такие значимые медицинские характеристики, как разнообразие клинических проявлений заболевания, разную вероятность формирования лекарственной устойчивости у паразита, а также его различную иммуногенность (способность вызывать наработку специфических антител). Все эти сведения будут полезны для прогнозирования течения заболевания и формирования иммунного ответа у зараженного человека, а также для разработки диагностических средств и создания вакцин.
Именно такое комплексное исследование проблемы описторхоза и его возбудителей проводится с 2005 г. в Институте цитологии и генетики СО РАН (Новосибирск). Работа по анализу популяционно-генетической структуры гельминтов началась с формирования уникальной коллекции описторхов из разных географических зон – Западной Сибири, европейской части России и Северного Казахстана. На сегодня в ней представлено около 300 образцов Opisthorchis felineus – основного возбудителя описторхоза в нашей стране, и около 300 других видов описторхид, включая эпидемиологически значимые.
Метод как основа
 Для оценки генетического разнообразия гельминтов из разных мест обитания был использован метод сравнительного анализа геномных маркеров, в качестве которых выступают фрагменты ДНК. Этот метод, широко использующийся в современной молекулярной биологии, позволяет достаточно надежно судить о степени родства как отдельных индивидов, так и их групп. Поэтому его используют для определения близкородственных видов и реконструкции их эволюционной истории.
Для оценки генетического разнообразия гельминтов из разных мест обитания был использован метод сравнительного анализа геномных маркеров, в качестве которых выступают фрагменты ДНК. Этот метод, широко использующийся в современной молекулярной биологии, позволяет достаточно надежно судить о степени родства как отдельных индивидов, так и их групп. Поэтому его используют для определения близкородственных видов и реконструкции их эволюционной истории.
В качестве собственно маркеров обычно выступает не вся последовательность выбранного участка ДНК, а имеющиеся в ней однонуклеотидные полиморфизмы, т. е. одиночные «буквы» генетического кода, которые могут различаться у сравниваемых последовательностей ДНК. Частота возникновения таких однонуклеотидных замен (мутаций) по случайным причинам очень низка и составляет лишь ~10–8—10–12 на клетку за поколение. Поэтому в качестве геномных маркеров выбирают участки генома с высокой скоростью накопления мутаций, а это характерно для тех из них, которые по тем или иным причинам не попадают под действие отбора, т. е. селективно нейтральны.
Этому требованию отвечают не кодирующие белок последовательности ядерной ДНК, а также собственная ДНК клеточных органелл – митохондрий. Последняя наследуется строго по материнской линии с цитоплазмой яйцеклетки и не участвует в рекомбинационном процессе (обмене участками хромосом при клеточном делении). Скорость накопления нейтральных мутаций в митохондриальных генах в 5—10 раз выше, чем в генах ядерной ДНК.

Принято считать, что число накопленных однонуклеотидных замен в селективно нейтральных участках ДНК линейно зависит от времени. Следовательно, произведя подсчеты этих замен, можно получить приблизительную датировку эволюционных событий.
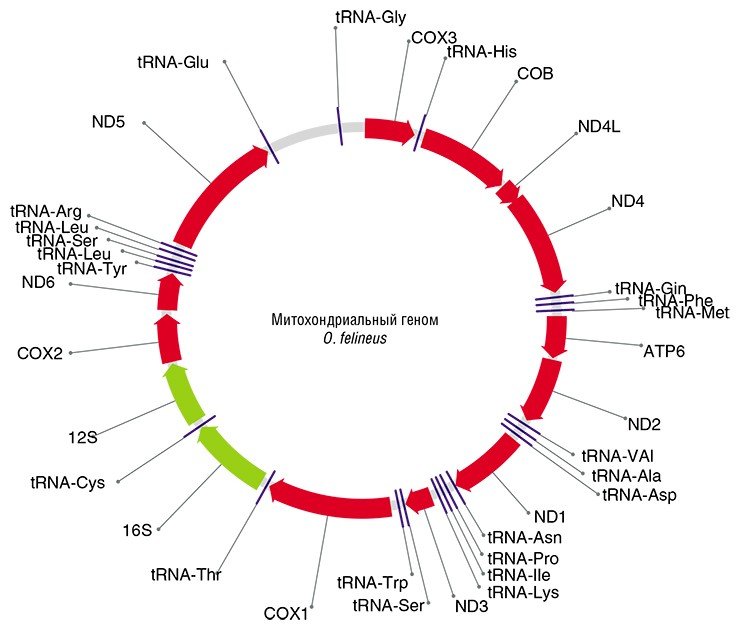
 Чтобы обнаружить видоспецифичные геномные маркеры, геном сначала нужно секвенировать («прочитать» нуклеотидную последовательность). Поэтому первоочередной задачей исследователей стало секвенирование некоторых фрагментов ядерной ДНК и полного митохондриального генома O. felineus, что было сделано в ИЦиГ СО РАН в ходе выполнения комплексного проекта по исследованию описторхид.
Чтобы обнаружить видоспецифичные геномные маркеры, геном сначала нужно секвенировать («прочитать» нуклеотидную последовательность). Поэтому первоочередной задачей исследователей стало секвенирование некоторых фрагментов ядерной ДНК и полного митохондриального генома O. felineus, что было сделано в ИЦиГ СО РАН в ходе выполнения комплексного проекта по исследованию описторхид.
В результате было найдено восемь подходящих генетических маркеров, из них три (два митохондриальных и один ядерный) были выбраны для генотипирования коллекционных образцов описторхид. Нужно добавить, что хотя в последнее десятилетие аналогичные маркеры использовались при исследованиях популяционной структуры и филогеографии других паразитических трематод в Европе, Восточной и Юго-Восточной Азии, Африке, и Америке, исследования такого рода в отношении O. felineus ранее не проводились.
«Бутылочное горлышко» оледенения
С помощью разработанных в ИЦиГ СО РАН геномных маркеров удалось навести «порядок» в семействе описторхид, куда входят два близкородственных вида – вышеупомянутый O. felineus и Сlonorchis sinensis, вызывающий клонорхоз, очень схожее с описторхозом заболевание. Оказалось, что расхождение от гипотетического общего предка этих двух видов произошло примерно 3 млн лет назад.
Последующая эволюционная история O. felineus, по-видимому, была весьма драматичной. Дело в том, что ранее было высказано предположение о существовании трех подвидов описторха – сибирского, казахского и восточно-европейского, обитающих соответственно в Обь-Иртышском и Енисейском, Нура-Сарысукском, Волжском, Донском и Уральском речных бассейнах (Беэр, 2005). Поэтому ожидалось, что коллекционные образцы из столь разнесенных в пространстве популяций продемонстрируют заметные генетические различия, поскольку экологически условия обитания также значительно разнятся. Но вопреки предположениям исследованные выборки описторхов характеризовались крайне низким генетическим разнообразием, в отличие от других уже изученных видов трематод (Брусенцов и др., неопубликованные данные).
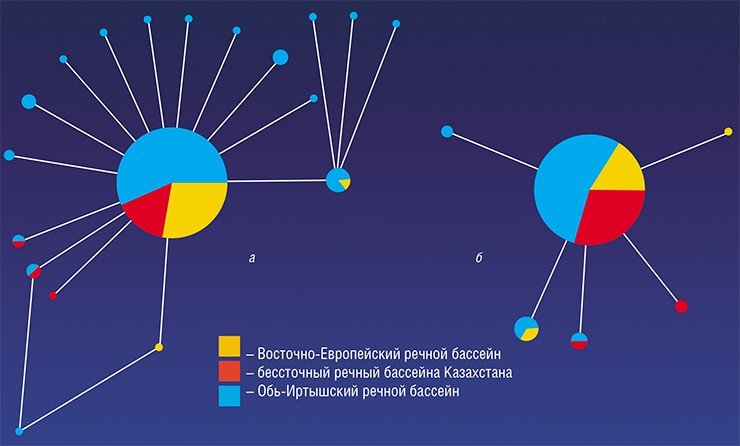
Что же послужило причиной такого удивительного генетического однообразия описторхов? Очевидно, оно явилось следствием резкого сокращения численности единственной предковой популяции O. felineus, уцелевшей в Евразии после волны плейстоценовых оледенений. Оледенения сопровождались уменьшением мест обитания промежуточных хозяев описторха – пресноводных моллюсков и рыб, и снижением их зараженности, которая в то время составляла не больше 2 % (Беэр, 2005). Такое явление – прохождение популяции сквозь фазу критически низкой численности известно под образным названием «бутылочное горлышко»; следствием его обычно бывает резкое обеднение популяционного генофонда.
 С наступлением потепления и формированием новых речных бассейнов последовало восстановление численности предковой популяции. Согласно расчетам, 21—25 тыс. лет назад в истории вида начался (и продолжается до сих пор) период демографического взрыва, которому, вероятно, в немалой степени способствовал факультативно гермафродитный способ размножения описторха.
С наступлением потепления и формированием новых речных бассейнов последовало восстановление численности предковой популяции. Согласно расчетам, 21—25 тыс. лет назад в истории вида начался (и продолжается до сих пор) период демографического взрыва, которому, вероятно, в немалой степени способствовал факультативно гермафродитный способ размножения описторха.
Нужно заметить, что у вышеупомянутых других видов трематод с аналогичным способом размножения было выявлено значительно более высокое генетическое разнообразие. Однако относительная «обедненность» генофонда O. felineus не помешала этому виду восстановить и успешно расширить свой ареал.
К сожалению, проведенное исследование не дает возможности точно указать локализацию предковой популяции и проследить пути расселения паразита. Но, учитывая сложный жизненный цикл O. felineus, представляется очевидным, что направление и скорость его экспансии определялись миграционными способностями его хозяев. Тот факт, что описторхоз сегодня распространен только в некоторых географических зонах, во многом обусловлен средовыми предпочтениями его первого промежуточного хозяина – пресноводных моллюсков битиний, которые в морской воде погибают. Однако одним из окончательных хозяев описторха является человек, для которого географические изолирующие барьеры практически отсутствуют.
В одной пробирке
С помощью метода генетических маркеров удалось решить и актуальную медицинскую задачу точной видовой идентификации описторхид. Дело в том, что, наряду с описторхом, в России, а также в Казахстане и странах Восточной Европы встречается еще один эпидемиологически значимый вид – меторх (Мetorchis bilis). А на Дальнем Востоке – еще и клонорх (C. sinensis), о котором упоминалось выше, обычный для стран Юго-Восточной Азии.
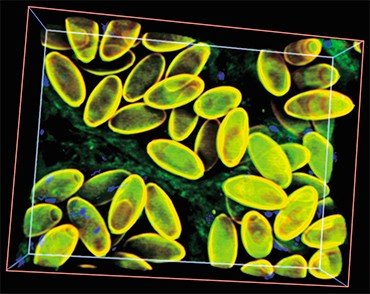
Все эти трематоды вызывают заболевания с очень сходной клинической картиной, поэтому на основе одних лишь симптомов врач не может поставить точный диагноз. Под микроскопом же яйца этих гельминтов практически неразличимы между собой, так что результат микроскопического анализа фекалий или содержимого двенадцатиперстной кишки, взятого при дуоденальном зондировании, во многом зависит от квалификации лаборанта. Ситуацию усугубляет возможность одновременного заражения разными видами описторхид.
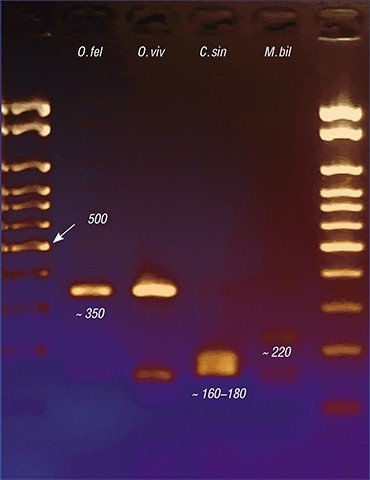
Сегодня наиболее точной является ДНК-диагностика трематодозов. За рубежом такие эффективные тест-системы начали интенсивно разрабатываться еще в 1990-е гг. Российские ученые начали подобную работу позже, но в последние годы и у нас, в частности в ИЦиГ СО РАН, активно идет процесс создания ПЦР-дигностикумов, с помощью которых можно выявлять в лабораторном материале генетические фрагменты, строго специфичные для определенного вида возбудителя. Поскольку метод позволяет использовать одновременно генетические маркеры на разных гельминтов, для точной диагностики паразитических агентов достаточно одного анализа.
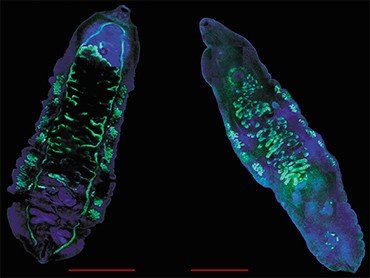 Установление вида паразита может иметь большое значение. Например, оно позволяет определить источник и место заражения. Но самое главное – возбудители описторхоза – меторхоза и клонорхоза различаются по ряду биологических характеристик, что может влиять на течение и прогноз заболевания, возникновение осложнений и степень чувствительности паразитов к лекарственным препаратам.
Установление вида паразита может иметь большое значение. Например, оно позволяет определить источник и место заражения. Но самое главное – возбудители описторхоза – меторхоза и клонорхоза различаются по ряду биологических характеристик, что может влиять на течение и прогноз заболевания, возникновение осложнений и степень чувствительности паразитов к лекарственным препаратам.
Так, недавно в эксперименте на золотистых хомячках было показано, что два вида описторхид – наш O. felineus и O. viverrini, встречающийся в странах Юго-Восточной Азии, различаются по агрессивности воздействия на организм хозяина (Lvova et al., 2012). Кстати сказать, в той же Юго-Восточной Азии помимо высокопатогенной O. viverrini широко распространена еще одна похожая трематода – Haplorchis taichui, заражение которой не вызывает тяжелого заболевания (Lovis et al., 2009). Этот пример показывает, насколько важна дифференциальная диагностика трематодозов для назначения адекватного лечения.
Кроме того, даже при низкой степени зараженности хроническая инвазия описторхидами может приводить к серьезным последствиям для здоровья. Однако, как правило, врачи бессильны обнаружить яйца описторхид в лабораторном материале таких пациентов с помощью обычной световой микроскопии, и диагноз зачастую ставится только посмертно (Müller et al., 2007). ПЦР-диагностика же является в этом случае гораздо более чувствительным методом.
 Итак, несмотря на свою драматическую эволюционную историю, паразитическая трематода O. felineus не только выжила, но, даже потеряв часть своего генофонда, сегодня является весьма процветающим видом с высокими адаптационными способностями, в том числе высокой инвазионностью – способностью внедряться в организм хозяина.
Итак, несмотря на свою драматическую эволюционную историю, паразитическая трематода O. felineus не только выжила, но, даже потеряв часть своего генофонда, сегодня является весьма процветающим видом с высокими адаптационными способностями, в том числе высокой инвазионностью – способностью внедряться в организм хозяина.
Разработанные новосибирскими учеными наборы для ПЦР-диагностики описторхоза прошли стадию лабораторных испытаний, сейчас завершается их тестирование на клиническом материале. С их помощью уже удалось успешно выявить у группы пациентов случаи смешанных трематодных инвазий (Brusentsov et al., 2010), что, несомненно, говорит о необходимости их включения в арсенал методов лабораторной диагностики описторхоза. Ведется разработка производственной технологии выпуска диагностикумов.
Тем не менее методы ДНК-диагностики гельминтозов еще не стали рутинной медицинской практикой. Пока наиболее широко распространена серологическая диагностика, в частности, иммуноферментный анализ (ИФА), для которого производится ряд коммерческих наборов. Принцип этого метода основан на выявлении в сыворотке крови пациента антител, специфичных к антигенам паразита. Слабым местом ИФА являются его низкая чувствительность и специфичность: он плохо работает в случае небольшой концентрации антител; также можно получить и ложноположительный результат, если диагностический антиген прореагирует с молекулярной мишенью, не являющейся «нужным» антителом.
Повысить точность ИФА можно путем клонирования генов, кодирующих специфичные для описторха антигены. В ИЦиГ СО РАН уже получены такие генно-инженерные белки-антигены О.felineus, пригодные для создания диагностикумов нового поколения. Их можно использовать для детекции даже незначительного количества специфических антипаразитарных антител в сыворотке крови. Однако в медицинскую практику такие ИФА-диагностикумы поступят еще не скоро.
КОММЕНТАРИЙ СПЕЦИАЛИСТАНужно отметить, что получение нового диагностического инструмента – это далеко не единственный среди всех возможных практический выход этого проекта. Полученные в ходе проекта знания о молекулярно-генетическом разнообразии паразита в дальнейшем должны стать основой для выявления терапевтических мишеней лечения описторхоза – проблемы, еще более актуальной, чем его точная диагностика. Ведь сейчас при медикаментозной терапии описторхоза практически используется единственный препарат – празиквантель, который имеет ряд негативных побочных эффектов.
Но, безусловно, нельзя умалять и значение нового, высокоспецифичного и чувствительного метода, благодаря которому врач может точно выявить возбудителя заболевания и своевременно назначить соответствующее лечение. Используемые сегодня для диагностики описторхоза методы копроовоскопии (анализ кала на яйца глистов) требуют высокого уровня подготовки лаборантов, и специалистов такого уровня действительно мало. ДНК-диагностика требует более сложного оборудования, но при этом позволяет уменьшить влияние на результат “человеческого фактора”. Для широкого применения ДНК-диагностики требуется решить задачу выделения ДНК из клинического материала (фекалий). Эта проблема тоже была решена в ходе выполнения проекта.
Безусловно, существуют методы выявления антител к описторхозу методом ИФА. Но не совсем корректно сравнивать два разных метода диагностики – ПЦР и ИФА, которые, по сути, являются (или должны стать) составляющими одного диагностического процесса. ИФА в большей степени подходит для контроля лечения, поскольку позволяет вести мониторинг активности иммунной системы, ПЦР же – для скрининга, первичного выявления заболевания.
Важность наличия точного диагностического инструмента в том, что во многих случаях описторхоз протекает бессимптомно. А поскольку доказано, что одним из тяжелейших последствий описторхоза может быть холангиокарцинома – злокачественная опухоль желчных протоков, то населению эндемичных очагов описторхоза желательно регулярно обследоваться на наличие паразитов, а в случае заболевания – в обязательном порядке проводить дегельминтизацию.
Сибирского государственного медицинского университета (Томск)
Внедрение новых диагностических технологий, несомненно, повлияет на качество лечения и продолжительность реабилитации пациентов. Этому есть много примеров, наиболее яркие из которых связаны с диагностикой бактериальных инфекций, перешедшей из чашек Петри в пробирки для ПЦР. Новые технологии не отменят традиционные, но позволят намного повысить чувствительность и точность анализов, особенно в сложных клинических случаях.
Литература
Юрлова Н. И. Обская болезнь описторхоз // Наука из первых рук. 2008. №2 (20). С. 12—21.
Пальцев А. И. Системному заболеванию – системный подход // Наука из первых рук. 2008. №2 (20). C. 22—27.
Колчанов Н. А., Мордвинов В. А. Паразитоз от А до Т // Наука из первых рук. 2008. №2 (20). C. 28—41.
Беэр С. А. Биология возбудителя описторхоза. КМК, 2005. 336 с.
Брусенцов И. И., Катохин А. В., Сахаровская З. В. и др. ДНК-диагностика микст-инвазий Opisthorchis felineus и Metorchis bilis с помощью метода ПЦР // Медицинская паразитология и паразитарные болезни. 2010. № 2. С.10—13.
Менявцева Т. А., Ратнер Г. М., Стручкова С. В. и др. Иммуноферментный анализ в диагностике описторхоза. Сообщение 1. Разработка иммуноферментного метода определения IgM - антител к описторхозному антигену // Медицинская паразитология и паразитарные болезни. 1996. № 1. С. 41—43.