Кому нужен прогноз по клещевому энцефалиту?
В июне 2007 г. главный санитарный врач России Г. Онищенко объявил о начале самой сильной за последние пять лет эпидемии клещевого энцефалита в нашей стране. В список потенциально опасных, помимо «традиционных» Сибири и Дальнего Востока, попало более 40 районов. Ситуация осложняется тем, что большинство региональных представителей власти заранее не позаботилось о необходимом запасе иммуноглобулина — практически единственного специфического лекарственного средства против этого действительно смертельного вирусного заболевания.
Читая тревожные новости о росте числа укушенных и заболевших, невольно ловишь себя на мысли, что речь идет о каком-то внезапном буйном разгуле стихий, сходным даже не с налетом очередного тайфуна (о его приближении метеорологи часто успевают предупредить), а с цунами, вызванным неожиданным землетрясением в непостижимых океанских глубинах… Но ведь возбудитель и переносчик инфекционного воспаления мозга, названного клещевой энцефалит, были открыты Дальневосточной экспедицией Наркомздрава СССР под руководством выдающегося вирусолога Л.А. Зильбера* еще в 30-х гг. прошлого века! Почему же тогда спустя 70 лет вспышка весенне-летнего клещевого энцефалита воспринимается как коварное и непредсказуемое природное явление?
Основатели первого в истории нашей страны города фундаментальной науки и образования — Новосибирского академгородка — выбрали для его строительства прекрасное место: со смешанными сосново-березовыми лесами, полянами огненных жарков, рукотворным Обским морем. Пожалуй, единственным недостатком было обилие клещей, что влекло за собой и высокий риск инфицирования людей и животных болезнетворными агентами разной природы, включая вирус энцефалита и боррелии, переносимых этими членистоногими.
Но в те «благословенные» времена к решению всех подобных проблем привлекался проверенный помощник: силы малой авиации. И тогдашние дети, знать не знавшие слова «клещ» или «энцефалит», радостно бегали по окрестным лесам, собирая душистую землянику, щедро приправленную дихлордифенилтрихлорэтаном (ДДТ) — одним из самых экологически опасных инсектицидов, способных накапливаться, в том числе, в тканях печени, почек и мозга человека.
В конце 1970-х масштабные обработки городских лесов ядохимикатами были прекращены. Членистоногие отреагировали адекватно: их численность стала увеличиваться; соответственно росло число укушенных и заболевших людей. Летом 1980 г. распоряжением Президиума Сибирского отделения АН СССР была сформирована Комплексная программа исследований клещевого энцефалита (КЭ) под руководством В. И. Евсикова и А. В. Кушнира — директора и зам. директора Биологического института (сегодня — Институт си-стематики и экологии животных СО РАН). Одним из пунктов этой программы стал мониторинг состояния основных компонентов природного очага в лесопарковой зоне Новосибирского научного центра.

Первые, наиболее трудные, шаги по организации регулярных наблюдений были выполнены специалистами Биологического института — вирусологом Н. Н. Харитоновой и акарологом (специалистом по клещам) В. Ф. Сапегиной. Профессиональный опыт и интуиция позволили ученым выделить ключевые участки лесопарковой зоны и очертить круг основных параметров наблюдения, что на многие годы задало вектор мониторинга системы «вирус-хозяин-переносчик».
Не встречайтесь с «чужим» паразитом
Выбор методических подходов к исследованию системы передачи инфекции опирался на опыт изучения природных очагов КЭ, накопленный к тому времени, главным образом, советской наукой. Как известно, вирус КЭ может жить и размножаться в организмах разных животных, но в передаче вируса от зараженной к незараженной особи ключевую роль играют естественные переносчики — два вида иксодовых клещей: таежный (Ixodes persulacatus Schulze) и лесной (Ixodes ricinus L.).
На Урале, в Сибири и на Дальнем Востоке распространен только первый из них. В целом у клещей рода Ixodes сложный цикл развития, включающий в себя три стадии. На каждом этапе своей жизни клещ вместе с кровью хозяина, может либо сам получить вирус КЭ и других возбудителей трансмиссивных инфекций, либо, наоборот, заразить хозяина вирусом через секрет своих слюнных желез.

Важно отметить, что у естественных прокормителей клеща заражение вирусом КЭ не вызывает обычных клинических симптомов, что и неудивительно: ведь совместная эволюция паразита (в широком смысле этого слова) и его хозяина чаще всего идет в направлении уменьшения негативного воздействия паразита на организм хозяина (Thompson, 1994). Трагические последствия контакта человека с вирусом энцефалита во многом объясняются тем, что он, по большому счету, является «новичком» в данной «паразит-хозяинной» системе.
Знаете ли вы, что у млекопитающих вирус клещевого энцефалита может передаваться половым путем? По крайней мере, такое явление было обнаружено при скрещивании зараженных самцов лабораторных мышей со здоровыми самками (Герлинская и др., 1997)С учетом жизненного цикла клеща и его связей в биологическом сообществе исследователями были выбраны основные объекты и методы мониторинга. Оценивались обилие и степень зараженности вирусом КЭ взрослых клещей; численность и степень зараженности клещами мелких млекопитающих, а также наличие среди этих особей так называемых серопозитивных, т. е. содержащих в крови антитела к вирусу клещевого энцефалита.
Кроме того, с самого начала велось изучение биологической активности вируса, выделенного от взрослых особей таежного клеща, а с 1990 г. стали производиться оценки иммунитета фоновых видов грызунов — основных прокормителей клеща на ранних стадиях его развития. Параллельно, в совместных исследованиях сотрудников ИСиЭЖ и Института химической биологии и фундаментальной медицины СО РАН на собранном полевом материале были разработаны и апробированы молекулярно-биологические методы для высокочувствительной и специфичной индикации вируса КЭ (Бахвалова и др., 1989; Бахвалова, 1994; Morozova et al., 2002).

За 27 лет непрерывного мониторинга были изучены особенности распределения и многолетней динамики таежного клеща в лесопарковой зоне Новосибирского научного центра, видовой состав мелких млекопитающих (Сапегина и др., 1985; Добротворский, 1992); сформирована уникальная коллекция штаммов ВКЭ, которые на основании нуклеотидных последовательностей были отнесены к сибирскому генетическому типу (Бахвалова и др., 1994, 2000, 2001; Bakhvalova et al., 2000).
Инкубатор для инфекции
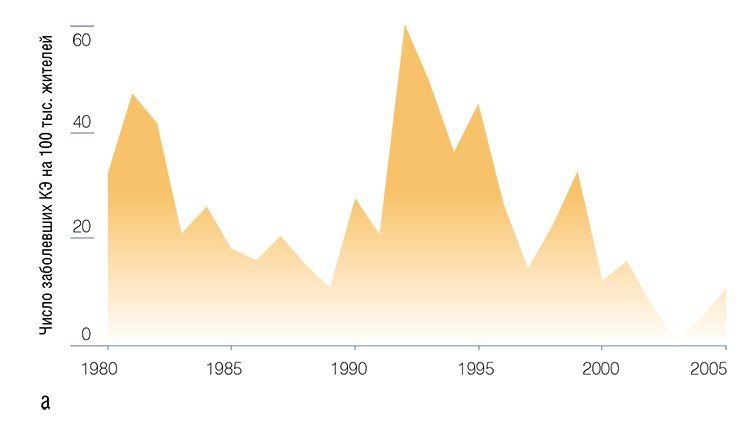
Уже после 10 лет наблюдений над исследуемым энцефалитным очагом обнаружились вещи, не укладывающиеся в общепринятые схемы. Казалось бы, что может служить мерилом инфекционного риска, как не численность клещей и степень их зараженности вирусом? Однако привычные критерии энцефалитоопасности далеко не соответствовали реальности, выражающейся в динамике заболевания энцефалитом жителей Советского района г. Новосибирска, где и расположен Академгородок.
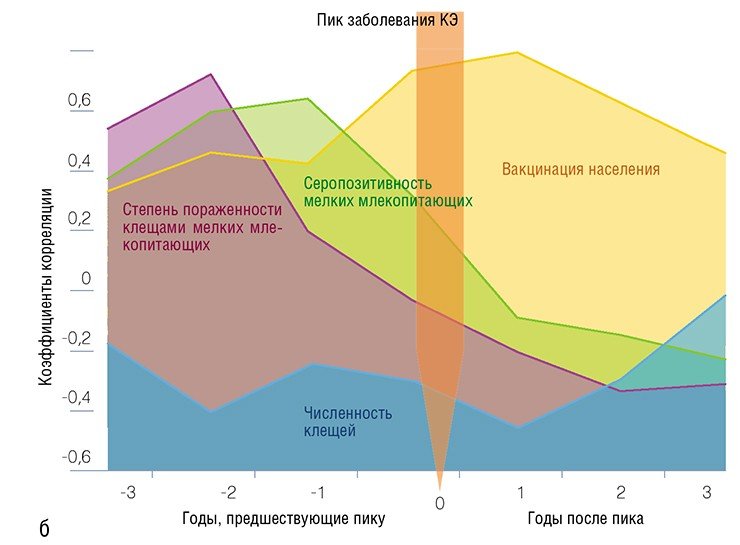
Вместе с тем удалось установить, что за 1—2 года до возникновения пика заболеваемости людей на коже мелких млекопитающих обнаруживается максимально большое количество личинок и нимф — ранних стадий таежного клеща; при этом среди прокормителей клещей велика доля серопозитивных особей, т. е. зверьков, в крови которых содержатся антитела к вирусу клещевого энцефалита. Какие последствия могут иметь эти два взаимосвязанные события?
Как известно, переживание и размножение вируса в организме самих клещей приводят к снижению вирулентности, т. е. способности вируса вызывать заболевание. Однако данное свойство быстро восстанавливается, если вирус попадает в организм теплокровного животного, где и начинает размножаться (Чунихин и др., 1982). Поэтому, когда доля зараженных особей среди мелких млекопитающих увеличивается, резко возрастает вероятность того, что личинки и нимфы клеща во время своей кровавой трапезы получат и высоковирулентный штамм возбудителя болезни. Через 1—2 года эти личинки и нимфы превратятся во взрослых клещей, в организме которых будет функционировать наиболее «агрессивный» вирус: их укус и представляет для нас наибольшую опасность в смысле заражения энцефалитом.
Тот факт, что динамика заболеваемости людей во многом определяется изменениями именно самого вируса, был подтвержден исследованиями его инфекционных свойств: гемаглютинирующей активности (ГА) и вирулентности вирусных изолятов, выделенных в разные годы. Оказалось, что многолетние колебания ГА совпадают с колебаниями заболеваемости жителей Советского района; а вирулентность изолятов, полученных в годы высокой заболеваемости, достоверно выше таковой по сравнению с изолятами, выделенными при низком уровне заболеваемости (Бахвалова, 1994; Бахвалова, Добротворский, 1994; Мошкин и др., 1998; Бахвалова и др., 2005).
Итак, проведение в течение нескольких лет мониторинга отдельных компонентов энцефалитного очага на основе относительно простых параметров — степени зараженности мелких млекопитающих клещами и вирусом клещевого энцефалита — позволяет довольно точно предсказывать пресловутые энцефалитные «эпидемии». Но это предсказание, хотя и вполне достаточное для прогнозирования инфекционного риска, является довольно упрощенным описанием действительности. В последние годы, благодаря развитию молекулярно-генетических методов определения возбудителей болезней, произошла переоценка роли мелких млекопитающих в циркуляции клещевых инфекций. Что же удалось узнать об этом вечном, как мир, и, похоже, неиссякаемом природном резервуаре инфекций?
Тестостероновый детонатор
Судя по результатам мониторинга, динамика энцефалитоопасности природного очага в значительной мере определяется изменениями популяции вируса. Эти изменения, в свою очередь, обусловлены различной величиной вклада в воспроизводство вируса его основными «хозяевами» — таежным клещом и теплокровными прокормителями.
В частности, в совместных исследованиях с ИХБФМ было установлено, что вирусные РНК и/или белок оболочки вириона клещевого энцефалита (свидетельствующие о наличии вируса) обнаруживаются в органах подавляющего большинства мелких млекопитающих (Бахвалова и др., 2001; Бахвалова и др., 2003; Bakhvalova et al., 2006). Причем подобное явление характерно не только для зверьков, отловленных в сезон активности клещей, но также и для пойманных зимой или в течение длительного времени после отлова удерживаемых в виварии, т. е. заведомо «свободных» от клещей. Это означает, что в организме диких млекопитающих вирус может долго сохраняться в персистирующем (переживающем) состоянии, как правило, никак себя не проявляя. По крайней мере, он не способен заразить двухнедельных лабораторных мышей, обычно восприимчивых к данному вирусу.

Оказалось, что клещ, свободно перемещающийся по краю чашки Петри, не реагирует на свежую мочу лабораторной мыши (Ромащенко и др., 2006) или красной полевки (по личному сообщению А. К. Добротворского). Однако, если вместо этого ему «предъявить» подстилку из мышиной клетки со старыми (около 2—3 суток) мочевыми метками, то в 60 % случаев у подопытных клещей отмечается поведенческая реакция, выражающаяся в стремлении достичь источника запаха. Следует отметить, что реакция клеща на образцы пота молодых мужчин, собранные на фильтровальную бумагу, также зависит от свежести этих образцов.
Наиболее привлекательным для клеща является запах пота из подмышечной области, причем самая сильная реакция отмечается в том случае, когда фильтровальная бумага находилась под одеждой донора в течение 2 суток. Повышение ольфакторной привлекательности «несвежих» образцов пота и мочи может быть следствием их бактериальной трансформации
Однако так бывает не всегда. Как показали наши исследования, такой персистирующий вирус может активизироваться при подавлении иммунной системы хозяина. Причем сделать это можно не только с помощью специальных фармакологических иммуносупрессоров, но и путем введения обычного мужского полового гормона — тестостерона (Бахвалова и др., 2006).
И последнее обстоятельство, как все понимают, особенно значимо: дело в том, что естественный подъем секреции мужских половых гормонов у млекопитающих, в том числе и у грызунов, приурочен к сезону размножения. И сочетается с подавлением клеточного и гуморального иммунитета особей. Более того — этот период очень точно совпадает по времени и с периодом наибольшей активности клещей.

Еще один нюанс: в экологии отношений «паразит-хозяин» существует правило, согласно которому 20 % наиболее зараженных хозяев дают «приют» 80 % паразитов того или иного вида (Perkins et al., 2003). Согласно нашим данным, распределение по степени зараженности клещами особей красных полевок (Clethrionomys rutilus Pall.), обитающих в исследуемом очаге КЭ, полностью соответствует этому правилу. Возникает естественный вопрос: что же это за особи?
Как известно, в популяции мелких млекопитающих особи значительно различаются по таким поведенческим характеристикам, как агрессивность и территориальность. Эта разнокачественность определяется в основном различиями в секреции половых гормонов, а значит, как упоминалось выше, и соответствующими различиями в иммунной системе животных. От этого состояния особей и зависит величина вклада, который они вносят в прокормление таежного клеща.
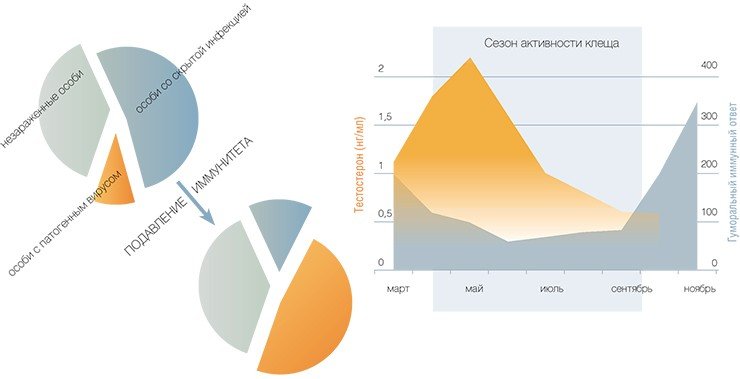
Что же удалось выяснить? Среди наиболее зараженных особей преобладают половозрелые оседлые самцы, у которых величина гуморального иммунного ответа на стандартный антигенный стимул минимальна. По сравнению с расселяющимися мигрантами территориальные самцы характеризуются большей степенью зараженности, что, на первый взгляд, противоречит общепринятым представлениям о прямой связи между подвижностью животных и вероятностью их встречи с эктопаразитами.
Знаете ли вы, что в начальной стадии заражения вирус клещевого энцефалита вызывает у самцов грызунов рост агрессивности, а также запаховой привлекательности для самок? Таким образом, у этих особей увеличивается шанс оставить потомство (Moshkin et al., 2002)Но это кажущееся несоответствие. Во-первых, общая активность самцов, патрулирующих свою индивидуальную территорию, может быть не ниже, чем у мигрантов. Во-вторых, экспериментально доказано, что подавление иммунитета хозяина, в том числе с помощью введения тестостерона, увеличивает время и эффективность прокормления клещей (Hughes, Randolf, 2001). И наконец, запах мочевых меток, которые территориальный самец постоянно оставляет на одних и тех же маршрутах, для клещей может являться более мощным «магнитом», чем эпизодические выделения мочи расселяющимися особями: это означает, что вероятность встретить «добычу» на этом участке велика!
Как птица Феникс
Данные, полученные в результате почти беспрецедентного по длительности и охвату мониторинга эпидемиологического очага, свидетельствуют о том, что существует довольно точная временная координация сезонных циклов между собой, протекающих в популяциях организмов — паразитов и хозяев, благодаря чему в природе обеспечивается устойчивое существование очага клещевого энцефалита.
В популяциях мелких млекопитающих зимний период переживают только те особи, которые родились в конце лета и не размножались в год своего рождения (Шварц и др., 1969). Важнейшим фактором их зимней выживаемости является надежный иммунитет, который не был «расшатан» участием в процессах воспроизводства, требующих, как известно, больших ресурсных затрат. Даже если вирус клещевого энцефалита попадет в кровь такой здоровой особи, он не сможет долго в ней циркулировать, однако успешно «перезимует» в ее органах и тканях в латентном состоянии.
Его черед наступает весной, когда во время полового созревания концентрация тестостерона в крови мелких млекопитающих резко увеличивается, а иммунная система, соответсвенно, подавляется. Одновременно с активацией вируса в теле грызунов, в лесной подстилке активизируются клещи, которые особенно агрессивно нападают на половозрелых территориальных самцов. Совместное питание множества клещей, паразитирующих на одном хозяине, создает режим наибольшего благоприятствования для обмена вирусом между живым «кафетерием» и клещами. Причем обмен между клещами, «трапезничающими» в непосредственной близости друг от друга, может осуществляться практически напрямую — даже не через кровь хозяина (Labuda et al., 1997; Randolph et al., 1999; Rosa et al., 2003).
Эта древняя, сформировавшаяся в результате длительной эволюции, система «паразит-хозяин» существовала, существует и просуществует до тех пор, пока не будут окончательно закатаны в асфальт живая лесная подстилка, поляны жарков и душистая земляника…
В заключение еще раз перечислим некоторые из основных научных результатов, полученных на экспедиционной базе Новосибирского научного центра. Итак:
- Впервые установлено, что наибольшую ценность для прогнозирования инфекционного риска имеют показатели, отражающие интенсивность взаимодействия теплокровных хозяев с клещами и вирусом клещевого энцефалита.
- Впервые показано, что основной причиной межгодовых колебаний энцефалитоопасности природного очага КЭ может быть временная изменчивость инфекционных свойств вирусной популяции.
- Благодаря молекулярно-генетическому детектированию вируса КЭ удалось оценить реальные масштабы вирусоносительства в популяциях мелких млекопитающих и клещей; выяснилось, что эти показатели на порядок выше тех, которые были установлены на основе обычного биотестирования.
- Впервые проанализированы внутрипопуляционные факторы изменчивости иммунореактивности грызунов и экспериментально обоснована ключевая роль репродуктивной иммуносупрессии в результате активации персистирующего вируса КЭ.
- При изучении ольфакторных реакций клеща выделены вещества, на основе которых могут быть созданы препараты для управления поведением этих членистоногих.
К счастью, согласно критериям, разработанным нашими учеными, пик заболеваемости можно предсказать за 1—2 года до его наступления! За это время, кстати, можно не только успеть заказать нужное количество препарата, но и провести активную санитарно-просветительскую работу по профилактической вакцинации населения, поскольку прививки против энцефалита необходимо начинать ставить зимой, когда членистоногие «дракулы» спокойно спят в лесной подстилке.
Безусловно, у любого здравомыслящего человека, ознакомившегося с результатами работы наших специалистов, не возникнет и тени сомнения в том, что столь четкие объективные параметры энцефалитоопасности очага и схемы прогнозирования возможной «эпидемии» грозного заболевания должны быть оперативно и благодарно использованы соответствующими службами. Что же получается на самом деле?
Вспомним трагическую статистику этого лета, лепту в которую внесла и Новосибирская область, где проводится уникальный многолетний мониторинг эпидемиологического очага. Единственное, что из года в год интересует местные органы санитарно-эпидемического надзора, — прогноз численности клещей, несмотря на то что исследователи, занимающиеся этим вопросом, ежегодно не устают пояснять, что для данной территории колебания численности клещей не являются эпидемически значимым показателем.
Что происходит в коридорах власти; кто, где и каким образом принимает решение о времени, а также объеме заказа и закупки противоклещевого иммуноглобулина, — так и остается тайной. По крайней мере, для обычных людей, ученых и даже для главного санитарного врача нашей необъятной страны. Остается только надеяться, что «глас вопиющего в пустыне», в конце концов, будет услышан — и клещевой энцефалит перестанет быть для нас непредсказуемым стихийным бедствием.
Авторы и редакция благодарят участника мониторинга к. б. н. В. В. Панова (ИСиЭЖ СО РАН) за помощь в подготовке иллюстративного материала
Статья публикуется по материалам сб.: Природа Академгородка: 50 лет спустя / Под ред. И. Ф. Жимулева. — Изд-во СО РАН. — 2007.
*См: НАУКА из первых рук. — 2006. — № 5(11).