Коронавирус: не стреляйте, я свой!
Почему новый коронавирус SARS-CoV-2 обладает такой высокой заражающей способностью? Почему многие случаи этой инфекции протекают в очень тяжелой форме? Почему многие заболевшие сообщают о полной, хотя и временной утрате обоняния? Авторам этой статьи, петербургским ученым, удалось найти одну из причин, определяющих характерные особенности протекания коронавирусной инфекции, и это – определенное сходство между вирусными и человеческими белками. «Не стреляйте, я свой!» – возможно, именно это «говорит» патоген нашей иммунной системе сразу после того, как попал в организм. А вирусные белки, маскируясь под белки человека, «подставляют» последние под удар нашего собственного иммунитета
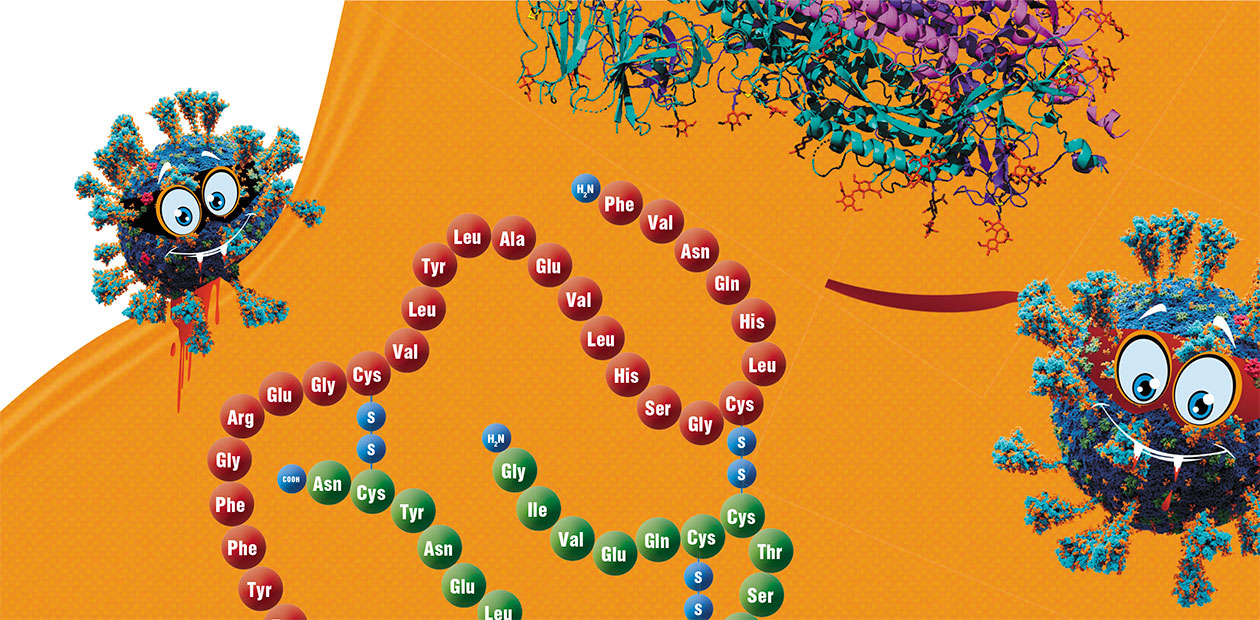
Во взаимоотношениях SARS-CoV‑2 и человеческого организма есть несколько важных моментов, которые стоит выделить особо. В первую очередь это гомология – структурная схожесть между человеческими и вирусными белками. Оказалось, что белки коронавируса содержат в своей структуре короткие (по 7–10 аминокислот) участки, которые буквально совпадают с участками различных человеческих белков (Khavinson, Terekhov, Kormilets et al., 2021). Примером может служить самый известный из белков коронавируса – S-гликопротеин (шиповый белок, или S-белок), состоящий из 1273 аминокислот. У этого вирусного белка мы обнаружили десятки аминокислотных участков, гомологичных участкам белков человека. Такая особенность вирусных белков имеет важные последствия как для самого патогена, так и для организма человека. И одна из них – способность вируса к молекулярной мимикрии.
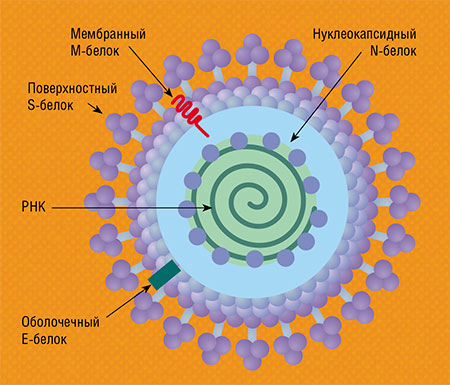
 Как и другие вирусы, SARS-CoV‑2 представляет собой молекулу нуклеиновой кислоты (в данном случае РНК), окруженную молекулами белков, как структурных, формирующих вирусную оболочку и нуклеокапсид, так и неструктурных (регуляторные ферменты и др.). Попадая в организм человека (например, на слизистые оболочки верхних дыхательных путей), вирус должен «решить» первоочередную задачу – избежать распознавания, чтобы не позволить системе врожденного иммунитета уничтожить себя еще до того, как он инфицирует клетку.
Как и другие вирусы, SARS-CoV‑2 представляет собой молекулу нуклеиновой кислоты (в данном случае РНК), окруженную молекулами белков, как структурных, формирующих вирусную оболочку и нуклеокапсид, так и неструктурных (регуляторные ферменты и др.). Попадая в организм человека (например, на слизистые оболочки верхних дыхательных путей), вирус должен «решить» первоочередную задачу – избежать распознавания, чтобы не позволить системе врожденного иммунитета уничтожить себя еще до того, как он инфицирует клетку.
Для этого вирус может встроить в структуру своих оболочечных белков аминокислотные последовательности, похожие на участки человеческих белков. И тогда наша иммунная система будет дезориентирована. На решение проблемы «свой или чужой?» уйдет время, за которое патоген успеет проникнуть в клетки, где начнет размножаться. Чем больше гомологичных участков встроит вирус в свои белки, тем успешнее он обманет иммунную систему.
Вирус вынуждает зараженную клетку прекратить синтез собственных белков (информация о том, как их производить, хранится в клеточном ядре в виде молекул ДНК). Вместо этого он навязывает клетке свою информацию, записанную в молекулах его РНК/ДНК, и заставляет ее строить из собственных материалов новые вирусные частицы. Функционирование самой клетки при этом нарушается, и она погибает.
«ГЛАВНАЯ ДОГМА» В ПАРЕ АБЗАЦЕВ Если вы хорошо помните содержание школьного учебника по биологии, можно этот текст пропустить. В ином случае напомним, что любые белки – это цепочки из десятков, сотен или тысяч аминокислот. В этом смысле молекулу белка можно сравнить со спутанными дамскими бусами, где каждая бусина – одна из 20 известных аминокислот.Каждая аминокислота имеет свое название и буквенное обозначение. Например, A – это аланин, C – цистеин, D – аспарагиновая кислота и т. д. до Y – тирозина. Поэтому запись первичной структуры (последовательности аминокислот) белка выглядит как огромное слово длиной в несколько сотен или тысяч букв. Буквы-аминокислоты «ставятся в строку» в строгом соответствии с инструкцией, записанной в молекуле ДНК, где каждая аминокислота закодирована тройкой нуклеотидов.
Здесь надо уточнить, что на саму ДНК воздействуют разные факторы внешней среды, к примеру ионизирующие излучения, которые в небольших дозах есть везде и всегда. В результате наша ДНК-инструкция по сборке белка может измениться (мутировать), и клетка начинает синтезировать белок немного иного аминокислотного состава, а следовательно, и других свойств.
Если новый белок значительно нарушает нормальное функционирование организма, то такая особь погибает, как правило, не успев оставить потомство, а мутация, соответственно, выбраковывается из генофонда биологического вида. В случае нейтральных изменений мутировавшая ДНК передается потомкам. В той же редкой ситуации, когда изменения в ДНК повышают приспособляемость организма к внешней среде, новая версия постепенно вытесняет предыдущую. Накопление полезных изменений в течение 4 млрд лет создало все многообразие животных, включая и вид Homo sapiens
И вот теперь мы подошли к главному. В конечном итоге иммунная система все же распознает факт «вторжения» и «признает» все инородные для организма вирусные белки подлежащими уничтожению. Она синтезирует антитела – специальные белки, которые должны связаться с белками-антигенами «агрессора», чтобы помочь его уничтожить. Однако эти антитела не должны затрагивать белки человеческого тела, а также белки постоянно живущих в нем полезных бактерий, к примеру лактобактерий кишечника.
Но если между белками коронавируса и человека есть сходство в некоторых участках, то антитела могут «ударить» не только по вирусным белкам, но и по нашим собственным! Это и называется аутоиммунным процессом. И опять: чем больше будет в белках гомологичных участков, тем выше риск нарушений в работе механизмов иммунного ответа.
Иммунные провокаторы
 Перечислить все функции всех белков, вовлекаемых в ответ иммунной системы на SARS-CoV‑2, в научно-популярной статье невозможно. Ограничимся двумя примерами.
Перечислить все функции всех белков, вовлекаемых в ответ иммунной системы на SARS-CoV‑2, в научно-популярной статье невозможно. Ограничимся двумя примерами.
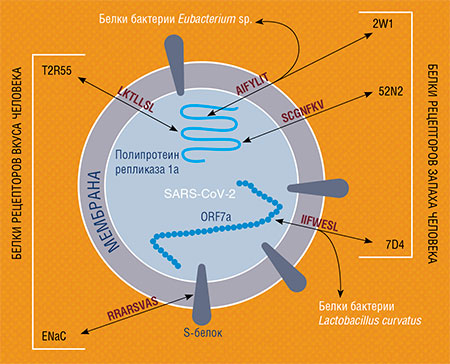
Первый – это белки обонятельных и вкусовых рецепторов. Как известно, один из распространенных симптомов коронавирусной инфекции – временная потеря обоняния и вкуса. И как выяснилось, белки рецепторов запаха и вкуса также имеют участки сходства с белками коронавируса.
Так, в ферменте репликазный полипротеин RPP 1a, расположенном внутри вирусной частицы, имеется два участка, гомологичных участкам в молекулах белков обонятельных рецепторов человека 2W1 и 52N2. А в вирусном белке ORF7b, взаимодействующем с ключевыми белками врожденного противовирусного иммунитета, есть участок, гомологичный участку в белке 7D4 обонятельных рецепторов. Кроме того, в нем имеется два участка белков коронавируса, гомологичные белкам вкусовых рецепторов.
Вполне возможно, что наша собственная иммунная система, вырабатывая антитела против вирусных белков, наносит удар и по всем этим белкам. Позднее их функции восстанавливаются.
Белки коронавируса по функциям разделяют на структурные (поверхностные и оболочечные) и неструктурные (регуляторные, ферменты и др.).Пока что внимание исследователей занято почти исключительно поверхностным шиповым белком (S-белок) – именно его молекулы, демонстративно выставленные наружу, создают вокруг вирусных частиц эффект «солнечной короны», если рассматривать их под электронным микроскопом. Но к группе структурных белков относятся и другие, к примеру мембранный M-белок, а также малый оболочечный E-белок и нуклеокапсидный N-белок. И все эти белки, а также ряд неструктурных белков (ORF3a, ORF7a, ORF8, ORF9b и др.) имеют участки сходства с белками человека.
Предположительно, функции всех этих вирусных белков при инфицировании организма распределяются следующим образом: белки S и М, в большей степени контактирующие с человеческими клетками, обеспечивают вирусу молекулярную мимикрию. Прочие структурные и все неструктурные белки в основном ответственны за инициацию аутоиммунных процессов
Второй пример связан с поверхностным S-белком коронавируса, в котором нам удалось выявить более двух десятков участков, гомологичных белкам человека. Среди последних – сократительный немышечный белок нетрадиционный миозин XVIIIa (MYO-XVIIIa), участвующий в регуляции воспалительных процессов в альвеолах легких человека (не здесь ли связь с одним из наиболее тяжелых вариантов ковидной инфекции – пневмонией?). Этот же белок влияет на работу рецепторов системы врожденного иммунитета, расположенных на макрофагах – иммунных клетках, функция которых состоит в захватывании и переваривании проникших в организм патогенов и токсинов.
Именно макрофаги ответственны за «первую линию» обороны организма, в том числе и от вирусов. И гомология коронавирусных белков с MYO-XVIIIa сначала помогает патогену скрываться от опознания иммунной системой, а позже ослабляет иммунный ответ организма.
В целом мы отметили десятки человеческих белков, которые могут быть повреждены в ходе аутоиммунного процесса при ответе организма на коронавирусную инфекцию. Функции этих белков в организме в значительной мере уже известны, и, проверив их сохранность у больных COVID‑19, клиницисты смогут обнаружить новые нарушения, пока ускользающие от их внимания.
Например, в коронавирусных белках S и ORF9b есть участки, гомологичные участкам белков, которые принимают участие в регуляции сперматогенеза. Здесь уместно вспомнить, что о временном нарушении мужской репродуктивной функции упоминают как об одном из последствий новой коронавирусной инфекции. Зная об этих и подобных им «поломках», можно будет своевременно их предотвращать или лечить с помощью уже существующих либо специально разработанных методов.
Открытие как «побочный продукт»
Почему почти два года назад мы начали искать там, где не искали другие? Ведь согласитесь, что предполагать сходство белков вируса и растений – идея не из числа очевидных.
Предыстория такова. В течение нескольких десятилетий мы и наши коллеги из Санкт-Петербургского института биорегуляции и геронтологии исследовали физиологические эффекты пептидов – маленьких фрагментов белковых молекул, играющих в организме человека множество важных ролей (к примеру, многие из них являются гормонами).
«ВОЛК В ОВЕЧЬЕЙ ШКУРЕ» Коронавирусные белки схожи с белками не только человека, но и некоторых безвредных и даже полезных бактерий, обитающих в пищеварительном тракте человека, например с белками лактобактерий, которых много в кисломолочных пищевых продуктах.При заражении через рот вирусные частицы SARS-CoV‑2, попавшие в кишечник, могут в этом случае маскироваться под полезную бактерию, к присутствию которой иммунная система этого органа давно «привыкла» (к слову сказать, 80 % иммунных клеток человека находятся именно в кишечной стенке). С другой стороны, при распознавании интервента иммунная система кишечника может заодно «ударить» и по полезным бактериям, вызывая дисбактериоз и диарею.
Белки коронавируса имеют некоторое сходство и с белками таких привычных для нас злаков, как пшеница, кукуруза, ячмень, и других обычных компонентов пищи большинства людей. Вполне возможно, что ответ иммунной системы на заражение вирусом нарушает их переваривание, что вполне соответствует «интересам» вируса, ведь любое ослабление организма человека облегчает патогену процесс размножения
В предпандемийную эпоху нас живо интересовал вопрос, есть ли в белках человека мотивы (последовательности аминокислот), которые мы унаследовали от самых далеких наших предков – одноклеточных организмов. Кое-что уже было известно. Например, что инсулин, самый важный гормон в нашем теле, является одновременно и самым эволюционно древним. Так, инсулиноподобный материал выделили из растений и инфузорий, а также из нескольких штаммов бактерии – кишечной палочки (Collier et al., 1987; LeRoith et al., 1980; и др.). Это означает, что соответствующие гены практически не менялись в течение 4 млрд лет – естественный отбор «признал инсулин крайне удачным эволюционным проектом».
В ходе подобных исследований мы среди прочего обнаружили, что гормон ксенин, функция которого связана с функцией инсулина, синтезируется практически в неизменном виде на протяжении почти 1,8 млрд лет (Maryanovich, Kormilets, Polyanovsky, 2018). Тем самым мы «удлинили» срок его существования на много сотен миллионов лет против того, что было известно до наших изысканий.
 Обнаружив очередной пептид с полезными свойствами, мы задались вопросом: откуда он и из какого белка образовался? Чтобы проследить «траекторию» подобных гормонов по направлению к корням эволюционного древа, мы вынуждены были создать на основе уже существующих и находящихся в общественном достоянии компьютерных программ свою собственную, которая примерно за одну минуту «просматривает» структурные формулы почти всех известных белков бактерий, одноклеточных, грибов, растений и животных, вплоть до человека.
Обнаружив очередной пептид с полезными свойствами, мы задались вопросом: откуда он и из какого белка образовался? Чтобы проследить «траекторию» подобных гормонов по направлению к корням эволюционного древа, мы вынуждены были создать на основе уже существующих и находящихся в общественном достоянии компьютерных программ свою собственную, которая примерно за одну минуту «просматривает» структурные формулы почти всех известных белков бактерий, одноклеточных, грибов, растений и животных, вплоть до человека.
Как это происходит? Представьте себе, что на двух полосках бумаги написаны два очень длинных слова, где каждая буква – это аминокислота. Мы протягиваем одну ленту вдоль другой и ждем момента, когда заданное число букв, идущих подряд, в обоих словах совпадет. Только в отличие от человека-наблюдателя компьютер делает это почти мгновенно. В результате мы смогли сказать: «Такой-то гормон нам удалось проследить от уровня рыб, а такой-то – только от земноводных».
Проблема происхождения вирусов еще интереснее: никто не знает, когда и как они возникли. Наши попытки сопоставить совокупности белков вирусов и человека заметных результатов не давали, но привычка их сравнивать оставалась.
Когда пришла весна 2020 г. и миру объявили, что он находится в состоянии пандемии, в нашем распоряжении оказались данные из открытых источников, касающиеся структуры 33 млн белков (или 11 млрд аминокислот). С помощью нашей компьютерной программы мы просмотрели первичные структуры всех этих белков, обнаружив десятки коротких идентичных участков в белках коронавируса, с одной стороны, и в белках человека, животных, растений и бактерий – с другой.
Модификация программы, выполненная нашим коллегой Александром Тереховым из Северо-Западного государственного медицинского университета им. И. И. Мечникова, позволила собрать более полную информацию о гомологии белков коронавируса и человека. В результате мы обнаружили в структуре оболочечного Е-белка коронавируса комбинацию из восьми аминокислот подряд (VNSVLLFL), встречающуюся в одном из белков человека, а непосредственно рядом с ней – еще и комбинацию из восьми аминокислот (AFVVFLLV), характерную для белка лактобактерий.
Вероятность случайного сочетания 16 аминокислот подряд равна единице, деленной на шесть с двадцатью нулями. Для большей наглядности представим себе рулетку, на диске которой только 20 ячеек (по числу аминокислот). И если на одно вращение колеса и запись результата мы будем тратить по 1 минуте, то, чтобы гарантированно получить заданное сочетание (VNSVLLFLAFVVFLLV), придется в течение миллиона лет крутить миллиард таких рулеток.
Общая же длина участка E-белка, гомологичного белкам человека и его полезных кишечных бактерий, составила 28 аминокислот (VNSVLLFLAFVVFLLVTLAILTALRLCA). Для случайного подбора этой комбинации «рулетку» пришлось бы вращать астрономическое число раз – 2028!
 Но если случайный подбор столь длинных комбинаций исключен, то зачем они появились в результате эволюции? Мы предположили, что коронавирус собрал из ДНК различных организмов столь длинную последовательность в свой E-белок ради мимикрии, и эта «встройка» оказалась адаптивной, т. е. повысила шансы вируса на проникновение и размножение в организме человека.
Но если случайный подбор столь длинных комбинаций исключен, то зачем они появились в результате эволюции? Мы предположили, что коронавирус собрал из ДНК различных организмов столь длинную последовательность в свой E-белок ради мимикрии, и эта «встройка» оказалась адаптивной, т. е. повысила шансы вируса на проникновение и размножение в организме человека.
Вот так, запустив автоматический поиск, мы в качестве «побочного продукта» выявили в белках нового коронавируса участки сходства с белками не только человека, но и других организмов.
В наши дни десятки научных коллективов по всему миру создают новые вакцины против коронавируса, и все они направлены против вирусных белков-антигенов. Можно ли имеющиеся знания относительно сходства белков коронавируса и человека применить уже сегодня? Почему нет?
Очень желательно, чтобы будущие вакцины были нацелены на те участки вирусных белков, которые имеют минимальное сходство с человеческими. Это позволило бы уменьшить вероятность аутоиммунного повреждения белков организма человека и таким образом снизить частоту осложнений при вакцинации. В этом смысле мы, как геологи-нефтегазоразведчики, указали на перспективный район. Теперь дело за другими специалистами.
Вирусные инфекции будут преследовать человечество постоянно – COVID‑19 в этой череде не первый и не последний. Непрерывно будет изучаться и взаимодействие вирусов с организмом-хозяином. Надо многое проверить, и чем большее число специалистов получит в руки данные вроде тех, что представлены здесь, тем скорее будут проведены исследования, от которых зависит здоровье и благополучие каждого из нас.
Литература
Abdelmageed M. I., Abdelmoneim A. H., Mustafa M. I. et al. Design of a multiepitope-based peptide vaccine against the E protein of human COVID-19: An immunoinformatics approach // Biomed. Res. Int. 2020. ID 2653286.
Khavinson V., Terekhov A., Kormilets D. et al. Homology between SARS CoV-2 and human proteins // Sci. Rep. 2021. 11(1):17199.
Lederberg J. Infectious history // Science. 2000. V. 288(5464). P. 287–293.
Maryanovich A. T., Kormilets D. Y., Polyanovsky A. D. Xenin: the oldest after insulin? // Mol. Biol. Rep. 2018. V. 45(2). P. 143–150.