Антитела против канцерогенов
Создать универсальную прививку от рака – болезни коварной и многоликой – принципиально невозможно. Здоровый образ жизни и хорошие экологические условия – вот все, чем мы располагаем в этом смысле. Однако впечатляющие успехи вакцинопрофилактики инфекционных заболеваний породили надежду, что можно создать вакцины против химических канцерогенов – веществ, провоцирующих появление злокачественных новообразований. В первую очередь такими канцерогенами являются продукты сжигания органического топлива в промышленных выбросах
В большинстве развитых стран мира, в том числе и в России, онкологические заболевания занимают второе место среди причин смерти после сердечно-сосудистых. Однако если атеросклероз и гипертония лечатся годами и десятилетиями, рак страшен своей скоротечностью: каждый третий больной погибает в течение года с момента постановки диагноза.
Основные усилия ученых в борьбе со злокачественными опухолями сосредоточены на совершенствовании старых и разработке новых методов лечения, при этом базовый тезис медицины – болезнь легче предупредить, чем вылечить, – так и остается только тезисом. Фармакологических средств профилактики рака, сопоставимых по эффективности со средствами профилактики инфекционных заболеваний, на сегодняшний день не существует. Причина, в первую очередь, заключается в мультифакторной природе злокачественных новообразований, что подразумевает существование множества возможных причин и разнообразия механизмов возникновения опухолей. Это обусловливает почти непреодолимые трудности в решении проблемы профилактики рака в каждом конкретном случае.
Но хотя универсальных средств предупреждения рака нет и быть не может, создание препаратов, воздействующих на отдельные факторы и звенья патогенеза онкологических заболеваний, представляется вполне возможным.
Кузбасс промышленный
По мнению экспертов Международного агентства по изучению рака (МАИР), основной причиной этой болезни служат факторы окружающей среды химической природы. Речь идет о канцерогенах – веществах, воздействие которых достоверно увеличивает частоту возникновения и/или ускоряет рост злокачественных опухолей в популяции человека или животных. Наиболее распространенные канцерогены в промышленно развитых странах – это продукты сжигания органического топлива.
 Согласно спискам МАИР и Санитарно-эпидемиологическим правилам и нормативам РФ, в угле содержатся и/или образуются при сжигании и переработке целый ряд канцерогенных веществ: бензопирен и бензантрацен, каменноугольные смолы, бериллий, кадмий, мышьяк, никель и их соединения; диоксин, радон и т. д. Поэтому канцерогенная опасность для человека таких индустриальных процессов, как производство кокса, переработка каменноугольных смол, газификация угля, производство чугуна, стали и алюминия, безусловно, доказана.
Согласно спискам МАИР и Санитарно-эпидемиологическим правилам и нормативам РФ, в угле содержатся и/или образуются при сжигании и переработке целый ряд канцерогенных веществ: бензопирен и бензантрацен, каменноугольные смолы, бериллий, кадмий, мышьяк, никель и их соединения; диоксин, радон и т. д. Поэтому канцерогенная опасность для человека таких индустриальных процессов, как производство кокса, переработка каменноугольных смол, газификация угля, производство чугуна, стали и алюминия, безусловно, доказана.
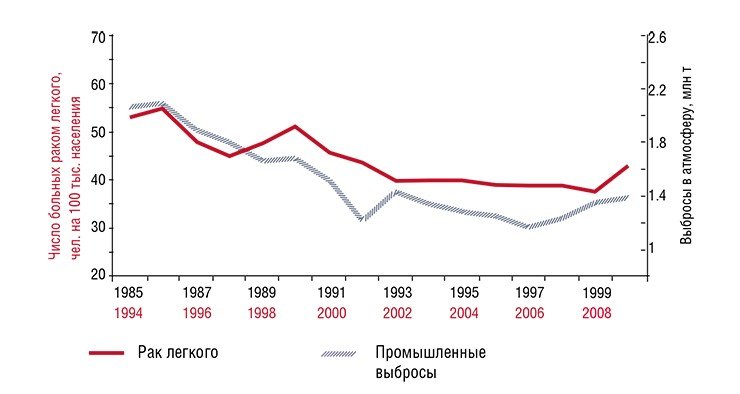
Кузбасс – основной угледобывающий регион России, обеспечивающий 56 % угледобычи, 19 % проката и 15 % стали страны, – занимает всего 2% площади РФ. Экологические последствия такой высокой концентрации тяжелой промышленности печально известны: ежегодные промышленные выбросы в атмосферу за последние 25 лет составили около 2 млн т, а сбросы загрязняющих веществ в водные источники – до 1,3 млн т! Таким образом, на каждого жителя Кемеровской области «приходится» от 0,5 до 1,2 т загрязняющих веществ, не считая огромного количества промышленных отходов, накопленных в многочисленных отвалах.
Исследования сотрудников Института экологии человека (ИЭЧ) СО РАН показали, что заболеваемость раком легкого и раком желудка в Кемеровской области прямо связана с объемом ежегодных загрязняющих выбросов в атмосферу и водные источники (аналогичная закономерность характерна и для Донецкой области Украины). Как свидетельствуют статистические данные, чтобы за год заболеваемость раком легкого не превышала 40 случаев, а раком желудка – 26 случаев на 100 тыс. чел., объем промышленного загрязнения атмосферы и водных источников должен составлять не более 1,2 и 0,5 млн т соответственно.
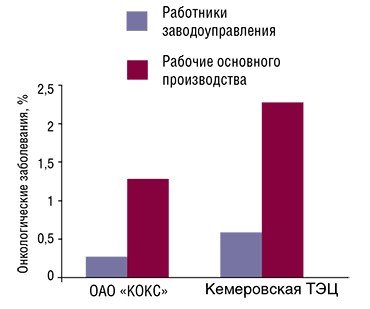
Было также обнаружено, что у рабочих основных профессий углеперерабатывающих предприятий ОАО «Кокс» и Кемеровская ТЭЦ злокачественные опухоли появляются значительно чаще, чем у работников вспомогательных подразделений. При этом у этих рабочих отмечено и достоверно большая частота встречаемости хромосомных мутаций (перестроек), чем у работников, не занятых непосредственно в производстве (Оценка и прогноз канце-рогенной опасности, 2010).
Защитная биотрансформация
Полициклические ароматические углеводороды – наиболее распространенные и изученные химические канцерогены – часто называют проканцерогенами, так как они, будучи химически инертными, не способны взаимодействовать с ДНК и непосредственно вызывать злокачественное перерождение клеток. Однако благодаря своей гидрофобности они могут вызывать нарушения структуры и функций липидных мембран важнейших внутриклеточных образований.
Поэтому в клетках многих тканей организма эти углеводороды подвергаются процессу биотрансформации. Сначала они превращаются в водорастворимые соединения, которые, благодаря появлению в их структуре химически активных группировок, приобретают способность ковалентно связываться с другими биомолекулами. Соединяясь с ДНК и белками, эти метаболиты образуют так называемые аддукты канцерогенов. При делении клетки на участке ДНК, где образовался такой комплекс, может происходить неправильное считывание генетической информации – возникает мутация.
Этому процессу препятствуют ферменты II фазы биотрансформации, которые присоединяют пептид глутатион к водорастворимым метаболитам канцерогенов. В виде таких коньюгатов канцерогены в конечном счете и выводятся из клетки и из организма. Физиологическим механизмом, восстанавливающим нормальную последовательность нуклеотидных оснований в ДНК в случае возникновения мутации, является ее репарация (восстановление) с помощью специальных ферментов. Однако при низкой активности этих ферментов мутации накапливаются при каждом клеточном делении, и в конечном итоге нормальная клетка может трансформироваться в злокачественную.
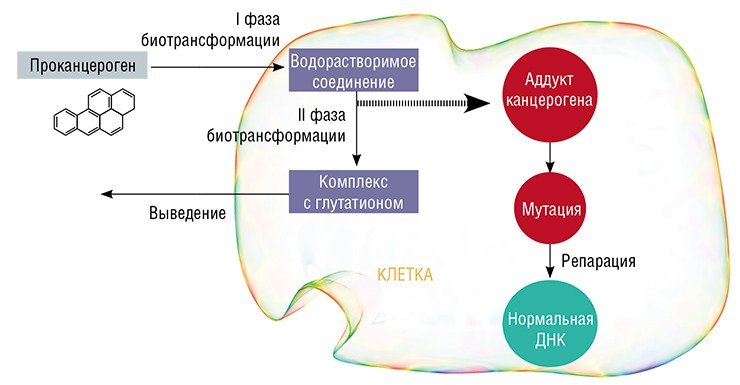
Следует отметить, что гены, кодирующие ферменты биотрансформации и репарации, характеризуются значительной изменчивостью (полиморфизмом). Одни варианты обеспечивают синтез активных форм ферментов, другие же – мало активных, а в некоторых случаях активность утрачивается полностью. Очевидно, что мутации в ДНК могут сохраняться и закрепляться только в том случае, если высокая активность ферментов I фазы сочетается с низкой активностью ферментов II фазы биотрансформации и репарации.
К счастью, такие «роковые» сочетания встречаются не часто, поскольку каждая из этих трех групп ферментов кодируется большим числом генов, а каждый ген может иметь несколько вариантов. Об этом свидетельствует и относительно небольшая частота онкологических заболеваний в популяциях человека.
Иммунный ответ – есть!
Широко распространено мнение, что одной из причин онкологических заболеваний является угнетение иммунитета, которое может возникать и под действием химических канцерогенов. Однако это представление не со-всем верно: химические канцерогены, будучи низкомолекулярными соединениями, сами по себе вообще не способны вызвать специфический иммунный ответ (синтез антител) – это могут только такие макромолекулы, как белки, пептиды и т. д.
Между тем антитела к химическим канцерогенам обнаружены в сыворотке крови как у здоровых людей, так и у больных раком, причем у последних чаще и в больших количествах. Закономерно возникают вопросы: каким образом химические канцерогены вызывают специфический иммунный ответ? И какую роль играют эти антитела в самом канцерогенезе?
Большинство исследователей считают, что в данном случае антигеном, вызывающим иммунный ответ, являются те самые аддукты – комплексы химических канцерогенов с биомолекулами. Существует и концепция иммунохимического гомеостаза, согласно которой образующиеся в организме специфические антитела связывают эти канцерогены, что приводит к снижению активности процесса биотрансформации (Ковалев, Шипулина, 1992).
Однако на основании модельных экспериментов было показано, что такую защитную роль играют только те антитела, которые проникают из крови в просвет полых органов (бронхов и желудочно-кишечного тракта). В самой крови они, напротив, создают дополнительный градиент для канцерогенов, усиливая их транспорт из окружающей среды через эпителий и тем самым стимулируя канцерогенез (Silbart et al., 1997; De Buck et al., 2005). Единственный эксперимент на целостном организме мышей показал, что под воздействием бензопирена опухоли возникают раньше у особей с высоким уровнем специфических сывороточных антител (Curtiset et al., 1978).
Специалисты из ИЭЧ СО РАН задались вопросом о взаимосвязи между образованием специфических антител и работой системы биотрансформации химических канцерогенов у человека. Эти исследования были необходимы для разработки нового направления иммунопрофилактики рака – антиканцерогенных вакцин.
Палка о двух концах
Исследования кемеровских ученых показали, что у больных раком легкого значительно чаще, чем у здоровых, наблюдаются повышенные уровни антител к канцерогену бензопирену, а также к эстрадиолу – стероидному гормону, вырабатываемому в организме. При этом вероятность возникновения опухоли зависела от соотношения этих двух показателей. Хотя биологический смысл этого явления пока не ясен, однако уже сейчас для определения индивидуального риска возникновения рака легкого можно рекомендовать проведение одновременного анализа на антитела к канцерогену и эстрадиолу.
При изучении генетического полиморфизма ферментов биотрансформации низкомолекулярных соединений была обнаружена еще одна закономерность. В группе больных раком легкого отмечена взаимосвязь между уровнем защитных антител и полиморфизмом гена GSTT1, кодирующим фермент II фазы биотрансформации. Мутация этого гена приводит к полной потере ферментом способности присоединять активные формы химических канцерогенов к глутатиону.
Распространено мнение, что неактивная форма этого гена ассоциирована с высоким риском онкологических заболеваний. Однако в данном случае оказалось, что уровень антител к бензопирену был выше у больных с функционально активным геном GSTT1. Это свидетельствует о том, что синтез антител индуцируется продуктами не столько I фазы биотрансформации, как предполагалось ранее, сколько II фазы.
По-видимому, сывороточные антитела, образуя комплексы с белковыми коньюгатами канцерогенов, препятствуют их проникновению из кровяного русла в органы и ткани. Такие циркулирующие комплексы поглощаются печенью, где они и инактивируются. Это означает, что образование антител против низкомолекулярных соединений является особым звеном иммунологической адаптации человека к факторам, потенциально опасным для клеточной ДНК.
Однако в определенных условиях антитела против канцерогенов способны усиливать генотоксическое действие последних, провоцируя канцерогенез, что и было доказано в исследовании хромосомных нарушений в лимфоцитах периферической крови, проведенном на здоровых мужчинах с известными уровнями антител к бензопирену (Глушков и др. 2011).
Антитело вместо антигена
Совершенствование иммуноанализа и появление адекватных моделей химического канцерогенеза породили в последние годы надежды на создание вакцин против химических канцерогенов, которые можно использовать для иммунопрофилактики рака. Нужно отметить, что первые попытки такого рода были сделаны на мышах еще в первой половине прошлого века (Frank and Creech, 1939). Основная трудность в создании антиканцерогенных вакцин заключается в выборе подходящего антигена. В случае инфекционной болезни в этом качестве часто используют инактивированный возбудитель, безопасный для человека. Но инактивировать химический канцероген невозможно по определению: значительно изменив структуру молекулы, мы получаем другое соединение, которое уже не может служить антигеном; в ином случае канцероген сохраняет свои мутагенные свойства.
Так, американские исследователи успешно использовали для иммунизации животных полициклический углеводород фторметилбензантрацен (Moolten et al., 1981). Но хотя наличие фтора ослабляет канцерогенные свойства исходного соединения, применять подобные препараты в медицинской практике нельзя – всегда остается вероятность возникновения опухоли.
 Эту проблему удалось решить с помощью так называемых анти-идиотипических антител, которые получают путем «двойной иммунизации» (Chagnaud et al., 1993). Сначала коньюгатом бензопирена с альбумином были иммунизированы кролики, а полученными от них «первыми» антителами – лабораторные мыши. С помощью гибридомной технологии * от мышей были получены «вторые» моноклональные антитела, которые использовались уже для иммунизации лабораторных крыс. Удивительно, но хотя в составе этих антител полностью отсутствовал первичный канцероген, они, тем не менее, действовали подобно антиканцерогенной вакцине, тормозя появление опухолей при воздействии бензопирена. Так было показано, что защитный иммунный ответ против канцерогена можно получить с помощью безопасных белковых препаратов, имитирующих антигенные свойства канцерогена.
Эту проблему удалось решить с помощью так называемых анти-идиотипических антител, которые получают путем «двойной иммунизации» (Chagnaud et al., 1993). Сначала коньюгатом бензопирена с альбумином были иммунизированы кролики, а полученными от них «первыми» антителами – лабораторные мыши. С помощью гибридомной технологии * от мышей были получены «вторые» моноклональные антитела, которые использовались уже для иммунизации лабораторных крыс. Удивительно, но хотя в составе этих антител полностью отсутствовал первичный канцероген, они, тем не менее, действовали подобно антиканцерогенной вакцине, тормозя появление опухолей при воздействии бензопирена. Так было показано, что защитный иммунный ответ против канцерогена можно получить с помощью безопасных белковых препаратов, имитирующих антигенные свойства канцерогена.
В настоящее время имеются более совершенные методы получения подобных вакцин. Так, в ИЭЧ с этой целью была использована технология так называемого фагового дисплея, а сама методика была защищена двумя патентами РФ.
На первом этапе кемеровские исследователи синтезировали коньюгат бензопирена с белком (бычьим сывороточным альбумином). Затем с помощью гибридомной технологии из селезенки мышей, иммунизированных коньюгатом, был выделен клон лимфоцитов – клеток, продуцирующих антитела против бензопирена. Оказалось, что эти антитела способны реагировать также с другими поли- и гетероциклическими углеводородами, но при этом они не связываются с аминокислотами, содержащими ароматическое кольцо, а также со стероидными гормонами. Это выгодно отличает их от известных зарубежных аналогов.
 На третьем этапе из огромной библиотеки бактериофагов – бактериальных вирусов, широко использующихся в исследовательской практике, – было выделено пять клонов, способных избирательно связываться с полученными моноклональными антителами. Это означает, что эти бактериофаги имеют в составе своей оболочки пептид, являющийся своего рода «белковым аналогом» бензопирена. Соответственно, при иммунизации мышей одним из этих клонов в организме будут вырабатываться антитела, специфичные к данному канцерогену – что и требуется от противоканцерогенной вакцины (Glushkov et al., 2010).
На третьем этапе из огромной библиотеки бактериофагов – бактериальных вирусов, широко использующихся в исследовательской практике, – было выделено пять клонов, способных избирательно связываться с полученными моноклональными антителами. Это означает, что эти бактериофаги имеют в составе своей оболочки пептид, являющийся своего рода «белковым аналогом» бензопирена. Соответственно, при иммунизации мышей одним из этих клонов в организме будут вырабатываться антитела, специфичные к данному канцерогену – что и требуется от противоканцерогенной вакцины (Glushkov et al., 2010).
Таким образом, исследования кемеровских ученых подтвердили возможность получения вакцин для профилактики рака на основе пептидов, имитирующих иммунологические свойства химических канцерогенов.
Было впервые показано, что антитела к химическим канцерогенам в организме человека могут как противодействовать генотоксическому действию канцерогенов, так и, напротив, усиливать его, способствуя возникновению злокачественных опухолей. Эти результаты необходимо учитывать при применении уже известных средств иммунопрофилактики рака и при разработке новых. Коль скоро эффект иммуностимуляции канцерогенеза нельзя исключить, следует относиться с большой осторожностью и к применению широко рекламируемых средств «повышения иммунитета».
Что касается Кузбасса, то очевидно, что планируемое здесь двукратное увеличение добычи угля с высокой вероятностью приведет к увеличению канцерогенной нагрузки на население и росту онкологической заболеваемости. Поэтому при росте добычи угля крайне важно любым способом ограничить увеличение объема промышленных выбросов, в том числе путем применения новых технологий, разработанных в СО РАН.
Кроме того, необходимо разработать и внедрить (в первую очередь на предприятиях тяжелой промышленности и топливного цикла) комплекс лабораторных методов для определения индивидуальной устойчивости/чувствительности к канцерогенным факторам, характерным для Кузбасса, поскольку даже при низкой канцерогенной нагрузке определенные группы людей остаются подвержены онкологическим заболеваниям.
Литература
Глушков А. Н., Ларин С. А. и др. Заболеваемость злокачественными новообразованиями в Кемеровском АО «КОКС»// Вопросы онкологии. 2005. Т. 51, № 4. С. 444—446.
Глушков А. Н., Апалько С. В. и др. Моноклональные антитела к химическим канцерогенам группы полициклических ароматических углеводородов// Российский иммунологический журнал. 2009. № 3. С. 30—38.
Оценка и прогноз канцерогенной опасности для населения угледобывающих регионов России и Украины (на приме-ре Кемеровской и Донецкой областей) / под общ. ред. А. Н. Глушков, Г. В. Бондарь; Рос. акад. наук, Сибирское отд., Ин-т экологии человека [и др.] // Новосибирск: Изд-во СО РАН. 2010. 156 с.
Glushkov A. N., Apalko S. V. et al. A Novel Approach to the Development of Anticarcinogenic Vaccines // Acta Na-ture. 2010. Vol. 2, № 4 (7). P. 105—111.
*Гибридомы – клетки, полученные в результате слияния лимфоцитов и опухолевых клеток, – способны к синтезу специфических антител, а также к неограниченному росту в клеточной культуре