Как клетка ремонтирует ДНК
Всю информацию, которую хранят и передают по наследству живые клетки, несут в себе молекулы ДНК, являющиеся своеобразными шифрованными генетическими «текстами». Клетка тщательно следит за состоянием своих сокровищ: ДНК — единственная молекула, которую при повреждении клетка «ремонтирует» или, как принято говорить, «репарирует» — молекулы всех других типов синтезируются заново.
Удивительно, что, несмотря на ключевую роль, которую играет нить ДНК в работе клеток, она является очень нежным образованием, и повредить ее ничего не стоит. Даже обычный солнечный свет представляет для ДНК серьезную угрозу. Чаще всего это происходит следующим образом: квант света — фотон, — столкнувшись с ДНК, может передать свою энергию одному из ее структурных элементов — азотистому основанию, — который при этом переходит в возбужденное состояние. Дальше все зависит от того, с каким конкретно основанием это произошло. Если это аденин или гуанин, то энергия возбуждения быстро переходит в тепловую — и структура ДНК не меняется. Если же порцию дополнительной энергии получили тимин или цитозин, то последствия могут быть весьма серьезными.
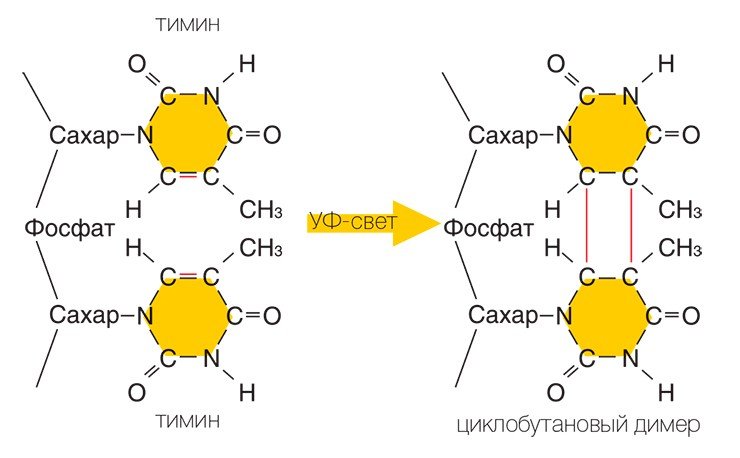
К примеру, из двух расположенных рядом на одной цепи тиминов может возникнуть новая структура — тиминовый димер — молекула, в которой четыре расположенных по углам квадрата атома углерода соединены химическими ковалентными связями. Если представить, что ДНК — это застежка-молния, то димер в таком случае похож на два соседних зубца, которые сошлись вместе и не позволяют застежке работать: с такой поврежденной цепи ДНК уже нельзя снять копию-слепок, которая может быть «инструкцией» по изготовлению нужного белка.
Довольно жестким ударом для любого организма является радиационное облучение, в несколько раз превышающее фоновый уровень радиации, необходимый для существования всех живых существ. Действие ионизирующей радиации вызывает различные повреждения ДНК, включая разрывы обеих цепей, что наиболее опасно для клетки, поскольку репарация таких повреждений особенно сложна. Этот принцип, собственно, положен в основу радиотерапии, когда с помощью ионизирующей радиации уничтожаются раковые клетки; сходным действием обладают и некоторые лекарственные препараты, также используемые при лечении рака. Следует заметить, что даже единственный неисправленный разрыв обеих цепей ДНК может вызвать гибель клетки.
Повреждения ДНК могут быть вызваны и некоторыми антропогенными загрязнениями окружающей среды, такими как продукты сгорания бензина, табачный дым... Однако самые многочисленные, но в то же время и наиболее легко исправляемые повреждения, вызваны агентами, которые возникают в процессе нормальной жизнедеятельности самой клетки: при дыхании, окислении липидов (жиров), а также при воспалительных реакциях. Сейчас известно всего более ста типов подобных окислительных повреждений ДНК.
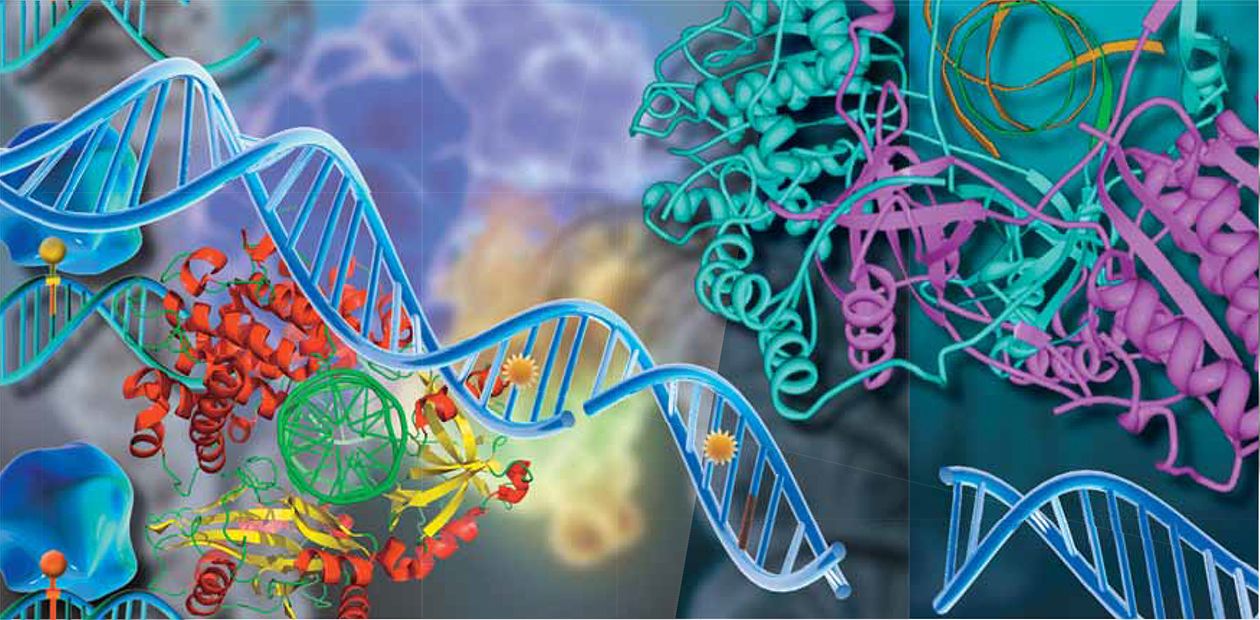
Ясно, что со столь разнообразными повреждениями справиться непросто. В процессе эволюции возникло несколько изощренных, частично перекрывающихся систем, которые способны исправить большинство (хотя и не все) изменений в генетических «текстах» клеток. Эти системы, как правило, представляют собой ансамбли, состоящие из нескольких десятков разных белков, и специализируются они на проведении определенного типа «ремонта» — репарации ДНК.
Распределение функций между этими белковыми «машинами» выглядит следующим образом. Эксцизионная репарация нуклеотидов (от англ. excision — выщепление) обеспечивает удаление большого класса разнообразных объемных повреждений, которые искажают структуру двойной спирали ДНК и, как правило, препятствуют синтезу копий ДНК, т. е. получению копий-инструкций для последующего синтеза белков.
Эксцизионная репарация оснований специализируется на «мелком» ремонте небольших повреждений оснований ДНК, не сопровождающихся значительным искажением двойной спирали. Эти повреждения могут не препятствовать процессу копирования информации с ДНК, однако приводят к ошибкам в самих генетических «текстах». Существует еще два белковых ансамбля, участвующих в процессах, называемых «гомологичная рекомбинация» и «негомологичное воссоединение концов» — они заняты крупным ремонтом: соединяют цепи ДНК, в которых разорваны обе ниточки, хотя и пользуются для этого разными механизмами.
Заплатки короткие и длинные
Рассмотрим подробнее, как же работают некоторые репарационные машины. Нужно отметить, что, несмотря на большие различия в «исполнителях» и типе ремонта поврежденной ДНК, все репарационные процессы, идущие в клетке, имеют несколько общих черт.
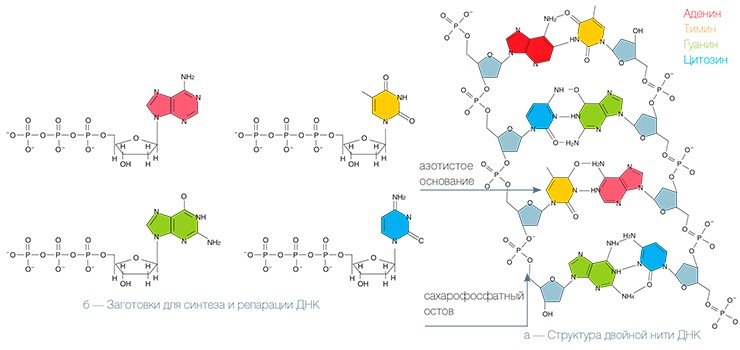
Во-первых, нужно найти повреждение, «расчистить» поврежденный участок ДНК (это может быть маленький кусочек, размером в один нуклеотид, или более протяженный участок из нескольких десятков нуклеотидов), затем залатать повреждение и провести окончательную «отделку», чтобы не осталось даже следов от сделанной «заплатки». Еще одна общая черта: при «ремонте» испорченные детали не исправляются, а заменяются новыми. В репарации используются те же самые заготовки, из которых собирается нить ДНК в процессе ее удвоения. Тем не менее, детали работы этих машин резко различаются.
В эксцизионной репарации оснований репарация ДНК осуществляется как бы конвейером, состоящим из отдельных белков. Поврежденная ДНК поступает в начало конвейера и в конце выходит полностью исправленной, т. е. передается от одного белка к другому, словно «эстафетная палочка». Конечно же, движется не сама ДНК — скорее каждый белок оказывается рядом и начинает работать, как только предыдущий участник процесса выполнит свою задачу.
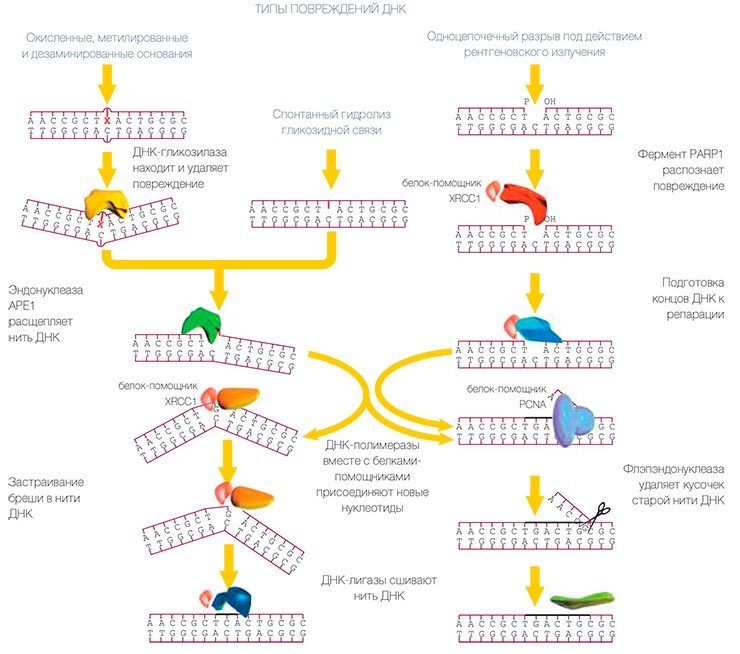
В самом начале конвейера находится несколько ферментов, ДНК-гликозилаз, которые находят поврежденное основание и удаляют его*. Некоторые из них находят и удаляют несколько различных типов поврежденных оснований, т. е. умеют «скусывать» с ниточки ДНК по-разному поврежденные «бусины», не разрезая самой ниточки. Другие же «замечают» только какой-то определенный тип повреждения.
Затем фермент апуриновая/апиримидиновая эндонуклеаза (АРЕ1) делает разрез в ниточке так, чтобы другой фермент, ДНК-полимераза бета, мог присоединить новую неповрежденную «бусинку» вместе с кусочком ниточки, да еще и «подравнять» ее, удалив кусочек, оставшийся от испорченной бусинки (т. е. рибозофосфатный остаток с противоположной стороны разрыва ДНК). Поскольку вторая цепочка ожерелья цела, то ДНК-полимераза, соответственно, выбирает из запаса не первую попавшуюся заготовку, а строго соответствующую (т. е. комплементарную) бусинке, находящейся напротив повреждения в цепи ДНК. ДНК-лигаза сращивает концы ниточки и теперь уже невозможно догадаться, что это ожерелье было починено.
Описанный механизм — самый простой путь эксцизионной репарации оснований, называемый «короткозаплаточным», поскольку в итоге происходит замена только одной «бусинки». Именно так системой ЭРО в основном исправляются повреждения. В этом процессе также участвуют вспомогательные белки, сами не выполняющие отдельные операции, но помогающие другим белкам сделать дело наилучшим образом. К числу таких помощников относится, например, белок c загадочным названием XRCC1, обеспечивающий устойчивость к рентгеновскому излучению: клетки, лишенные этого белка, более чувствительны к действию ионизирующей радиации, и репарация ДНК в них происходит хуже.
Как можно заметить, ЭРО — довольно экономный и хорошо отлаженный способ починки. Но не всегда дело идет так «штатно». Если оставшийся от поврежденной «бусинки» «кусочек ниточки», который должна удалить ДНК-полимераза бета, тоже был поврежден, то его удаления не происходит, и клетка переключается на другой путь репарации.
При этом клетка может использовать помощь других белковых машин, например тех ДНК-полимераз, которые обычно занимаются не починкой, а сборкой новых нитей ДНК. Такие ДНК-полимеразы вместе с белком-помощником (PCNA) работают быстрее и меньше ошибаются, выбирая тип заготовки-бусинки. Старая цепочка вытесняется из ожерелья и образует свисающий «хвост». Тут-то и требуется участие еще одного белка, который удалит «хвост». Этот фермент — флэпэндонуклеаза (FEN1) — также из машины репликации и лучше выполняет свою работу, взаимодействуя с PCNA.
Данный механизм, открытый немного позднее, был назван «длиннозаплаточным путем», поскольку замещается кусочек ДНК, состоящий не из одного, а из нескольких нуклеотидов. В этом случае для зашивания конечного разрыва используется еще один «репликативный» фермент — ДНК-лигаза. Сходным образом ремонтируется ДНК, в которой возникли разрывы вследствие воздействия ионизирующей радиации. В процессе, как правило, требуется участие еще одного фермента, полинуклеотидкиназы, роль которой заключается в создании определенной структуры концов «ниточки», удобной для работы ферментов ДНК-полимераз и ДНК-лигаз.
Плохо — когда очень мало или очень много
При эксцизионной репарации нуклеотидов (ЭРН) рядом с опознанным повреждением ДНК собирается ансамбль белков, который осуществляет «раскрытие» структуры ДНК вблизи повреждения, а затем его последующее удаление. Повреждение удаляется вместе с куском нормальной ДНК.
Считается, что за опознавание повреждения ответственность несет белок, который обозначается буквами XPC-HR23B. (Характерно, что многие из белков этого ансамбля имеют обозначения, начинающиеся буквами XP. Происхождение этих обозначений связано с пигментной ксеродермой (xeroderma pigmentosum), которая проявляется в повышенной чувствительности к действию солнечного света, что связано с отсутствием одного из белков ЭРН.)
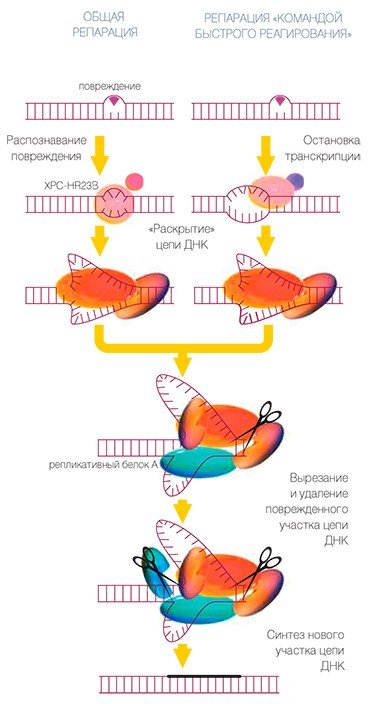 Белки этой репарационной машины занимают свои места в определенном порядке, и «посадка» каждого белка облегчает следующему участнику процесса выполнение задачи. Работа, заключающаяся в вырезании кусочка ДНК длиной около 30 нуклеотидных остатков, идет слаженно. Геликазы со своими помощниками разводят цепи ДНК, репликативный белок А (RPA) покрывает и удерживает неповрежденную нить. Нуклеазы со своими помощниками делают два надреза нити по обеим сторонам от повреждения. Разрезы проводятся так, чтобы образовавшиеся кончики нити в дальнейшем были удобны для восстановления поврежденного участка машиной репликации. Вырезанный кусочек можно удалить — и тогда дело сделано наполовину, а именно: проведены подготовительные работы для восстановления утраченного куска.
Белки этой репарационной машины занимают свои места в определенном порядке, и «посадка» каждого белка облегчает следующему участнику процесса выполнение задачи. Работа, заключающаяся в вырезании кусочка ДНК длиной около 30 нуклеотидных остатков, идет слаженно. Геликазы со своими помощниками разводят цепи ДНК, репликативный белок А (RPA) покрывает и удерживает неповрежденную нить. Нуклеазы со своими помощниками делают два надреза нити по обеим сторонам от повреждения. Разрезы проводятся так, чтобы образовавшиеся кончики нити в дальнейшем были удобны для восстановления поврежденного участка машиной репликации. Вырезанный кусочек можно удалить — и тогда дело сделано наполовину, а именно: проведены подготовительные работы для восстановления утраченного куска.
Вот теперь можно использовать помощь белков ансамбля репликации: ДНК-полимеразы со своими белками-«ассистентами» по одному звену наращивают недостающий кусочек ДНК на основе информации неповрежденной нити ДНК, а ДНК-лигаза ликвидирует разрыв нити. Дело сделано, но и на этом пути репарации не все однозначно.
Существует два вида ансамблей белков, несколько различающихся по составу и специализации. Одни занимаются тем, что постоянно отслеживают состояние всех нитей ДНК и ремонтируют их по мере необходимости. Другой же ансамбль представляет собой «команду быстрого реагирования». Она вступает в игру тогда, когда фермент РНК-полимераза (также вместе с белками-помощниками: разве что-нибудь стоящее можно сделать в одиночку?) начинает собирать на нити ДНК другую нуклеиновую кислоту — так называемую матричную РНК, — которая и является инструкцией для синтеза конкретного белка**. Если в ДНК есть громоздкое повреждение, которое мешает РНК-полимеразе правильно прочитать информацию и записать ее в инструкцию, процесс останавливается: тут-то и приглашается «команда быстрого реагирования», чтобы исправить повреждение примерно тем способом, который описан выше.
Работы еще двух систем, специализирующихся на репарации двуцепочных разрывов в ДНК, мы не будем касаться — это тема другого разговора.
Для правильной и своевременной репарации ДНК важно не только наличие в клетке всех белков, участвующих в этих процессах, но и их количество: опасны как недостаток (или отсутствие) белков, так и их избыток. Чем же грозят человеку дефекты в системах репарации ДНК? Подобные заболевания протекают, как правило, тяжело (самое известное из них — вышеупомянутая пигментная ксеродерма), но встречаются они достаточно редко.
Заболевания человека, однозначно связанные с функциональной неактивностью какого-либо из белков системы ЭРО, на сегодня вообще не известны. Это может быть обусловлено высокой значимостью описанного пути репарации, выражающейся в нежизнеспособности организмов с подобными дефектами.
В то же время для многих патологических состояний характерны изменения в количестве белков, причем как в большую, так и в меньшую сторону. Так, для некоторых типов раковых клеток характерны увеличенные количества ДНК-полимеразы бета и АРЕ1. Казалось бы, что плохого, если в клетке много ферментов репарации? Однако резкое изменение активности (количества), например ДНК-полимеразы бета, может приводить к тому, что она начинает «совать нос не в свое дело», замещая более точно функционирующие ДНК-полимеразы, а это приводит к нестабильности генетической информации.
Пришиваем этикетку к белку
Для исследования комплексов белков, относящихся к системам репликации и репарации ДНК, а также для поиска новых участников этих процессов ученые используют метод так называемой фотоаффинной модификации белков, разработанный в Институте химической биологии и фундаментальной медицины СО РАН. «Аффинная» означает «основанная на сродстве». Имеется в виду способность ДНК образовывать специфические комплексы с белками, участвующими в определенных реакциях.
Ученым удалось сконструировать и синтезировать аналоги дезоксинуклеозидтрифосфатов (заготовок, используемых ДНК-полимеразами при синтезе ДНК), обладающие следующими замечательными свойствами: они несут дополнительные химические группы, которые при облучении ультрафиолетовым светом активируются и могут присоединяться к белкам с образованием стабильной связи. Фотоактивные группы введены в основание таким образом, чтобы не мешать работе ДНК-полимераз, которые могут встраивать эти фотоактивные «бусины» в состав ДНК.
Теперь, если мы облучим УФ-светом смесь, содержащую фотоактивную ДНК и белки, те из белков, которые находятся в специфическом комплексе с ДНК, будут присоединены к ней прочной связью. Так белок приобретает «этикетку» в виде кусочка ДНК.
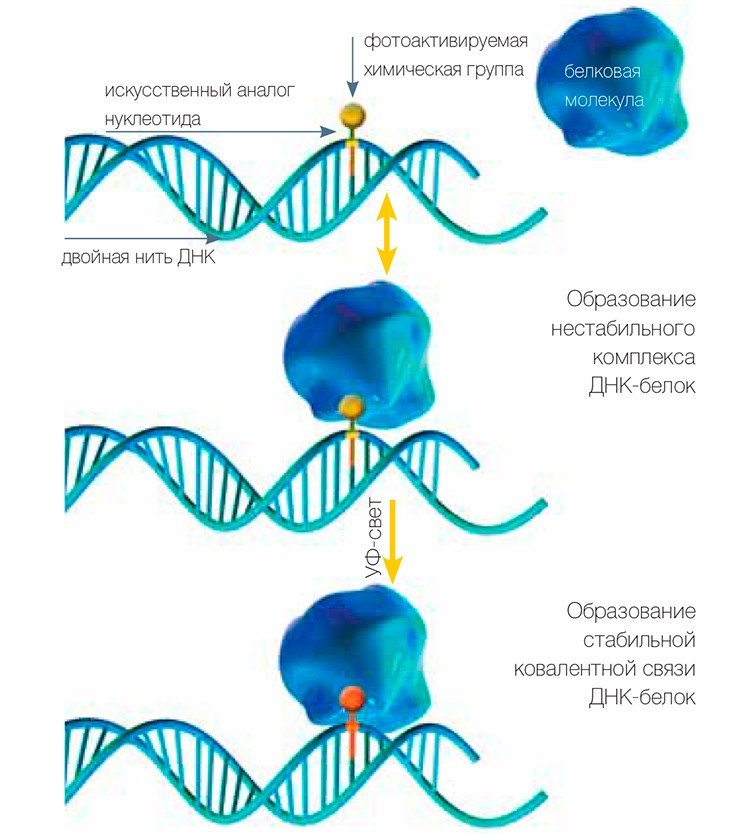
В результате исследователи убивают сразу двух зайцев. Во-первых, поскольку в состав ДНК входят атомы фосфора, мы можем ввести в ее состав радиоактивную метку (обычно это изотоп фосфора 32Р), что дает возможность легко следить за этой меткой при последующем анализе. Радиоизотопные метки регистрируются с высокой чувствительностью, что позволяет работать с очень маленькими количествами белков. Во-вторых, присутствие этикетки на белке свидетельствует о том, что этот белок способен взаимодействовать с определенными структурными образованиями ДНК, характерными для того или иного этапа процесса репарации.
Используя этот метод, ученые ИХБФМ установили, что, к примеру, из тысяч белков, содержащихся в экстракте из клеток мыши, только шесть оказались радиоактивно меченными фотоактивными ДНК, по структуре схожими с участками ДНК, которые «ремонтируются» системой ЭРО. Среди них наши «старые знакомые» — ДНК-полимераза бета, флэпэндонуклеаза, апуриновая/апиримидиновая эндонуклеаза, — об участии которых в этом пути репарации хорошо известно.
Помочь в идентификации белка, помеченного с помощью метода аффинной модификации, могут современные чувствительные технологии. В качестве ДНК-«этикетки» можно использовать специфические ДНК, содержащие АР-сайт, т. е. «дырку» на месте одного азотистого основания, возникающие как промежуточные соединения при эксцизионной репарации. Сахар дезоксирибоза в составе АР-сайта может образовывать с определенными аминокислотами белка химические связи, которые становятся стабильными при восстановлении боргидридом.Для отделения подобного комплекса используется очень изящный и остроумный прием. Предварительно в состав ДНК вводят биотин (витамин Н или B7), способный очень прочно связываться с белком куриного яйца авидином или бактериальным белком стрептавидином. Если закрепить тот же стрептавидин на какой-нибудь поверхности, а затем нанести на нее раствор с биотинилированной ДНК, то последняя будет удерживаться, не смываясь водными растворами. Так можно «заякорить» и ДНК с пришитым белком. Стрептавидин закрепляют на мелких парамагнитных шариках, при отмывке удерживамых с помощью магнита.
Оставшийся на шариках продукт снимают и отделяют от примесей электрофорезом в полиакриламидном геле. Кусочек геля, содержащий белок с пришитой ДНК, вырезают и прямо в геле «нарезают» на кусочки-пептиды ферментами, например трипсином, строго в определенных местах.
Массы образовавшихся пептидов определяют очень чувствительным методом масс-спектрометрии MALDI-TOF-MS. В результате анализа определяется «пептидная карта» белка. Затем с помощью программного обеспечения (Mascot или Profound) производится идентификация белка, для чего в анализируемом образце массы пептидов сравниваются с теоретически рассчитанными массами для всех белков, занесенных в базу данных. Обработав огромный массив данных, программа выбирает наиболее вероятных кандидатов. Несмотря на то что пептиды с одинаковыми массами могут встречаться в разных белках, сочетание пептидов определенной массы в образце позволяет надежно установить природу анализируемого белка
Природу еще одного белка удалось установить с использованием других методов, в том числе специфических антител. Этим белком оказался фермент поли (АДР-рибозо) полимераза 1 (PARP1). Он обнаруживает разрывы в нити ДНК, образуя димеры (пары), и в ответ синтезирует разветвленный отрицательно заряженный полимер (поли(АДР)рибозу), прочно присоединенную к некоторым ядерным белкам. Самое поразительное, что одна молекула PARP1 синтезирует этот полимер на втором участнике пары. Так возникает внутриклеточный сигнал: «Внимание! Здесь в ДНК появился разрыв. Требуется помощь».
Как следствие, в клетке «запускается» каскад событий, который, в конечном счете, приводит к исправлению повреждения. Если же повреждений очень много, то происходит «гиперактивация», т. е. наработка большого количества «сигнала». Это истощает энергетические запасы клетки, и в ней формируется другой «сигнал»: возможности ремонта ДНК исчерпаны — клетка подлежит уничтожению. В ответ на этот сигнал в клетке вступают в действие программы ее самоуничтожения, поскольку клетки с нарушениями ДНК могут становиться родоначальниками опухолевых.
Еще два из меченых белков пока сохраняют свое «инкогнито», но работа по установлению их «личности» продолжается. Сегодня ученые научились точно и быстро устанавливать последовательность и в принципе «прочитали» все генетические «тексты», записанные в ДНК человека, однако функции далеко еще не всех белков, которые клетки могут синтезировать, установлены— это огромное поле деятельности для современных и будущих исследователей.
*См. в: НАУКА из первых рук. — 2006. — № 6 (12). — С. 24—35.
**См. в: НАУКА из первых рук. — 2006. — № 6 (12). — С. 46—53.