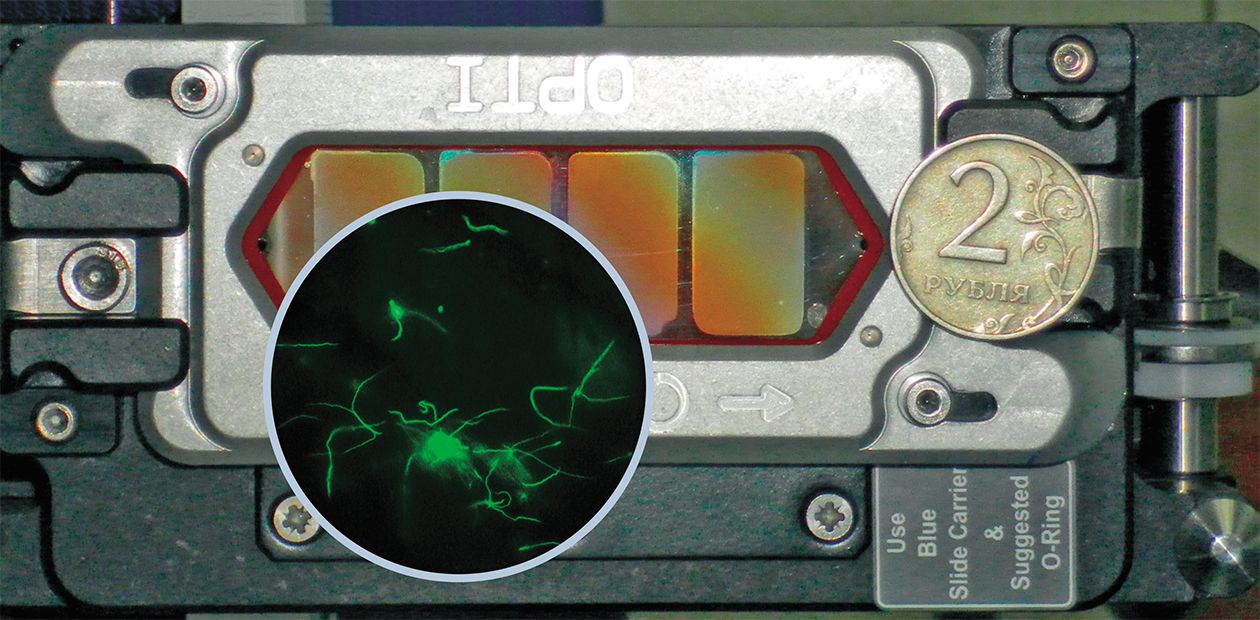
Расшифрован геном боррелии – возбудителя болезни Лайма
В 2011 г. в Институте химической биологии и фундаментальной медицины СО РАН (Новосибирск) был полностью расшифрован геном типичного для России патогенного вида боррелии, выделенной из иксодового клеща сотрудниками томского предприятия НПО «Вирион»
Исследования заболеваний, переносимых клещами, с каждым годом становятся все более актуальными: только в 2011 г. в России было зарегистрировано около полумиллиона случаев укуса клеща. При этом человек может заразиться не только широко известным вирусным клещевым энцефалитом, но и другой, не менее опасной, бактериальной инфекцией – клещевым боррелиозом, или болезнью Лайма.
Боррелиоз – полисистемное заболевание, при котором может поражаться кожа, опорно-двигательный аппарат, нервная и сердечно-сосудистая система. Если сразу не начать лечение, болезнь переходит в хроническую форму, которая лечится значительно дольше, сложнее и не всегда эффективно – заболевшему часто грозит инвалидность из-за тяжелого повреждения тканей и органов. Вакцин же, предохраняющих от этого заболевания, в настоящее время не существует.
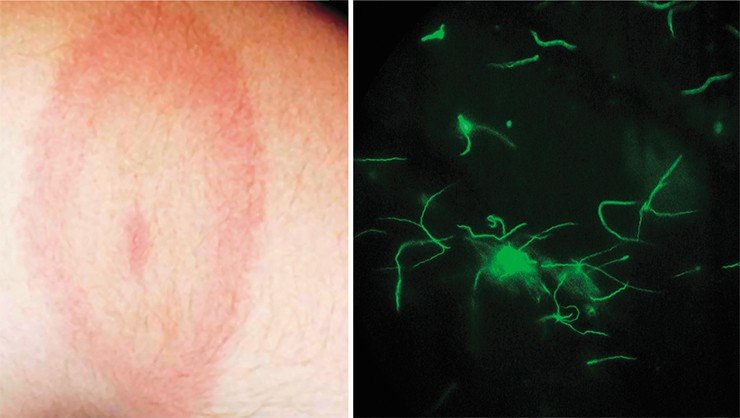
Чтобы своевременно оказать необходимую медицинскую помощь при боррелиозе, требуется быстрая и точная молекулярно-генетическая диагностика заболевания. Однако сделать это не так просто, так как в разных регионах для человека патогенны различные виды боррелий, которые к тому же могут отличаться большим внутривидовым генетическим разнообразием. Это затрудняет, к примеру, использование в Сибири диагностических систем, разработанных в США или Европе.
Ключевой точкой при разработке современных средств диагностики, профилактики и терапии заболевания болезни является исследование генома (полной совокупности наследственного материала) возбудителя. В идеале следует осуществлять секвенирование – определение последовательности нуклеотидов в ДНК – всего генома инфекционного агента. Соответственно, для разработки диагностических систем, вакцин и методов лечения, специфичных и эффективных в первую очередь в отношении боррелий, типичных для России, требуется секвенировать геномы местных генетических вариантов бактерий. Но еще до недавнего времени подобные работы были бы чрезвычайно дорогими и трудоемкими.
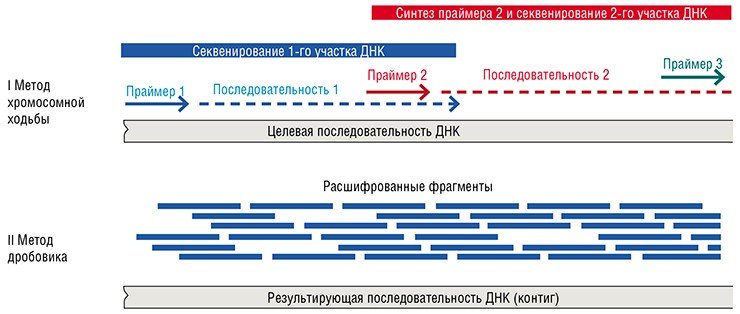
Чтобы упростить и ускорить процесс секвенирования протяженных участков ДНК, была предложена стратегия, получившая название «метод дробовика». Суть ее в том, что последовательность исходной ДНК (контиг) определяется на основе множества расшифрованных перекрывающихся коротких фрагментов. В рамках этой стратегии, однако, требуется получить суммарное количество данных, в разы превышающих данные относительно самой исходной последовательности! За кажущейся простотой и изящностью этого подхода скрывалась немалая решимость исследователей, ведь он был предложен и опробован в то время, когда стоимость определения одного нуклеотида составляла несколько долларов. К тому же не существовало ни эффективных алгоритмов сборки целевой ДНК из коротких последовательностей, ни достаточно мощных вычислительных машин, способных эту сборку выполнять. Неудивительно, что секвенирование генома человека, начатое в 1990-х годах, потребовало 13 лет скоординированных усилий сотен людей из десятков научных организаций нескольких стран.
ИЗ ДРОБОВИКА – ПО ГЕНОМАМСуть второй стратегии секвенирования, названной «метод дробовика», заключается в том, что целевая ДНК первоначально фрагментируется случайным образом. Фрагменты клонируются в векторные молекулы ДНК, размножаются в бактериальном штамме и секвенируются по методу Сэнгера с использованием универсального праймера. Целевая последовательность затем восстанавливается на основе перекрывающихся последовательностей коротких фрагментов. При этом суммарная длина секвенируемых последовательностей обычно в разы превышает длину целевой ДНК
Однако ситуация радикально изменилась в XXI в., когда на основе накопленного опыта были разработаны принципиально новые технологии массового параллельного секвенирования. В основе существующих сегодня подобных технологий лежат разные процессы, но все их объединяет одно: секвенирование производится одновременно в миллионах микроскопических реакционных областях. Таким образом, в ходе единственного эксперимента прочитываются миллионы индивидуальных коротких последовательностей, которые затем можно использовать для сборки протяженных последовательностей методом дробовика. При этом расход времени, реактивов и, в конечном счете, денег в пересчете на один нуклеотид на порядки меньше, чем при традиционном секвенировании по Сэнгеру. Так появилась реальная возможность быстро и недорого секвенировать целые геномы.
Специалисты новосибирского Института химической биологии и фундаментальной медицины СО РАН имеют немалый опыт в этой области: здесь еще в 1989 г. был секвенирован геном вируса клещевого энцефалита. Однако геном боррелии более чем в 100 раз больше и намного сложнее организован.
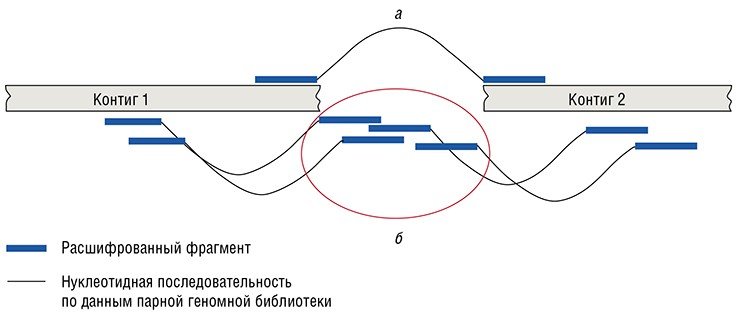
Геномы даже таких простейших организмов, как боррелии, как правило, обычно содержат несколько репликонов (наследственных единиц, автономно копирующихся при клеточном делении) – хромосом или плазмид. При этом в таком геноме, как правило, имеются области, дублированные несколько раз (сателлитная ДНК, гены рибосом и т. д.). Это приводит к тому, что целевые нуклеотидные последовательности, полученные методом дробовика, оказываются короче, чем должна быть полная последовательность.
«Разрыв» последовательностей происходит как раз в местах, содержащих дубли. В ряде случаев завершение полной расшифровки таких геномов оказывается теоретически возможным, но требует привлечения традиционной техники секвенирования по Сэнгеру для миллионов последовательностей, т.е. огромных дополнительных ресурсов. По этой причине очень часто секвенирование генома объявляется завершенным еще до того, как будут получены неразрывные достоверные последовательности всех его репликонов. Например, геном человека до сих пор представлен сотнями нуклеотидных последовательностей, которые покрывают около 95 % его реальной протяженности.
Однако иногда подобную ситуацию можно разрешить проще, используя так называемые «парные геномные библиотеки». На концах каждой молекулы такой библиотеки находятся разные фрагменты целевого генома. Расстояние между этими фрагментами известно и задается исследователем. Секвенирование таких библиотек позволяет расположить расшифрованные последовательности в правильном порядке и ориентации, а в ряде случаев – еще и заполнить промежутки между ними.
Для повышения качества результатов секвенирования оптимально использовать комбинацию различных методов, каждый из которых обладает уникальными преимуществами. Секвенирование генома сибирского вида боррелии (B. garinii BgVir), выделенного в НПО «Вирион», в ИХБФМ производили методом массового параллельного секвенирования на платформах Roche (фрагментная геномная библиотека) и SOLiD (парная геномная библиотека).

С помощью пиросеквенатора Roche можно секвенировать длинные (около 400 п. н.) нуклеотидные последовательности и определять структуру тех районов генома, которых нет в уже расшифрованных геномах даже наиболее близких видов. Использование же платформы SOLiD дает возможность при минимальных затратах получать сколь угодно большое покрытие геномов любого размера и, при использовании парных библиотек, закрывать районы, не покрытые данными других платформ.
Такой подход позволил новосибирским исследователям использовать преимущества и нивелировать недостатки каждой из платформ. Окончательная сборка последовательностей, поиск в них генов и анализ отличий секвенированного генома от ранее известных проводился с использованием разработанных в институте программных алгоритмов на приборной базе ЦКП «Биоинформатика». При сравнительном анализе с другими видами боррелий удалось выявить ряд структурных различий, затрагивающих в том числе гены поверхностных белков и некоторых ферментов, и определить набор генов, уникальных для генома B. garinii BgVir.
Опыт, накопленный сибирскими исследователями в области секвенирования относительно более простых вирусных и бактериальных геномов, дает им возможность в дальнейшем не только с успехом заниматься расшифровкой вирусных и бактериальных геномов, но и начать работу с более сложно организованными геномами высших организмов.
К. б. н. Е. В. Бреннер, А. М. Курильщиков, к. б. н. Н. В. Фоменко (Институт химической биологии и фундаментальной медицины СО РАН, Новосибирск)
Литература
Фоменко Н. А. Клещевой боррелиоз: болезнь на всю жизнь? // Наука из первых рук. 2007. № 3(15). C. 44—51.